Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...

- Категория: Система RH
Фенотип Du описан Stratton в 1946 г. [631] как новый вариант антигена системы резус, слабо реагирующий с сыворотками анти-D. Частота Du у европеоидов около 0,1 %. Находку подтвердили многие авторы [202, 218, 266, 329, 339, 429, 561]. Вскоре выяснилось, что различия между антигеном D и Du имеют количественный, а не качественный характер [548, 578, 635]. Эритроциты Du адсорбировали анти-О-антитела в меньшей степени, чем обычные эритроциты D+, однако снятый с них элюат не проявлял какой-либо особой анти-Ои-специфичности.
Эритроциты Du не реагируют в реакции солевой агглютинации с полными IgM анти-О-антителами, но реагируют с неполными IgG анти-О-антителами в коллоидных тестах, непрямой антиглобулиновой пробе. В ферментных методах они реагируют слабее (Stratton [632]). В отдельных случаях, при очень слабой выраженности антигена Du, его выявляют только непрямой антиглобулиновой пробой. Третьим элементом, отличающим фенотип Du от D, является присутствие в этих эритроцитах примерно в 98 % случаев сильновыраженного антигена С.
Первоначальное обозначение Du, данное Stratton, в настоящее время заменено общим понятием «слабый D-антиген», или «слабый D-фенотип». Современные моноклональные реагенты анти-D агглютинируют большинство образцов крови, которые раньше при использовании поликлональных сывороток были бы отнесены к слабому D-типу.
Эксперименты с поли- и моноклональными анти-О-антителами показали, что эритроциты D+ лиц CDe/cde и cDE/cDE несут соответственно около 10 тыс. и 30 тыс. участков антигена D на 1 эритроцит [364, 568]. На эритроцитах лиц Cde/cDue со слабым D-антигеном число антигенных участков снижено до 300 [648].
Beckers и соавт. [159] исследовали 6 человек со слабым D-антигеном и установили, что число участков антигена D у них составило от 500 до 1000 на одну клетку; 4 обследованных имели фенотип D+C+c+E-e+, 2 - D+C-c+E+e+, т. е. не содержали антигена С. Все 6 человек имели ген RHD, который был абсолютен нормальным при исследовании в Саузерн-блоте и ПЦР. Авторы не пришли к какому-либо определенному выводу относительно механизма низкой (антигена D на эритроцитах исследованных людей. ВозможнЛэто связано с неэффективной транскрипцией или трансляцией участков нормального гена или другими механизмами, обусловливающими подавление продукции антигена.
По данным разных авторов, в среднем число антигенных участков на эритроцитах со слабым D, снижено до 5-10 % от нормального уровня [157,187,648]. рНВ литературе обсуждаются 3 возможных механизма появления слабого фенотипа D.
Первый механизм обусловлен позицией транс генов С и D. В 1952 г. появилось сообщение Ceppellini и соавт. [204] о том, что у некоторых людей гаплотип Cde снижает продуктивность гена Д расположенного на другой хромосоме, т. е. находящегося по отношению к гену С в позиции транс. Слабый D-фенотип часто обнаруживают у лиц с генотипом CDe/Cde и cDe/Cde [218, 329, 339,429].
Феномен ингибиции гена Д расположенного на одной хромосоме, генным комплексом Cde гомологичной хромосомы подтвержден другими авторами.
Гаплотип CdE в положении транс, как считают McGee и соавт. [470], так же как и гаплотип Cde, вызывает уменьшение продукции D-антигена.
То, что слабый D-антиген формируется в результате супрессирующего влияния гена С, стало ясно из семейных исследований. Ген D родителей, имевших слабый D-фенотип, кодировал у детей продукцию нормального D-антигена, когда передавался им по наследству с геном С в позиции цис. Наследование гена С в позиции транс сочеталось со слабым D-фенотипом.
Еще одно подтверждение высказанного положения: известно, что эритроциты лиц cDE/cDE, лишенные гена С, несут от 16 000 до 33 000 участков антигена D на одну клетку, а лица CDe/CDe - меньшее число антигенных участков - от 14 000 до 19 000.
Таким образом, существование слабого D-фенотипа у лиц, имеющих нормальный ген RHD, объясняется тем, что на экспрессию антигена D влияет ген С другого гаплотипа RH. Однако это правило не является абсолютным. Некоторые лица Cde/cDe имели слабый D-антиген, а на эритроцитах других людей с таким же генотипом D-антиген был выражен нормально [218, 612].
Второй механизм появления слабого D, серологически неотличимого от формы Du, обусловлен отсутствием на полипептиде Rh некоторых эпитопов D. Необходимо отметить, что отсутствие одного или даже нескольких эпитопов не всегда проявляет себя как слабый D-фенотип. Большая часть эритроцитов с парциальными D-антигенами реагирует с анти-О-сыворотками так же активно, как если бы на веществе Rh присутствовали все эпитопы D [660, 661].
Третий механизм формирования слабого D связан с функцией редкого, с частотой менее 0,1 %, аллеля RHD, который кодирует продукцию всех эпитопов D, но в меньшем количестве, чем обычно должно быть представлено на эритроцитах 'ШШ Такой тип слабого D хорошо прослеживается при семейных исследованиях,
дается от родителей детям [394,631,635]. При данном типе слабого D ген D не зависит от влияния гена С в положении транс или цис.
Молекулярно-биологические исследования лиц со слабым D-фенотипом позволили установить типичную для JWD-гена последовательность матричной
РНК с нормальной промоторной областью. Однако сравнительные исследования с помощью ПЦР показали, что количество 1)-специфического транскрипта у лиц со слабым D уменьшено. Низкая экспрессия D-антигена при слабом фенотипе D обусловлена, как полагают Beckers и соавт. [157] и Rouillac и соавт. [582], не мутациями в кодирующей последовательности RHD-гет, а уменьшением активности матричной РНК.
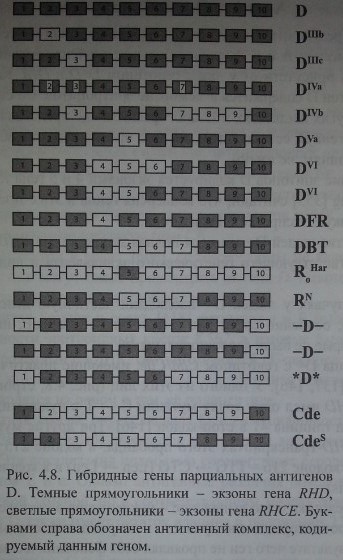
Другие исследователи (Wagner и соавт. [692]) отметили, что все образцы геномной ДНК, полученные от 16 лиц со слабым фенотипом D, высокогетероген-ны. Некоторые экзоны (4 и 5) в результате генной конверсии частично были замещены соответствующими последовательностями, характерными для RHCE-гена. Аминокислотные замены наблюдались в трансмембранном и внутриклеточном сегментах протеина, но они не затрагивали экзофациалыгую часть, определяющую антигенную специфичность (табл. 4.11).
Считается, что при фенотипе Du имеется селективная депрессия участков гена D. При этом ген Сс/Ее не затронут. Указанная выборочная депрессия не связана с каким-либо повреждением структуры гена D и его промоторной последовательности в области от -600 до +41. Как показали Rouillac и соавт. [582], транскрипты генов D и Du имели нормальную аминокислотную последовательность, однако уровень D-экспрессии транскриптов у доноров Du был в 4-5 раз ниже, чем в образцах с обычным фенотипом D. Экспрессия транскриптов СБ-гена была одинакова для лиц Du и D+.
Не поврежденные по сравнению с нормой гены D и СЕ обнаружены у некоторых лиц с фенотипом и Rhnull [214,233], что указывает на существование неизвестного пока регуляторного механизма помимо /?#-генного кодирования, который может влиять на экспрессию антигенов.
Вскоре после открытия Du появились сообщения, что эритроциты со слабым D после трансфузии реципиенту D- могут вызвать у него продукцию анти-D-антител (Rosenfield и соавт. [578]), а реципиенты со слабым D-антигеном после переливания им резус-положительной крови с нормально выраженным антигеном D могут вырабатывать резус-антитела (Argall и соавт. [139]).
Ruffie и Carriere [588] получили анти-О-антитела в результате искусственной иммунизации добровольцев эритроцитами Du.
В связи с подобными, однако не столь многочисленными наблюдениями, свидетельствующими об иммуногенности Du, людей со слабым D-антигеном принято относить к D- если они являются реципиентами. Если люди со слабо выраженным D-антигеном (Du) являются донорами, их причисляют к резус-положительным и их эритроциты переливают только резус-положительным больным.
Длительное время оставалось непонятным, почему в сыворотке крови лиц со слабым D-антигеном, имеющим количественное, но не качественное отличие от обычного D-антигена, могут присутствовать антитела анти-D.
Pietrusky [526] высказал предположение, что антиген D неоднороден и состоит из многочисленных парциальных вариантов: Dp D2, D3 и т. д. Полный набор парциальных вариантов соответствует полноценному D-антигену. Отсутствие какого-либо парциального фактора или одновременно нескольких факторов приводит к появлению ослабленных форм.
Лица, лишенные определенных парциальных антигенов, могут вырабатывать по отношению к ним антитела. В свою очередь сыворотки анти-D, по мнению Pietrusky, также могут содержать по отдельности или в разных комбинациях антитела анти-D , анти-02, анти-03 и т. д. В связи с этим эритроциты со слабым D по-разному реагируют с набором сывороток анти-D. Некоторые образцы эритроцитов Du агглютинируются одними и слабо или вовсе не агглютинируются другими сыворотками, показывая большое разнообразие форм.
Серологические свойства эритроцитов Du подробно изучены Т.М. Пискуновой [85, 86], обнаружевшей, что агглютинабельность эритроцитов Du у разных лиц носителей этого фенотипа неодинакова. Она варьирует от очень слабой, выявляемой в антиглобулиновой пробе, до средней степени выраженности. В последнем случае антиген D может быть выявлен с помощью желатинового и других методов с применением коллоидов, а также в реакции агглютинации в солевой среде.
[Эритроциты со слабым D характеризуются низкой авидностью антигена и сниженной адсорбцией как полных, так и неполных анти-Б-антител. О низкой авидности антигена Du можно судить по более легкой элюции антител анти-D с эритроцитов этого типа. В элюатах обычно присутствуют анти-О-антитела, идентичные тем, которые имелись в сыворотках, взятых для адсорбции. Элюаты с эритроцитов Du и D по специфичности не отличаются. Последнее обстоятельство указывает на то, что антигены Du и D качественно однородны. Какие-либо специфические анти-Ои-антитела не найдены.
Сегодня имеются все основания полагать, что лица, чей фенотип Du обусловлен генной ингибицией полипептида D (позиция транс гена RHC), а также лица, чей фенотип Du обусловлен аллельным геном D", не могут вырабатывать анти-О-антитела, поскольку содержат все эпитопы D-антигена, хотя и в ослабленной форме. Антитела анти-D (парциальные) могут вырабатывать лишь те люди, чей фенотип слабого, а также нормально выраженного D обусловлен отсутствием нескольких важных для экспрессии антигена D эпитопов. Подобные варианты антигена правильнее относить к группе парциальных D-антигенов, а не к категории слабых D-фенотипов (собственно Du). Такое разграничение принципиально важно для оценки значения этих двух групп антигенов в транс-фузиологии, поскольку специфические антитела к парциальным антигенам D являются реальностью, а антитела к антигену Du до сих пор не найдены.
В настоящее время признано (Mollison и соавт. [476]), что продукция анти-D-антител лицами со слабым D-антигеном, получившими переливание крови D+, относительно редкое явление. Подавляющее большинство людей D+ не могут образовывать аллоиммунных анти-Б-антител. Такой же редкой является пгюдукция резус-антител лицами cde/cde после переливания им эритроцитов со слабым фенотипом D. о сводке Schmidt, Morrison и Shohl (цит. по Issitt и Anstee [374]), 45 реципиентам D- было перелито 68 доз крови со слабым D и ни у одного из них не выработались анти-О-антитела. Крайне редко слабый D-антиген становился причиной гемолитической болезни новорожденных. Тем не менее, большинство специалистов-трансфузиологов разделяют мнение о том, что лиц Du следует рассматривать как резус-положительных доноров, но как резус-отрицательных реципиентов.
Относительно применения у родильниц с фенотипом Du иммуноглобулина анти-D с профилактической целью мнения расходятся. Одни авторы [394] полагают, что его назначать не следует в связи с редкостью такой сенсибилизации, а также с тем, что введенный препарат скорее всего адсорбируется на эритроцитах женщины и не выполнит ожидаемой защитной функции. Другие высказывают опасение, что при рутинном определении резус-фактора в родильном Тв родильницы Du будут фенотипированы как Rh- и им будет введен этот препарат понятно, что решение о введении анти-Б-иммуноглобулина родильницам с фенотипом Du требует индивидуального подхода и тщательного имму-носерологического обследования женщины в каждом конкретном случае.
- Категория: Система RH
Можно ожидать, что эритроциты людей с генотипом cDE/cDE будут нести больше антигенных участков сиЕ, чем эритроциты с генотипом Cde/cDE, потому что человек cDE/cDE имеет 2 гаплотипа, кодирующих продукцию этих антигенов, а человек Cde/cDE - только один. Точно также лица CDe/CDe должны иметь в эритроцитах больше антигена С, чем лица CDe/cDe.
Разницу в количестве антигена иногда можно обнаружить титрованием сыворотки анти-с, анти-Е или анти-С с соответствующими эритроцитами. При этом сыворотки нередко имеют более высокий титр с клетками, несущими двойную дозу антигена, и агглютинация с ними может быть выражена сильнее. Однако такой метод установления гомо- или гетерозиготности неточен из-за значительной вариабельности числа реагирующих антигенных участков на эритроцитах людей с, казалось бы, одинаковым генотипом. Кроме того, далеко не со всеми сыворотками выявляют дозозависимый эффект.
Измерение количества того или иного антигена Rh у близких родственников позволило получить более точные результаты, так как имелась возможность с помощью серологических проб установить, кто из членов семьи гомо-, а кто гетерозиготен по гену Д и замерить с помощью подобранных сывороток количество антигена у этих лиц в сравнительном аспекте. Ген D в одной или двух копиях у детей в пределах одной семьи очень точно дозирует одинарную и двойную порцию антигена [393, 576].
Lewis и соавт. [438], Chown, Lewis [218] предложили способ определения гомо- и гетерозиготного варианта гена D по скорости реакции эритроцитов со специально стандартизированными для этой цели сыворотками анти-D. Другие исследователи [463] различали гомо- и гетерозигот по количеству анти-D-антител, адсорбированных на их эритроцитах, используя для этого антигло-булиновые сыворотки, меченные ферритином. Такие методы в достаточной степени приемлемы для идентификации гомо- и гетерозиготного варианта гена D у членов одной семьи, но дают весьма противоречивые результаты при определении зиготности гена D у людей, не связанных родством.
Установление гомо- и гетерозиготности гена D и других генов групп крови имеет значение для прогнозирования ГБН у женщин, имеющих аллоиммунные антиэритроцитарные антитела (как правило, анти-D) и ранее родивших детей с ГБН. В таких случаях важно выяснить, является ли муж гомо- или гетерозиготным по гену D. В случае, если он гетерозиготен, например CDe/cde, а предыдущая беременность женщины закончилась рождением ребенка Rh+, то с вероятностью 75 % можно прогнозировать, что при следующей беременности плод будет Rh-f*. Если при второй беременности, вопреки ожиданиям, снова родился ребенок Rh+, то возможность рождения ребенка Rh- в третий раз возрастает до 90 %. В том случае, когда муж гомозиготен по гену Д все дети будут резус-положительными и родить здорового ребенка в такой семье будет проблематично, если вовремя не предпринять соответствующие меры: патронаж с ранних сроков беременности, наблюдение за динамикой антител, досрочное родоразре-шение кесаревым сечением.
В последние годы разработаны более надежные методы определения зи-готности в супружеских парах, а также методы определения резус-принадлежности плода на ранних стадиях беременности по ДНК амниоцитов.
Наиболее надежным методом измерения количества антигенов Rh на эритроцитах как членов одной семьи, так и неродственных лиц является проточная ци-тометрия с использованием МКА [339].
Для подсчета числа антигенных участков на эритроцитах ряд исследователей использовали радиоактивно меченные сыворотки с различной Rh-cne-цифичностью, а также меченные радиоактивной меткой или ферритином анти-глобулиновые сыворотки против IgG человека [189, 364, 464, 568, 635]. О числе участков судили по количеству меченого субстрата, связавшегося с эритроцитами. Результаты многих исследований в основном совпадали: гомозиготы содержали больше антигенных участков, чем гетерозиготы. Таким образом, эффект дозы в Rh-системе существует, хотя и не проявляет себя в 100 % случаев, что еще раз свидетельствует о полиморфизме системы.
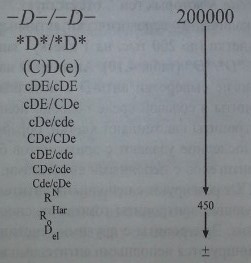
Количество антигенных участков на 1 эритроцит (тыс. ау/эр) для каждого антигена различно (см. табл. 4.10). У гомозигот DID - 14-33 тыс. ау/эр, у гетерозигот D/d их количество меньше - 10-20 тыс. ау/эр. Причем у гомозигот CDe/CDe число D-антигенных участков на один эритроцит меньше (до 19 тыс. ау/эр), чем у гомозигот cDE/cDE (до 33 тыс. ау/эр), что обусловлено, как указано выше, позицией транс гена С. Лица с генотипом -D-/-D- имеют наибольшее количество D-антигена (до 200 тыс. ау/эр), что, по-видимому, связано с отсутствием супрессирующего влияния на ген D других генов RH или же неясным пока компенсаторным механизмом, направленным на замещение недостающих в мембране структурных элементов.
У гомо- и гетерозигот (СС и Сс, ЕЕ и Ее) прослеживается такая же зависимость: гомозиготы продуцируют больше антигена, чем гетерозиготы.
По количеству занимаемых участков антигены Rh-Hr распределяются в следующей последовательности: c>C>D>E>e> Fya > G. Если сравнить эту последовательность со шкалой иммуногенности антигенов Rh и других трансфузион-но опасных антигенов (D>K>E>c>Cw>e>C> Fya), то станет ясно, что количество антигенных участков на эритроцитах не определяет степень иммуногенности того или иного антигена, по крайней мере, в рассматриваемой антигенной системе. Антиген с (hrf), имеющий максимальное число антигенных участков на 1 эритроцит (до 85 тыс.), занимает четвертое место по степени своей иммуногенности после антигенов D (Rho), К (KEL1) и Е (rhff), имеющих значительно меньше (от 3 тыс. до 33 тыс.) антигенных участков. В то же время антиген К, имеющий 3,5 тыс. ау/эр, стоит на втором месте после наиболее иммуногенного фактора - D. Антиген С (rh'), представленный 56 тыс. ау/эр, занимает лишь седьмое место в шкале иммуногенности, а антиген Fya отстоит от антигена К на 6 позиций.
Итак, степень иммуногенности того или иного субстрата обусловлена в первую очередь качественным составом. Однако нельзя полностью исключить возможную зависимость иммуногенности от количества антигена, например отсутствуют данные о степени иммуногенности эритроцитов сс и сС, имеющих соответственно 85 и 37 тыс. ау/эр, для реципиентов СС. Можно предположить, что в большой выборке сравнительных наблюдений иммуногенность эритроцитов сс окажется большей, чем эритроцитов сС, а иммуногенность эритроцитов DD лиц cDE/cDE - большей, чем эритроцитов Dd лиц CDe/cde.
- Категория: Система RH
Выраженность антигена D на эритроцитах не является константной величиной и меняется в широких пределах: от очень сильной до очень слабой, с трудом выявляемой. Во многом она зависит от сочетания факторов Rh, имеющихся у человека.
Считается, что отсутствие одних антигенов Rh сопровождается повышенным синтезом других, чтобы обеспечить формирование полноценной клеточной мембраны. Так, в отсутствие полипептидов, несущих антигены Сс, ген RHD производит дополнительное число полипептидов D, восполняя таким образом нехватку структурных элементов в мембране клетки. Высказывалось предположение, что сильный D-антиген на таких клетках обусловлен отсутствием конкуренции генов Сс и Ее в освоении общей для них и гена D субстанции-предшественника. При делеции гена D компенсаторную функцию берут на себя гены RHCE, нарабатывая большее, чем обычно, количество СЕ-полипептидов.
Имеются и другие предположения относительно неодинаковой экспрессии антигена D у разных индивидов, например CDe и cDE. В частности, полипептиды Се и се, переплетающиеся в оболочке эритроцита с полипептидами D, затрудняют доступ анти-Б-антител к участкам D-антигена, в результате чего создается видимость слабого реагирования эритроцитов D+ с анти-D-сыворотками. При отсутствии полипептидов Се и се в оболочке эритроцитов связыванию D-антигенов с анти-О-антителами ничто не мешает, и реакция выглядит более сильной, хотя на тех и на других эритроцитах могло присутствовать одинаковое количество антигенных детерминант. Полипептиды сЕ в меньшей степени блокируют доступ антител к D-антигену, чем белки, несущие Се-антигены, вследствие чего антиген D выражен сильнее, когда он находится в комбинации с антигеном сЕ, и менее выражен - в комбинации с антигеном Се.
Следует также иметь в виду, что антигенные участки подсчитывают по количеству связавшихся с ними антител и это не всегда отражает истинное их число. Скрытые от доступа антител участки, расположенные в толще мембраны, а возможно, и на эндоцеллюлярной ее части, могут оставаться не учтенными.
На выраженность антигена D влияет ген С, ингибирующий в положении транс продукцию полипептидов D (см. D ). Ингибирующий эффект гена С на ген D проявляется и в положении цис. Так, по данным Rochna и Huges-Jones [568], эритроциты лиц CDe/cde содержат меньше антигенных участков D, чем эритроциты лиц cDE/cde, у которых ген С отсутствует.
Первое место по количеству серологически активных D-антигенных участков на поверхности клетки (до 200 тыс. на 1 клетку) занимают эритроциты гомозигот -D-/-D- и *£)*/*£>* (табл. 4.10). Антиген D на этих клетках выражен столь сильно, что многие сыворотки анти-D с неполными антителами агглютинируют эти эритроциты в солевой среде подобно полным агглютининам. По силе реакции эти эритроциты напоминают клетки, обработанные протеолитиче-скими ферментами. Последние удаляют с эритроцитов белки, препятствующие взаимодействию Rh-антигенов с неполными антителами. Эритроциты гетерози-гот -D-/CDe и *D*/CDe реагируют с неполными антителами слабее. Не все сыворотки, агглютинирующие эритроциты гомозигот, способны агглютинировать эритроциты гетерозигот. Эритроциты с другими генотипами, представленными на рис. 4.9, не агглютинируются неполными антителами в солевой среде.
У лиц (C)D(e), имеющих сниженную экспрессию (С) и (е), содержится меньше серологически активного D-антигена, чем у лиц -D- и *D*, однако существенно больше, чем у гомозигот cDE/cDE. Далее в соответствии с рис. 4.9 выраженность D-антигена на эритроцитах убывает в последовательности: cDE/CDe > cDe/cde > CDe/CDe > cDE/cde > CDe/cde > Cde/cDe. Последний генотип, Cde/cDe, в котором С и D находятся в позиции транс, нередко представляет собой Cde/cDue, продуцирующий слабый антиген Du. Эритроциты Щ могут нести менее 500 D-антигенных участков, что находится на грани выявления даже такой чувствительной методикой, как непрямая проба Кумбса.
Примечание, нд - нет данных. Для сравнения:
количество А-антигенных участков на эритроцитах А(П) - 810-1170 тыс. ау/эр, В-антигенных участков на эритроцитах В(Ш) - 810-1170 тыс. ау/эр, К-антигенных участков на эритроцитах К/К- 6 тыс. ау/эр, К-антигенных участков на эритроцитах К/k - 3 тыс. ау/эр, Руа-антигенных участков на эритроцитах Fya - 12 тыс. ау/эр.
Количество антигенных участков D у лиц с различным сочетанием антигенов Rh-Hr.
Меньше всего антиген D выражен на эритроцитах с парциальными D-анти-генами у лиц RN, RHar, а также на эритроцитах Del, где антиген D выявляют только с помощью адсорбции - элюции при использовании особо активных сывороток анти-D. В то же время эритроциты с парциальным антигеном категории DIV реагируют сильнее с сыворотками анти-D, чем обычные клетки D+, несмотря на то, что они не содержат многих D-эпитопов.
- Категория: Система RH
Антиген D (резус-антиген, резус-фактор, стандартный резус-антиген) после групповых антигенов А и В имеет наибольшее значение в трансфузиологии и акушерстве. Он присутствует у лиц с генотипом D/D и D/d. Как и другие Rh-антигены, антиген D содержится в мембране эритроцитов. Со слюной он не выделяется и в других жидкостях и тканях организма не представлен. Лица, не содержащие антигена D, естественных антител против него, подобных групповым изогемагглютининам, не имеют.
Формирование эпитопов D кодируется экзонами 4 и 5 гена RHD. Avent и соавт. [143], Huang [355] считают, что конверсия генов в этих экзонах обусловливает крайне низкую экспрессию D-антигена.
У большинства людей D- имеется полная делеция гена RHD [138, 233, 368, 418, 616]. Соответствующего генетического эквивалента в виде d/d у них не найдено.
В редких случаях у людей D- наблюдали частичную делецию гена RHD, особенно среди лиц с фенотипом Cde, cdE, имевших экзоны ДЯО-гена, которые не были функциональными.
У другого человека было выпадение 4 нуклеотидов в секторе экзона 4 [137], что, как полагают авторы, могло привести к повреждению считывания нормального гена, в результате чего ген не проявлял себя фенотипически.
Иммунодоминантные протеины D+ и D- отличаются 36 аминокислотными заменами, из которых 8 расположены на внеклеточных гидрофильных петлях протеина в позиции 169, 170,172,233,238,350,353,354. Эти замены с их молекулярным окружением, по-видимому, и являются D-несущими детерминантами, способными связываться с анти-О-антителами.
Green [319], Le Van Kim и соавт. [418], Schmitz и соавт. [600] полагали, что экспрессию антигенов D, С и с обусловливает цистеиновый остаток, расположенный экзофациально в позиции 285.
Suyama и соавт. [646] не разделяли эту точку зрения, предположив, что Cys 285 не является определяющим в экспрессии антигена D.
Smythe и соавт. [618] применили трансфекцию генов ЛЯ в клетки К562, чтобы экспрессировать антигены Rh. В некоторые клетки К562 вводили мутантный || D, кодирующий в позиции 285 аланин вместо цистеина. Трансфертные клет-и экспрессировали одно и то же количество D-антигена независимо от того, провала вживляемая кДНК в позиции 285 цистеин или аланин.
Гибридные гены парциальных антигенов D. Темные прямоугольники - экзоны гена RHD, светлые прямоугольники - экзоны гена RHCE. Буквами справа обозначен антигенный комплекс, кодируемый данным геном.
- Категория: Система RH
Moore и Green [481] обнаружили, что в процессе иммунной преципитации полипептидов D и сЕ специфическими антителами одновременно с полипептидами преципитируются N-гликозилированные белки, получившие название RhAG (Rh-ассоциированные гликопротеины), или Rh-гликопротеины. Компоненты этих белков, сопровождающие полипептиды D и еС, имели несколько отличающуюся мол. массу, но одинаковую N-концевую аминокислотную последовательность [147].
Ridgwell и соавт. [565] клонировали фрагменты кДНК, соответствующие
Rh-связанному гликопротеину, и выделили кДНК полной длины из библиотеки кДНК костного мозга человека. Полученный Rh-гликопротеин содержал 409 аминокислот и имел, подобно полипептидам Rh, 12 мембранных доменов с внутриклеточными N- и С-концевыми участками. Аминокислотная последовательность Rh-гликопротеина и Rh-полипептида различалась. Сходство ограничивалось двумя аминокислотными остатками в первом и пятом домене: Glu 13 и Glu 146 - в гликопротеине Rh, Glu 21 и Glu 146 - в полипептиде Rh [565].
Структура генов RH
В 1972 г. Ruddle и соавт. [587] удалось определить, что генный локус системы резус расположен на хромосоме 1. Затем он был картирован на коротком плече хромосомы в участке 1р34.3-р36.13 [211,453,462].
Когда была получена кДНК, соответствующая Rh-полипептидам, ее можно было использовать в качестве зонда в Саузерн-блоте для исследования геномной ДНК, т. е. определения структуры генов RH.
Результаты этих исследований подтвердили, что локус RH включает 2 очень похожих гена (СЕ и £>), а один из этих генов отсутствует в гДНК, выделенной у нескольких неродственных лиц D- [233]. Таким образом была установлена молекулярная основа общего для европеоидов фенотипа Rh-, который часто обусловлен делецией гена D.
Ген D включает 10 экзонов и имеет организацию, похожую на структуру гена СЕ, но не идентичную ей (см. рис. 4.7).
Гены D и СЕ различаются по интрону 4 [138]. В гене СЕ имеется делеция 650 пар нуклеотидов, начинающаяся в интроне 4 от нуклеотида 181 [146]. Интрон 4 гена СЕ имеет 1976 пар нуклеотидов. Нуклеотиды в положении 1-181 и 831-1076 примерно идентичны в генах D и СЕ. Интрон 5 генов DnCE включает 1636 пар нуклеотидов. Имеется 29 нуклеотидных различий между этими двумя генами (98,2 % гомологии).
Организация гена СЕ исследована Cherif-Zahar и соавт. [209]. В связи с тем что антиген D обусловлен геном, отсутствующим у людей Rh-, определение молекулярной структуры антигенов Сс и Ее упростилось.
Mouro и соавт. [496] экстрагировали матричную РНК людей с редким фенотипом СсЕе и использовали синтетические олигонуклеотидные праймеры в присутствии обратной транскриптазы для получения кДНК полной длины, соответствующей продукту гена СЕ.
Присутствие антигенов Е и е было обусловлено заменой пролина на аланин в позиции 226. Пролин в этой позиции придавал субстрату специфичность Е, аланин - специфичность е (см. рис. 4.5).
При сравнении кДНК лиц, содержащих антигены С и с, ситуация ока-лась сложнее. Наблюдали 6 различий в нуклеотидах, одна часть из которых (Cysffl6, He 60, Ser 68, Sep 103) коррелировала с экспрессией С, другая (Тгр 16, Leu 60, Asn 68, Pro 103) - с экспрессией с (hr1) [496]. Эта находка была подтверждена амплификацией гДНК от людей с известным фенотипом: экзон 1 и 2 кодировал остатки, специфичные для антигенов Сс, а экзон 5 | специфичные для антигенов Ее.
Cherif-Zahar и соавт. [208] высказали предположение, что, хотя антигены Сс и Ее являются продуктами одного и того же гена и кодированы одним видом мРНК, возможен альтернативный сплайсинг, формирующий несколько белков. Полипептид полной длины кодирует экспрессию антигенов Ее, а не Сс; сплай-сеоформа, в которой отсутствует экзон 5, кодирует экспрессию Сс, но не Ее. Гипотеза подтверждается тем фактом, что из препаратов мРНК людей Rh- могут быть выделены разные продукты гена СЕ.
По мнению Umenishi и соавт. [666], сплайсеоформы не являются производными гена СЕ\ они могут также происходить от гена D. Некоторые сплайсеоформы выделены из незрелых эритробластов.
В экспериментах Smythe и соавт. [618] антигены с и Е были получены de novo на поверхности эритроидных клеток К562, в которые был введен ретро-вирус, комбинированный с кДНК, соответствующей сЕ-экспрессии. Поскольку использованная кДНК была полной длины, это отчетливо подтвердило, что антигены с и Е находятся на одном и том же полипептиде.
Аминокислотная замена, определяющая Е- и е-специфичность [Pro 226 (антиген Е), Ala 226 (антиген е)], находится в четвертой внеклеточной петле полипептида СЕ. Эта локализация полностью соответствует серологическим различиям антигенов Е и е. Однако антигенные различия обусловлены не только аминокислотной заменой, но и соответствующим молекулярным окружением. Полипептид D также имеет остаток аланина в положении 226, но не несет е-антигенности.
Структура антигенов С и с сложнее, потому что полипептиды СЕ имеют 4 аминокислоты для антигена С и 4 - для антигена с, одна из которых [Ser 103 (антиген С) или Pro 103 (антиген с)] расположена на второй внеклеточной петле полипептида.
Три из четырех аминокислот (Не 60, Ser 68, Ser 103), которые отличают С-активный полипептид от с-активного, обнаружены также в D-полипептиде. Этщ 3 аминокислоты кодируются экзоном 2 гена СЕ и экзоном 2 гена D. Не исключено, что именно благодаря этому подобию антигенов D и С антитела анти-D могут содержать анти-С-специфичность даже в тех случаях, когда эритроциты, послужившие антигенным стимулом, не имели серологически выявляемого антигена С, т. е. это был «чистый D». Во многом идентичная топология полипецтидов, кодируемых генами D и СЕ, лежит в основе перекрестных реакций антигенов и антител системы резус.
Считается, что гены RH синтезируют полипептиды, несущие Rh-антигены, не используя субстанций-предшественников.
- Категория: Система RH
В 1990-х годах 2 лаборатории независимо друг от друга получили совершенно одинаковые клоны кДНК полипептидов RhcE (Cherif-Zahar и соавт. [208], Avent и соавт. [148]).
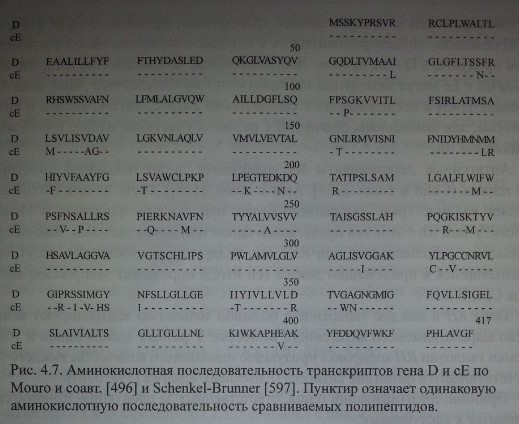
Выделение кДНК, соответствующей полипептиду D, было осуществлено независимо 3 исследовательскими группами (Le Van Kim и соавт. [418], Агсе и соавт. [138], Kajii и соавт. [390]). Последовательность аминокислот в белках, полученных при помощи кДНК RhD, отличалась от аминокислотной последовательности полипептида RhcE по 34-36 аминокислотным остаткам из 417 последовательностей (рис. 4.7).
Аминокислотная последовательность транскриптов гена D и сЕ по Mouro и соавт. [496] и Schenkel-Brunner [597]. Пунктир означает одинаковую аминокислотную последовательность сравниваемых полипептидов.
Полипептиды D и сЕ имеют высокую степень гомологии: клон полипептида D, выделенный Агсе и соавт. [138], был на 96 % идентичен клону полипептида сЕ по последовательности нуклеотидов кДНК и на 92 % идентичен по структуре белка.
Le Van Kim и соавт. [418] показали, что полученные ими клоны кДНК являются продуктом гена Д поскольку фрагменты геномной ДНК, с которыми совпадали эти клоны, были получены от людей с фенотипом D+.
В то же время Kajii и соавт. [390] установили, что полученные ими клоны не были продуктом гена Д поскольку кДНК была идентифицирована у человека с фенотипом D-C+c+E+e+.
Данные о том, что у некоторых людей фенотип D- обусловлен делецией гена Д были получены Colin и соавт. [233] в экспериментах с использованием метода Саузерн-блот.
- Категория: Система RH
Целью молекулярно-биологических исследований было ответить на вопрос: находятся ли антигенные детерминанты D, С/с и Е/е на разных белковых структурах или же они присутствуют на одном и том же полипептиде? Другой целью этих исследований было установить молекулярную структуру вариантов Rh-антигенов и кодирующих их генов.
Эксперименты с использованием трансфекции фрагментов ДНК [196, 496, 618] показали, что детерминанты С/с и Е/е расположены на одном полипептидном продукте, a D - на другом. Дополнительные доказательства того, что антигены Сс и Ее могут находиться на одном и том же полипептиде, получены Avent и соавт. [145] в исследованиях с сыворотками анти-С, анти-с, анти-Е и анти-е, которые, как выяснилось, реагируют с разными участками одного и того же полипептида Rh.
Антигенные детерминанты Rh кодируются двумя похожими по структуре генами (Colin и соавт. [233], Агсе и соавт. [138]). Один из них (RHD) определяет наличие трансмембранного белка, придающего эритроцитам D-актив-ность. У лиц Rh+ этот ген представлен одной или двумя копиями. Как уже упоминалось, у большинства лиц Rh- ген, кодирующий субстрат D, отсутствует. Находящийся в прилежащем локусе ген RHCE определяет экспрессию антигенов С, с, Ей е.
Гены RH в каждом гаплотипе с большой точностью контролируют количество вырабатываемого антигенного вещества. У разных членов одной и той же семьи гаплотип RH кодировал продукцию одинакового количества каждого присутствующего в фенотипе антигена (Rosenfield, Kochwa [393, 576]).
Принцип идентификации генов, ответственных за продукцию Rh-антигенов, сводится к следующему:
- выделение несущего Rh-активность белка с помощью преципитации специфическими антителами;
- расшифровка аминокислотной последовательности иммунодоминантного белка, приготовление комплементарных молекулярных зондов и конструкций для идентификации кодирующей ДНК (кДНК);
- вживление (трансфекция) кДНК в клетки или плазмиды, не производящие аналогичного иммунодоминантного продукта;
- идентификация геномного продукта трансфектных клеток или плазмид;
- идентификация геномной ДНК (гДНК), представляющей собой собственно ген с кодовой записью иммунодоминантного продукта.
Новости медицины
Много миллионов человек в мире принимают статины, но исследования показывают, что только 55% из тех, кому рекомендуется принимать статины, принимают их. Это большая проблема, потому что исследования также показывают, что те из группы...
Связанное с беременностью высокое кровяное давление может привести к долгосрочным сердечным рискам, показывают новые исследования.
Кэролин Консия, столкнулась с более серьезными последствиями репрессий против назначения опиоидов, когда узнала, почему сын ее подруги покончил с собой в 2017 году.
Новое исследование показывает, что психические заболевания не являются фактором большинства массовых расстрелов или других видов массовых убийств.