Антигенные детерминанты Rh расположены на негликозилированных не-фосфорилированных полипептидах с мол. массой 30-32 кДа [129, 295, 483]. Полипептиды RhD и RhcE представляют собой цепь из 12 связанных со скелетом • мембраны доменов [348], пересекающих мембрану эритроцита от эндо- до экзо-целлюлярного уровня (рис. 4.5 и 4.6). Основная часть полипептида размещена в фосфолипидном бислое. На внешней стороне клетки домены соединены 6 выступающими над поверхностью мембраны петлями, на которых также могут располагаться серологически выявляемые Rh-антигены. N- и С-концевые участки полипептида погружены внутрь клетки [196]. Полипептид RhD, полученный искусственно в трансфектных клетках с помощью олигонуклеотидньгх праймеров и соответствующих кДНК людей Rh+, состоит из 417 аминокислот [147,172,590]. Из такого же числа аминокислот состоит полипептид RhcE, полученный таким же способом с использованием кДНК людей Rh- [138,390,418].
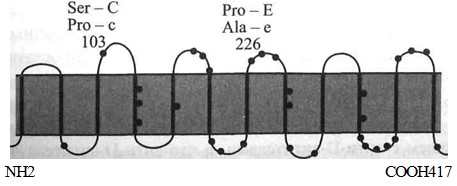
Топология мембранных доменов Rh-Hr no Schenkel-Brunner
Полипептид сЕ имеет 6 цистеиновых остатков, 5 из которых расположены в ци-топлазматических петлях. Шестой цистеин (Цис-285) находится в 5-й внеклеточной петле [564]. Цистеин в позиции 311 полипептида RhcE замещен на тирозин в полипептиде RhD. Отдельные последовательности (мотивы), например Cys - His - Leu -Не - Pro в положении 285-289, являются общими для всех эпитопов: D, Сс и Ее.
Высокая степень гомологии между генами RHDи RHCEспособствует генной конверсии, неравновесному кроссинговеру и образованию в результате этого гибридных генов, кодирующих продукцию новых антигенов Rh [597].
Rh-протеины высокогидрофобны и весьма прочно соединены с другими гидрофобными белками мембраны [336]. Обнаружена определенная связь Rh-полипептидов с гликофорином В, антигенами LW, гликопротеином, несущим антигены Duffy, гликопротеином CD47 и так называемым Rh-ассоцииро-ванным гликопротеином.
Rh-антигены устойчивы к воздействию протеолитических ферментов [295]. Антигены D и с (hr') разрушаются под воздействием N-этилмалеинимида, хлор-меркурибензоната и 2-нитробензойной кислоты. Это послужило для исследователей основанием полагать, что Rh-субстанция содержит тиоловые группы [316,319,600,646].
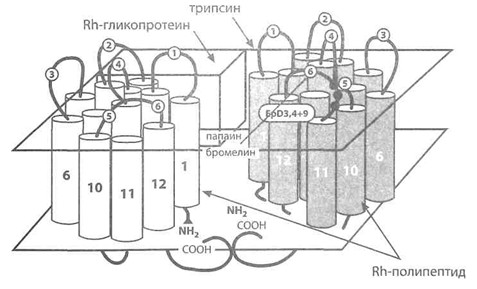
Предполагаемая трехмерная структура доменов Rh-полипептида и Rh-ассоциированного гликопротеина в мембране эритроцита (по Avent [141]). Светлые и темные цилиндры представляют домены Rh-полипептидов D и СЕ с N- и С-терминальными группами. На заднем плане условно представлен Rh-ассоциированный гликопротеин. Указаны участки разрывов при действии трипсина, папаина или бромелина, место расположения эпитопов D3, D4 и D9, экзо- и эндоцеллюлярные петли Rh-полипептида.
Как отмечали Dahr и соавт. [242], серологическая активность D-антигена утрачивалась под действием цистеиновых реагентов. После обработки эритроцитов дитионитробензойной кислотой (ДТНБК) антиген D инактивировался, однако активность его вновь восстанавливалась под действием дитиоэри-тритола. В то же время под действием глютатиона активность D-антигена не восстанавливалась. Обработка эритроцитов хлормеркурифенилсульфониковой кислотой приводила практически к полной потере активности антигена D, которая не восстанавливалась дитиоэритритолом.
Йодацетамид не инактивировал D-антиген - это согласовывалось с предположением Dahr и соавт. о том, что цистеиновые остатки являются непосредственной составной частью D-антигена. Авторы пришли к выводу, что цистеи-новая модификация Rh-протеина, в частности Cys 285 в 5-й внеклеточной петле, приводит к модификации антигена Rh.
Серологическая активность Rh-антигенов, как показал Green [317, 318], во многом зависела от содержания липидов в мембране эритроцитов. После вытяжки липидов из стромы п-бутанолом Rh-активность утрачивалась, а после инкубации стромы с липидным экстрактом она полностью восстанавливалась. Как указывает Schenkel-Brunner [597], липиды необходимы для оптимальной пространственной ориентации других структурных молекул в мембране эритроцита.
Обработка эритроцитов фосфолипазой, расщепляющей жирные кислоты, лектином, фосфатидилэтаноламином или фосфатидилсерином выраженно ин-гибировала активность антигенов с, D и е [320, 3366, 530].
На серологическую активность Rh-антигенов влияло обезвоживание мембраны эритроцитов [154, 181, 609]. Высокий уровень холестерола (соотношение холестерола и фосфолипидов 1,55) совпадал с повышенной вязкостью мембраны и большей выраженностью D-антигена. Низкий уровень холестерола (соотношение холестерола и фосфолипидов 0,55) сопровождался меньшей вязкостью мембраны и менее активным реагированием D-антигена [597].
Отсутствие Rh-полипептидов у людей с фенотипом Rhnul) сопряжено с изменениями в структурной организации липидного слоя мембраны и нарушением водно-ионного транспорта в клетке.
Из ранних работ (до 1960 г.) известно, что резус-антиген термолабилен и слабеет при высушивании (П.Н. Косяков [69]). Сыворотки антирезус снижали свою активность при смешивании со стрептомицином, дериватами рибонуклеиновой кислоты, некоторыми сахарами и другими химическими веществами, из чего авторы делали предположения о возможной химической природе резус-антигена.
Наличие в эритроцитах Rh+ Rh-ассоциированного гликопротеина, по-видимому, вводило в заблуждение исследователей, полагавших, что антигены резус имеют полисахаридную природу.








