Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Аллоиммунизация как глобальный популяционный процесс
Генетика
Система Rh - одна из наиболее полиморфных систем, антигены которой кодируются 2 генами (RHD и RHCE), расположенными на коротком плече хромосомы 1 в локусе RH между 1р34.3 и 1р36.13 (Cherif-Zahar и соавт. [211], MacGeoch и соавт. [453], Marsh и соавт. [462]).
Три генетические теории
Существуют 3 генетические концепции наследственной передачи антигенов Rh. Первая разработана в начале 50-х годов прошлого столетия Александром Винером (Wiener и соавт. [714, 715]), вторая - в тот же период Рональдом Фишером совместно с Робертом Рейсом (Fisher, Race [283, 284], Race [543]). Третья концепция, получившая в последние годы подтверждение, предложена в 90-х годах прошлого столетия Патрисией Типпетт (Tippett [654, 656]).
Интересно проследить логику построения этих концепций.
Располагая двумя сыворотками: aHTH-Rho и анти-rh', выявляющими 2 антигена - Rho и rh', Винер вполне обоснованно допустил, что существует не 2, а 4 аг- глютиногена резус: Rho, rh', Rho' и rh-агглютиноген, не содержащий ни Rho, ни rh'. Он полагал, что аллель R гена Rh обусловливает продукцию антигена Rho, аллель R1 - продукцию антигенов Rho и rh', аллель г' - антигена rh', а аллель г - отсутствие обоих антигенов - Rh и rh'.
Винер, не имея экспериментальных данных, свидетельствующих о том, что отдельные гены могут быть сцеплены, сделал вывод, что все антигенные признаки Rh контролирует только 1 (но полиморфный) ген (рис. 4.1). Это и явилось основой его концепции, получившей известность как теория одного гена.
Антигены, продуцируемые редкими аллелями RHCE-локуса при его повреждении
|
Повреждение СЕ протеина |
Продуцируемые антигены |
|
(С)(е) |
Rh9 С* |
|
(G)(e) |
Rh32 |
|
(С)(е) |
Rh35 |
|
1 (С)(е) ' |
Rh48 (JAL)r ‘ v |
|
• н |
Rh36 (Be8) |
Задолго до Tippett (в 1964 г.) идею о существовании двух генов RH, структурного к операторного, высказал Lauer [410], однако его исследования не были продолжены.
Sanger и соавт, [596], исследуя природу антигена f, установили, что этот антиген вырабатывается в случае, если гены сие расположены на одной хромосоме в положении цис. Такое же заключение было сделано ими относительно антигена Се: он вырабатывается г/мс-комбинацией генов Сие. Race и Sanger приблизились к современному пониманию того, что генетический материал, именовавшийся ранее локусами с, е, С и Е, представляет собой один и тот же ген, имеющий аллели се, Се, сЕ и СЕ. Однако этот вывод не был ими сформулирован.
Следует обратить внимание на некоторые противоречия и сложности, привнесенные новым пониманием того, что система Rh кодируется не тремя или четырьмя парами аллельных генов, а только двумя: RHD и RHCE. Прежние генетические теории объясняли все предельно просто. Так, в соответствии с Я/ьЯг-концепцией фенотип RjRj, или Rho'" hr'", обусловлен гаплотипами R1 и R2', в соответствии с СО£-концепцией фенотип CcDEe кодируется генами С, с, D, Ей е, переданными индивиду по наследству с гаплотипами CDe и cDE. С позиций двухгенной теории фенотип CcDEe объяснить сложнее. Согласно двухлокусной модели индивид CcDEe должен унаследовать ген RHD и один из аллелей гена RHCE (RHce, RHCe, RHcE или RHCE). В любой из возможных комбинаций (Dee, DCe, DcE, DCE) полного набора антигенов CcDEe не получается и в этом заключается противоречие.
Вряд ли можно полагать, что аллель RHCe производит антигены с и Е, а аллель RHcE - антигены Сие. Это маловероятно, поскольку нарушает основную идею двухгенной модели и, кроме того, не соответствует результатам серологических исследований. Остается признать, что фенотип CcDEe является продуктом гибридного гена Ce-D-cE. Такое объяснение более правдоподобно. Как показали результаты исследования последних лет, фенотип cde часто обусловлен делецией гена RHD. Возможность гибридизации генов RH, в силу их высокой гомологии, не вызывает сомнения и, по-видимому, явление частое.
Ретроспективный взгляд на 3 генетические теории
Винер не разделял теорию трех генов Фишера - Рейса, оставаясь последовательным приверженцем концепции одного гена. Не признал он и кроссин- говер. Действительно, при наличии одного гена кроссинговер маловероятен. Убежденность, с которой Винер отстаивал свои взгляды, побуждает критически отнестись к рассмотрению этого вопроса.
Легко приняв на веру подкупающую простотой теорию Фишера - Рейса, мало кто из специалистов, кроме Винера, подверг ее серьезной перепроверке. Прокоп и Гёллер в фундаментальном труде «Группы крови человека» [90] пишут, что Винер критиковал теорию кроссинговера, неоднократно проверяя ее по таблицам популяционно-генетических исследований и не находя в них подтверждения ожидаемого кроссинговера. Напротив, некоторые позиции противоречили теории Фишера.
По мнению Рейса [544], на кроссинговер указывали лишь единичные наблюдения, из которых трудно было сделать однозначное заключение о существовании этого феномена.
В концепции Типпетт также нет места кроссинговеру. Трудно ожидать перекреста двух расположенных рядом тесно сцепленных локусов. При таких условиях более вероятны делеции, мутации и конверсии.
Как и любое теоретическое построение, рассмотренные выше 3 генетические теории - это лишь предположения, попытки систематизировать, объяснить экспериментальные данные, исходя из представлений того времени.
Сегодня можно высказать суждение (ни в коей мере не подвергая сомнению теорию Фишера), что порядок расположения генов RH может соответствовать последовательности D-Е -С и это ничего не меняет на фенотипическом уровне. Кроссинговер (если он в системе Rh происходит) может дать такие же сочетания антигенов при последовательности генов D-E-C, как и при последовательности D - С - Е (см. рис. 4.2). Последовательность генов С - D - Е также ничего не меняет в Rh-фенотипе человека, если допустить возможность выборочной конверсии генетического материала при мейозе.
Гаплотип cDe встречается в 10-13 раз чаще у негроидов, чем у европеоидов (42,3 и 3,2 % соответственно [108]). Если бы гаплотип cDe являлся результатом кроссинговера, как полагал Фишер, то частота гаплотицов Cde, cdE, CDE и CdE также должна быть существенно выше у негроидов, чем у европеоидов. Однако в действительности частота указанных гаплотипов у представителей этих двух рас приблизительно одинакова. Тем не менее идея Фишера о том, что редкие га- плотипы образуются посредством кроссинговера частых гаплотипов, признается всеми исследователями как весьма элегантная, и если кроссинговер не был до сих пор убедительно доказан, то он и не был полностью опровергнут.
Теоретические построения Типпетт, при всей их оригинальности, также не могут рассматриваться как истина в последней инстанции. В них много допущений. Не ясно: почему чаще образуются антитела анти-С, анти-с, анти-Е и анти-е, чем антитела анти-се, анти-Ce, анти-сЕ и анти-СЕ, хотя обе группы антител стимулированы, как полагает Типпетт, одним полипептидом? Почему так часто образуются несепарируемые анти-БС-антитела, если антигены D и С находятся на разных полипептидах? Почему чаще вырабатываются анти-DE- антитела, чем анти-Е, но реже, чем анти-DC? Винер объяснял это существованием двух агглютиногенов: Rho' (DC) и Rho" (DE), которые встречаются с разной частотой. По мнению Фишера, это объясняется тем, что гены D и Е, а значит и антигены D и Е, дальше отстоят друг от друга, чем D и С, поэтому вероятность образования анти-ОС-антител выше, чем анти-DE. С позиций концепции Типпетт образование комбинированных антител анти-DC и анти-DE можно объяснить, допустив, что эпитопы Rh мозаично переплетены на поверхности эритроцитов в виде близкорасположенных пар DC и DE.
Концепция двух генов пока еще осмысливается иммуносерологами, привыкшими оперировать категориями Винера, Фишера и Рейса. Если антитела анти- се, анти-Ce, анти-сЕ и анти-СЕ определяют продукты гена RHCE, то почему антитела анти-DC и анти-DE не могут свидетельствовать о существовании гена RHDCE с аллелями DC и DE, подобно тому, как считал Винер?
Пока ответом на этот вопрос служит открытие двух разных протеинов, несущих антигены D и СЕ. Однако не исключено, что в ближайшем будущем могут быть найдены протеины, несущие одновременно специфичность D и С, D и Е. Гибридные гены DC-D/D-DC, продуцирующие необычные иммунодоминант- ные протеины, известны. Вместе с тем следует признать, что теория двух генов представляет несомненный прогресс в иммуносерологии и весьма перспективна для дальнейших молекулярно-биологических изысканий.
Как справедливо указывают Issitt, Anstee [374], дискуссия относительно трех генетических теорий системы резус далека от завершения. Однако эта дискуссия не содержит антагонистических противоречий. Как первая, так и вторая, и третья теории не противоречат практике и вполне устраивают иммуносерологов, судебных медиков, генетиков и других специалистов. Различаясь по форме, эти концепции никак не сказываются на интерпретации результатов фенотипирования при использовании конкретных тестовых реагентов. В этих теориях практически все позиции общие, за исключением количества детерминирующих генов.
Номенклатура Фишера - Рейса не противоречит номенклатуре Винера, так как опирается на одни и те же факты (обе исследовательские группы, Рейса в Англии и Винера в Америке, обменивались найденными сыворотками и сопоставляли полученные результаты). Концепция Типпетт никаких изменений в существующую номенклатуру не внесла.
И все-таки, может быть, более всех прав Винер, и наблюдаемое разнообразие фенотипов резус, несмотря на национальные и расовые особенности, обеспечивается одним геном? Многочисленных воздействий на дистанции «формирование гена —► ген —► готовый продукт» в виде кроссинговера, конверсии, мутации, делеции, пространственного взаимовлияния генов друг на друга и всего, что может воздействовать на кодирующую ДНК и синтез полипептидов, более чем достаточно, чтобы обеспечить существующее разнообразие. Вряд ли для этого нужно 3, а тем более 50 генов, достаточно одного. Теория Типпетт построена в унисон теории Винера. Она по сути представляет собой возврат от теории трех генов или более к теории одного гена.
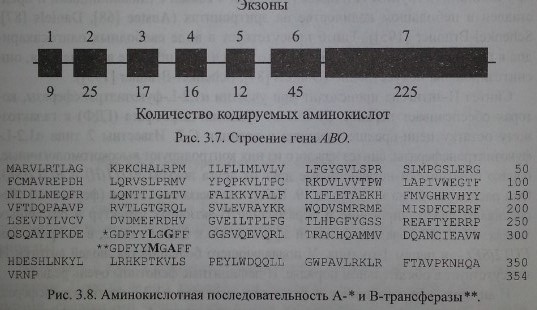
Как уже указывалось выше, серологически определяемые антигены А, В и Н не являются непосредственными продуктами генов. Гены А, В и //контролируют синтез соответствующих трансфераз. В настоящее время строение генов АВО и Я расшифровано (рис. 3.7). Их удалось клонировать и секвенировать. Расшифрована также аминокислотная последовательность А- и В-трансфераз, которые отличаются друг от друга двумя аминокислотами в позициях 266 и 268 (рис. 3.8).
Гены АВО содержат по 1062 пары оснований и кодируют пептиды, состоящие из 354 аминокислот (Reid, Lomas-Francis [186]). Секвенирование генов А и В позволило установить отличающие их последовательности в 7 кодонах, 4 из них (в позициях 176, 235, 266 и 268) могут быть причиной замены аминокислот в трансферазах. Секвенирование гена 01 показало его идентичность с А1 до нуклеотида 261, с которого рамка считывания нарушается с образованием стоп-кодона (Daniels [87]). Такой аллель кодирует синтез пептида, не обладающего какой-либо трансферазной активностью.
Выявлено несколько вставок: гуанин-цитозин (GC boxes), которые находятся выше кодона, инициирующего транскрипцию, и могут играть важную роль в регуляции активности трансфераз. Транскрипция генетической информации зависит от мини-сателлитов - участков размером 4 кб, расположенных выше начального участка считывания. Эксперименты с трансфекцией генов показали, что активность транскрипции гена А по сравнению с В существенно ниже.
Найдены часто встречающиеся аллели, характерные для представителей различных этнических групп. Так, примерно 80 % аллелей А1 среди японцев отличались от аллелей А1 европейцев мутацией, ведущей к замене проли- на на лейцин в положении 156. Однако это никак не проявляло себя на фенотипическом уровне (Olsson и соавт. [176-178]). Вместе с тем вставка одного нуклеотида в позиции от 798 до 804 в аллеле А2 приводила к синтезу продукта, не обладающего трансферазной активностью (аллель О3) (Olsson и соавт. [179]). При сравнении нескольких аллелей установлена их гибридная природа. Образование гибридов, включающих фрагменты двух разных аллелей, авторы объясняют кроссинговером во время мейоза. В большинстве случаев кроссин- говер затрагивал экзон 6. При наличии делеции G 261 экзон 7 фенотипически не проявлялся. В тех случаях, когда экзон 6 не содержал указанной делеции, экзон 7 аллеля А1 или О1 проявлял себя фенотипически как Aj-серологическая активность. Экзон 7 аллеля О/v проявлял себя как А2-серологическая активность (Ogasawara [170]).
Описана семья, в которой мать имела группу В, ребенок - А, отец - О. На первый взгляд, такие результаты серологического исследования в традиционной интерпретации должны были исключить отцовство. Однако результаты молекулярно-генетического исследования не позволили этого сделать. Секвенирование генов АВО членов данной семьи показало, что у ребенка имелся гибридный ген, экзон 6 которого содержал фрагменты гена В, а экзон 7 - фрагменты гена 0lv. Поскольку экзоны 7 аллелей А1 и 01у идентичны, а в экзоне 6 указанного гибридного гена, B-0Iv, отсутствовала делеция G 261 (стоп-кодон), на эритроцитах ребенка сформировался антиген A (Olsson и соавт. [177]). Вероятно, этот 2?-0Уу-гибридный ген с А-трансферазной активностью возник во время мейоза в результате кроссинговера.
В литературе появляется все больше материалов, свидетельствующих о гетерогенности аллелей А, В, Н и Se среди представителей различных рас и этнических групп. Молекулярно-генетические методы позволяют выявлять варианты генов с точковыми мутациями, делециями, гибридными включениями (табл. 3.14, 3.15, 3.16, рис. 3.8), приводящими к формированию стоп-кодонов, инактивации участков сплайсинга (Ogasawara и соавт. [170]). В ряде случаев отмечены эпистатические эффекты в виде аллельного угнетения (Feng и соавт. [101]) или, напротив, аллельного усиления активности генов (Morel и соавт. [162], Ogasawara и соавт. [171]). Структурные особенности генов часто не проявляют себя и лишь в редких случаях приводят к появлению необычных
Таблица 3.1 б
Аллели, ассоциированные со слабой экспрессией В
|
Фенотип |
Аллель |
Замена нуклеотидов |
Замена аминокислот |
|
вз |
В3-1 |
С 105 4T |
Arg 352 Tip |
|
В X |
Bw-1 *В104 |
G 871 А |
Asp 291 Asn |
|
Ве, |
Ве1-1*В105 |
Т 641 G |
Met 214 Arg |
|
Ве1 |
Ве1-2 *В10б |
G669T |
Glu 223 Asp |
|
В W |
Bw-2 |
С 873 G |
Asp 291 Glu |
|
В W |
Bw-3 |
С 721 Т |
Arg 241 Trp |
|
В W |
Bw-4 |
А 748 G |
Asp 183 Gly |
|
В W |
Bw-5 |
G 539 А |
Arg 180 His |
|
В W |
Bw-6 |
А 1036 G |
Lys 346 Glu |
|
в W |
Bw-7 |
G 1055 А |
Arg 352 Gin |
|
в W |
Bw-8 |
T863 G |
Met 288 Arg |
Высокая степень гомологии локуса АВО человека обнаружена также при сравнении с аналогичными локусами других млекопитающих: хомяков, крыс, мышей, овец, коров, кроликов, кошек и собак (Daniels [87], Roubinet и соавт. [190]). Интересная деталь: трансферазная активность локуса АВО у мышей вдвое выше, чем у человека (Roubinet и соавт. [190]).
Высокая степень подобия выявлена при секвенировании генов FUTl(Hh) и FUT2(Se) (табл. 3.17, см. рис. 3.8). Полагают, что локус FUT2 мог произойти в результате преобразования гена FUT1 (Daniels [87]).
Таблица 3.17
Аминокислотная последовательность гликозилтрансфераз у млекопитающих
Перспектива создания универсальных эритроцитов привлекла многих исследователей, появилась возможность конвертировать эритроциты группы А в О, и таким образом решить проблему АВО-несовместимых гемотрансфузий.В настоящее время предпринимаются попытки синтезировать а-галакгозилазу генно-инженерным путем, поскольку фермент из натурального сырья дорог окончательно не выяснен. Недостаточно изучены естественные эндогенные ингибиторы антителообразования, которые, по-видимому, могут влиять на состояние респондерства или нереспондерства в отношении резус-антигена.
|
Вид |
Аллель, антиген, энзим |
Высокогомологичный фрагмент аминокислотной последовательности |
|
|
Человек |
А101 |
FTYERRPQSQAYIPKDEGDFYYLGGFFGG |
272 |
|
Человек |
В101 |
FTYERRPQSQAYIPKDEGDFYYMGAFFGG |
272 |
|
Человек |
001 |
FTYERRPQSQAYIPKDEGDFYYLGRFFGG |
272 |
|
Человек |
цис-АВ |
FTYERRPQSQ AYIPKDEGDF YYLG AFF GG |
272 |
|
Мышь |
АВ |
FTYERRPQSQAYIPWDRGDFYYGGAFFGG |
251 |
|
Свинья |
А |
FTYERRPLSQAYIPRDEGDFYYAGGFFGG |
282 |
|
Собака |
Антиген Форссмана |
FP YERRHISTAF VAENEGDF Y Y GG AVF GG |
267 |
|
Мышь |
Г алактозилтрансфераза |
FT YERRELS AAYIPFGEGDF YYHAAIF GG |
312 |
|
Корова |
Г алактозилтрансфераза |
FTYERRKESAAYIPFGEGDFYYHAAIFGG |
286 |
|
Крыса |
ЮЬЗ |
LPYERDKRSAAALSLSEGDFYYMAAVFGG |
259 |
Не утверждая, что это лежит в основе статуса нереспондерства, мы тем не менее приведем некоторые размышления. Предположим, что резус-принадлежность D- данного человека обусловлена неполной делецией гена D, и небольшая часть генетического материала все же сохранилась. Этой части не достаточно, чтобы воспроизводимый ею субстрат мог быть выявлен серологически как D+, однако может быть достаточно, чтобы антиген D, введенный с перелитой кровью, не воспринимался как чужеродный. Таким образом, нереспондеры по отношению к резус- антигену - это лица, в эритроцитах которых присутствует вещество, гомологичное антигену D, в небольшом, серологически невыявляемом количестве (скрытый D). Не исключено, что такие лица могут иметь фенотип Del, при котором следовые количества антигена D выявляют только с помощью адсорбции - элюции.
Предпринятые некоторыми исследователями попытки индуцировать состояние толерантности к резус-фактору посредством орального введения эритроцитов Rh+ не увенчались успехом. Остается недоказанным предположение о существовании гена респондерства и нереспондерства.
Благодаря молекулярно-биологическим исследованиям Colyn, Mouro, Wolter, Cherif-Zahar, Le Van Kim и других исследователей стало понятно, почему антиген D столь иммуногенен.
В 1991 г. Colyn и соавт. [233] выяснили, что резус-положительные лица имеют 2 гена: RHD и RHCE, кодирующие выработку резус-антигенов. В то же время у большинства резус-отрицательных людей ген RHD подвергнут делеции и они имеют только 1 ген - RHCE. Последний представлен 4 аллелями: RHCe, RHcE, RHce и RHCE, кодирующими соответственно 4 варианта субстрата - Се, сЕ, се и СЕ. Полипептиды, кодируемые аллелями RHCE, имеют весьма значительное структурное сходство.
Как установили Mouro и соавт. [496], Wolter и соавт. [720], Cherif-Zahar и соавт. [208], Le Van Kim и соавт. [418], полипептид, несущий иммунодоминант- ный эпитоп С, отличается от полипептида, несущего иммунодоминантный эпитоп с, всего лишь четырьмя аминокислотами в цепи из 417 аминокислот, и лишь одно из этих 4 различий определяет специфичность С и с. Полипептид, несущий Е-специфичность, отличается от несущего е-специфичность одной аминокислотой. Иными словами, когда реципиенты Cde получают трансфузию эритроцитов cde, а реципиенты cde - трансфузию эритроцитов Cde, иммунная система реципиента не всегда отличает перелитое вещество Rh от своего собственного. То же самое происходит, когда людям с фенотипом cDE, cdE или cDe, cde переливают эритроциты cDe, cde или соответственно cDE, cdE: их иммунная система не в состоянии отличить чужой антиген от собственного по одной различающейся позиции.
Полипептид, кодируемый геном RHD, отличается от кодируемого геном RHce по величине [208, 233, 418, 496, 720]. Такое различие существенно для иммунной системы реципиента. При делеции гена RHD кодируемое им вещество Rh не производится, поэтому вводимый при гемотрансфузии антиген практически не имеет у реципиента какого-либо эквивалента. Иммунный ответ особенно сильно проявляется у лиц с фенотипом -D- и Rhnull, у которых часть или все антигены Rh отсутствуют. В этом случае антигенные различия реципиента и донора, даже если последний Rh-, очень велики.
На основании результатов молекулярно-биологических исследований, свидетельствующих о незначительных различиях в структуре минорных резус- антигенов С, с, Е, е, а также основываясь на данных статистики, показывающих, что частота антител к этим антигенам невысока, некоторые исследователи предлагают пересмотреть существующее положение о резуе-положительных и резус-отрицательных донорах. В частности, предлагается относить к резус- отрицательным донорам лиц D-, содержащих антигены С и Е, и узаконить трансфузии крови Cde, cdE и CdE резус-отрицательным реципиентам. По их мнению, такой подход, позволит расширить ресурсы донорской крови Rh-, сэкономит значительные средства, затрачиваемые на дополнительное типирова- ние доноров по факторам С и Е, и связанные с этим другие расходы.
Хотя мировое сообщество трансфузиологов в целом не приняло этот предложение, оно не лишено здравого смысла.
Придерживаясь общепринятого положения, предписывающего относить к резуе-отрицательным донорам только лиц, не содержащих факторов D, С и Е, мы все же рассмотрим его по существу.
В начале 50-х годов прошлого столетия сложилось представление о том, что для реципиентов cde антигены С и Е столь же иммуногенны, как D. Это представление базировалось на данных о высокой частоте встречаемости антител анти-С и анти-Е в виде комбинированных сочетаний: анти-DC и анти- DE. Создавалась видимость высокой иммуногенности этих факторов и отсюда опасение, что для реципиентов D-C-E- антигены С и Е будут также иммуногенны. В действительности чистые антитела к факторам С и Е без анти-D- антител встречаются редко, что свидетельствует об их невысоких иммуноген- ных свойствах.
Для того чтобы еще больше обезопасить резус-отрицательных реципиентов от возможной аллоиммунизации, им переливают эритроциты, не содержащие этих факторов. Предпочтение такой тактики было в значительной степени произвольным, поскольку объективная статистика, подтверждающая правомерность такого подхода, отсутствовала.
В то же время реципиентам Rh+ переливают эритроциты, которые в 20-30 % случаев не идентичны по антигенам С и Е, не опасаясь при этом вызвать аллоиммунизацию. Вряд ли такой подход можно признать правильным, поскольку реципиенты Rh+, хотя и редко, но все же иммунизируются минорными антигенами с, Cw, С, Е и е. В табл. 4.2 представлены данные, характеризующие степень иммуногенности минорных Rh-антигеновискусственная иммунизация нативными и энзимированными эритроцитами не позволяла получить эти антитела (Р.С. Сахаров [96, 98]).
В опытах по иммунизации, когда инъекции продолжались в течение полутора лет, Jones, Diamond и Allen (1954) не смогли стимулировать продукцию анти-С и анти-Е ни у одного из 32 человек D+.
Очень часто иммунизация, предпринятая с целью получения антител анти-С и анти-Е, приводит к выработке антител анти-KEL 1 или анти-hr' (с). Об этом свидетельствуют многочисленные данные, полученные отечественными исследователями Т.Г. Соловьевой, А.Г. Башлай, Р.С. Сахаровым, В.А. Мороковым, И.С. Липатовой и другими, занимавшимися направленной искусственной иммунизацией с целью получения моноспецифических тестовых сывороток.
Анти-С-антитела хотя и редки, но значительно чаще образуются у резус- отрицательных людей, чем у резус-положительных, что еще раз подтверждает правильность современной трансфузиологической тактики, предусматривающей переливание резус-отрицательным реципиентам эритроцитов, лишенных антигенов С и Е. Сложившуюся повсеместно практику переливания эритроцитов Rh+ резус-положительным реципиентам без учета факторов С и Е вряд ли можно считать идеальной, поскольку это приводит к аллоиммунизации реципиентов факторм hr' (с), который иммуногенен для гомозигот CDe/CDe и обусловливает около 3 % посттрансфузионных осложнений.
Итак, многие аргументы убеждают в необходимости переливать эритроциты, идентичные по основным антигенам системы Rh-Hr: D, С, Е, с, е. К этому перечню необходимо добавить антиген Cw, частота сенсибилизации к которому составляет 1-2 % [40].
Роль Rh-антигенов в биологии человека неясна. Gahmberg и соавт. [296], Ridgwell и соавт. [566], Paradis и соавт. [517] полагают, что резус-антигены являются лишь структурным элементом мембраны эритроцитов. Число молекул полипептида Rh и гликопротеина Rh на 1 эритроцит достигает 200 тыс. (Hughes- Jones и соавт. [364]), что делает их основными мембранными белками.
Вещество Rh присутствует только в эритроцитах и, по-видимому, выполняет определенную функцию, специфичную именно для этих клеток.
По данным Schmidt и соавт. [5] и Sturgeon [638], эритроциты людей с фенотипом Rhnull, при котором, как известно, отсутствуют Rh-антигены, имеют эллипсоидную форму. Концентрация анионов в мембране снижена (Balias и соавт. [151]). Эритроциты часто дегидратированы из-за повышенного транспорта воды через клеточную мембрану (Lauf, Joiner [411], Nash, Shojania [504]). Срок их приживления in vivo меньше, чем обычных эритроцитов [598].
Ridgwell и соавт. [565] нашли, что аминокислоты Glu 21 и Glu 146 в трансмембранной части Rh-полипептида и аминокислоты Glu 13 и Glu 148 в трансмембранной части Rh-гликопротеина обеспечивают движение катионов через мембрану эритроцита и относятся к структурам, которые подобно аквапорину-1 (антигену Colton) являются транспортерами воды в клетку.
Система резус полиморфна. Помимо четко очерченных антигенов, она включает варианты, при которых антигены выражены слабо либо вовсе не продуцируются. Для ясности дальнейшего изложения объясним некоторых обозначения, встречающиеся в современных публикациях.
Как видно из табл. 4.5, наименования отдельным вариантам, в том числе редко встречающимся, присваивали в значительной мере произвольно. В этом плане классификация ISBT внесла определенный порядок. Тем не менее обозначения, характеризующие необычную выраженность антигенов или их неожиданное отсутствие, в литературе сохраняются, например фенотипы Rhnull, -D-, (C)D(e). В последнем случае необычные фенотипы со слабовыраженны- ми антигенами Сие, кодируемые геном RN и чаще встречающиеся у негров, обозначают как (C)D(e), выделяя скобками очень слабые или практически отсутствующие антигены Сие.
Обозначение f (се) и rh. (Се) с дублирующим синонимом, помещенным в скобки, более информативно для читателя, чем обозначение этих антигенов как f и rhj, поскольку указывает на генетическую подоплеку их формирования (позицию цис генов се или Се). Антиген f продуцируется комбинацией генов с иев положении цис. При размещении генов спев позиции транс антиген f не формируется. Аналогичная ситуация имеет место в отношении антигена rh., который вырабатывается в том случае, если как минимум на одной из унаследованных гомологичных хромосом в позиции цис расположены локусы Си е. Гены С и ев позиции транс антигена rh. (Се) не производят.
Антигены резус встречаются с частотой: D - 85 %, С - 70 %, с - 80 %, Е - 30 %, е - 97,5 %. В табл. 4.6 представлены варианты фенотипов и генотипов Rh, а также результаты серологических реакций, в которые вступают эритроциты с тем или иным сочетанием антигенов резус. Фенотип Rh-Hr выявляют с помощью
5 сывороток: анти-D, анти-С, анти-Е, анти-с и анти-е. Сыворотки анти-се, анти- Се, анти-сЕ и анти-СЕ обнаруживают на эритроцитах дополнительный антигенный продукт, кодируемый генами, когда они находятся в одном гаплотипе одновременно. Реагирование этих сывороток при одинаковом фенотипе, но разном генотипе людей не совпадает, что может быть использовано для установления генотипа Rh по фенотипу. Например, лица с фенотипом CcDEe (Се+се-сЕ+СЕ-), с большой степенью вероятности (99,99 %) имеют генотип CDe/cDE (генотипы Cde/cDE или CDe/cdE менее вероятны), а лица с тем же фенотипом CcDEe (но Се-се+сЕ~СЕ+) имеют генотип CDE/cde или, что менее вероятно, CdE/cDe.
Выраженность антигенов Rh на эритроцитах варьирует в широком диапазоне. Выделяют сильные, средние и слабые формы антигенов. Эритроциты, несущие эти формы, обычно не имеют качественных различий, но отличаются от образца к образцу степенью агглютинабельности. Выраженность агглютинации (агглютинабельность) определяется количеством антигена, представленного на поверхности эритроцитов, что обусловлено генетическими факторами. Агглютинабельность эритроцитов людей с генотипом cDE/cDE выражена сильнее, чем эритроцитов лиц с генотипом CDe/CDe, поскольку количество антигенных участков на эритроцитах DE больше, чем на эритроцитах DC. Редкий фенотип -D-, при котором отсутствуют антигены С, Е, с и е, отличается наиболее высоким содержанием субстанции D по сравнению с нормальным D-типом. Менее всего антиген D выражен на эритроцитах со слабым D-фенотипом (Du) и совсем не выражен на эритроцитах Rhnull.
В редких случаях варианты агглютинабельности могут быть обусловлены качественными различиями парциальных антигенов, которые содержат неполный набор D-эпитопов.
После открытия групповых антигенов возникла проблема установления их структуры. Задачей иммунохимиков в области групп крови человека являлось выделить и охарактеризовать структуры, ответственные за специфические свойства веществ, обладающих антигенной активностью, и объяснить, почему они независимы в серологических реакциях.
Выделение антигенов А и В из эритроцитов оказалось непростой задачей. На эритроцитах и других клетках они представлены в водонерастворимой форме. Их удалось выделить экстракцией этанолом. Однако вскоре выяснилось, что эти вещества содержатся во многих органах и тканях организма человека, при этом они растворимы в воде. Для их выделения к 5 г различных тканей добавляли 25 мл воды, экстракт кипятили в течение 10 мин и затем центрифугировали. Полученный осадок растворяли в 2,5 мл изотонического раствора натрия хлорида. О присутствии субстанций А и В судили по способности экстрактов угнетать активность анти-А- и/или анти-В-антител (Freidenreich и Hartmann, 1938).
Эти и другие подобные исследования позволили установить, что наибольшее количество вещества А и В содержится в секреторных тканях (слизистая оболочка желудка, слюнные железы, жидкость кист яичников) и в меконии.
Эти же вещества были выделены из стенок желудков лошадей, коров и свиней. Процедуру чаще выполняли замораживанием - оттаиванием экстрактов с последующим растворением высушенного осадка в охлажденном 90% растворе фенола. Фракция, не поддававшаяся растворению, обладала наибольшей антигенной активностью. Высокой степени очистки удавалось добиться ультрацентрифугированием и использованием органических растворителей, например этанола. Оказалось, что по своей природе группоспецифические вещества А, В и Н являются мукополисахаридами, содержащими приблизительно 85 % углеводов и 15 % белков. Мягкий кислотный гидролиз приводил к исчезновению специфической активности субстрата. При этом высвобождались сахара. Изучение структуры полисахаридов клеточных мембран бактерий подтвердило их антигенные различия, обусловленные именно присутствием тех или иных терминальных углеводных группировок.
Существенный прогресс в изучение природы веществ А, В и Н внесли работы Watkins’а и Morgan’а, показавших присутствие анти-Н-подобных агглютининов в сыворотке угря. Последние вызывали агглютинацию эритроцитов человека группы О. Их активность ингибировалась L-фукозой. При последующих исследованиях обнаружено, что способность анти-А-лектинов агглютинировать эритроциты А устраняется добавлением в них Ы-ацетил-О-галакгозамина. Анти-В-антитела нейтрализовались D-галакгозой соответственно. Эти результаты были подтверждены при использовании экзогликозидаз, выделенных из Trichomonas foetus и Clostridium welchii. Указанные ферменты разрушали вещества А, В и Н. В то же время активность этих ферментов устраняли К-ацетил-Б-галакгозамин, D-галактоза и L-фукоза соответственно, что указывало на химическую природу группового вещества.
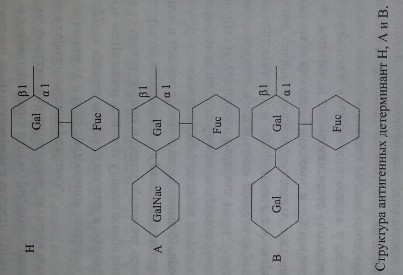
В настоящее время химическая структура групповых веществ хорошо изучена (рис. 3.6).
Антигены систем АВО и Н представляют собой олигосахаридные цепи, связанные с полипептидами (гликопротеины) или церамидами (гликосфинго- липиды).
Выделяют 2 класса олигосахаридных цепей, которые экспрессируют АВН- антигены. Первый из них представлен N-гликанами - разветвленными структурами, связанными через аминогруппы аспарагина, и N-ацетилглюкозамин. Второй класс представлен О-гликанами, имеющими простую или сложную структуру, связывание в них происходит через гидроксильные группы серина или треонина также через N-ацетилглюкозамин.
Гликосфинголипиды (углеводные цепи, присоединенные к церамиду) подразделяют в зависимости от биохимической природы на глобозиды, лактозиды и ганглиозиды.
Основная масса антигенов Н, А и В организма представлена гликопротеинами, доля гликосфинголипидов существенно меньше.
Антигены Н, А и В формируются трансферазами, которые присоединяют соответствующие моносахариды к цепям-предшественникам.
Н-антиген представлен L-фукозой, присоединенной в позиции С-2 терминального галактозного остатка.
А- и В-антигены появляются в результате присоединения к фукозилиро- ванному галакгозному остатку (Н-антигену) N-ацетил-Б-галактозамина или D-галактозы в позиции С-3. Хотя структура Н-антигена представлена не только фукозой, данная группировка считается иммунодетерминантной, поскольку де- фукозилирование приводит к утрате Н-серологической активности субстрата. Аналогичным образом 1Ч-ацетил-0-галактозамин и D-галактозу относят к имму- нодетерминантным структурам, определяющим А- и В-серологическую активность соответственно (Schenkel-Brunner [195]).
Выделяют шесть типов АВН-активных цепей (типы 1 - 6). Цепи типа 1 присутствуют в секретах, плазме и тканях энтодермального происхождения. Цепями типа 2 представлено большинство АВН-активных олигосахаридов на эритроцитах и в тканях экто- и мезодермального происхождения. Тип 3 несет антигенные детерминанты в гликолипидах эритроцитной мембраны и в муцине у индивидов группы A (Anstee [68]). Тип 4 связан с гликолипидами и представлен в небольшом количестве на эритроцитах (Anstee [68], Daniels [87], Schenkel-Bnmner [195]). Тип 6 присутствует в виде свободных олигосахаридов в грудном молоке и моче. Цепи 5-го типа в организме не встречаются, они синтезированы искусственно (Daniels [87], Schenkel-Brunner [195]).
Синтез Н-антигена происходит при участии а1,2-Ь-фукозилтрансферазы, которая обеспечивает перенос фукозы от гуанозин-дифосфата (ГДФ) к галактоз- ному остатку цепи-предшественника в позиции С-2. Известны 2 типа al,2-L- фукозилтрансферазы, синтез каждого из них контролируют высокогомологичные, однако генетически независимыме друг от друга локусы FUT1(H) и FUT2(SE). Они расположены на хромосоме 19. Продукты указанных генов (ферменты) обеспечивают фукозилирование и образование Н-активных структур в различных тканях. FUT1(H) обладает большей аффиностью к цепям типа 2, в то время как FUT2(SE) - к цепям 1-го типа. У подавляющего большинства людей антиген Н присутствует в обязательном порядке, Н-дефицитные фенотипы очень редки.
Н-антиген, образовавшийся в результате действия al ,2-Ь-фукозилтрансфераз, является субстратом для дальнейшего шикозилирования А- и В-специфическими трансферазами, обеспечивающими присоединение иммунодетерминантных группировок: М-ацетил-О-галактозамина и/или D-галакгозы, после чего субстрат приобретает А- и/или В-антигенные свойства.
Гены, контролирующие А- и В-трансферазы, независимы от локусов FUT1(H) и FUT2(SE), картированы на хромосоме 9, в локус АВО. Последний нередко содержит молчащие аллели О1, О2 и др., в присутствии которых синтеза А- и В-трансфераз не происходит. У лиц, гомозиготных по таким аллелям, вещество Н не конвертируется далее в антигены А.
Присутствие Н-, А- и В-трансфераз в сыворотке крови и на эритроцитах устанавливают с помощью специфических антител, которые нередко образуются после трансплантации органов (Eiz-Vesper и соавт. [96]).
Н. В. Бовин и др. (1990) создали искусственные А- и В-субстанции биохимическим синтезом, однако они, несмотря на их структурное сходство с естественным группоспецифическим веществам, не нашли применения, поскольку их адсорбционная активность в отношении а- и (3-изогемаагглютининов была низкая.
Сочетание гена Я с геном Se приводит к тому, что на эритроцитах присутствует вещество Н одновременно с А и/или В в зависимости от того, какой аллель АВО унаследован (табл. 3.13). Если аллель Se по наследству не передается, то вещества А, В и Н в секретах практически отсутствуют (обычные невыделители).
Гомозиготные комбинации генов h и se проявляются как Н-дефицит и невы- делительство.
Другие варианты гена h способны кодировать синтез вещества Н в небольшом количестве. Последнее преобразуется нормально функционирующими А- и В-трансферазами в небольшое количество антигенов А и В, которые можно выявить с помощью адсорбции - элюции.
Распределение группоспецифических веществ А, В и Н у лиц с Н-дефицитом|
Фенотип |
Гены |
АВН-вещества на эритроцитах |
АВН-вещества в слюне |
|
Выделитель АВН |
Я, Se, (АВО) ’ |
Н (А или В) |
Н (А или В) |
|
Невыделитель АВН |
Я, sese, (АВО) |
Тоже |
нет |
|
Oh Indian тип 1 |
hh, sese, (АВО) |
нет |
Тоже |
|
Oh Indian вариант |
hh, sese, (АВО) r' |
Следы Н, А и/или В |
" |
|
Oh Reunion тип Afa и Bfa |
hh, sese, (ABO) |
То же |
|
|
Н-дефицитный выделитель ОО |
hh, Se, 00 |
Следы Н |
н |
|
Н-дефицитный выделитель с наличием генов А или В |
hh, Se, А или В |
Следы А или В |
*Н, А или В |
Как указывалось выше, у гомозигот hh при отсутствии гена Se вещества Н, А и В в секретах отсутствуют. Эти лица способны образовывать анти-Н-антитела.
При отсутствии гена Я (комбинации: hh, Se, ОО', hh, Se, А или В) синтеза соответствующего группоспецифического вещества на эритроцитах не происходит. В то же время в плазме крови и секретах вещество Н определяется, поскольку Se- специфическая трансфераза присоединяет L-фукозу к цепям-предшественникам типов 1 и 3. Некоторое количество этой Н-субстанции адсорбируется на эритроцитах, чем и можно объяснить слабоположительные реакции эритроцитов с анти- Н-антителами у обладателей Н-дефицитного фенотипа.
с / Синтезируемые за счет других трансфераз А- и В-подобные вещества также могут быть адсорбированы эритроцитами и их небольшое количество может быть обнаружено на указанных клетках.
Наилучшим образом возникновение различных Н-дефицитных фенотипов (Бомбей, пара-Бомбей, Реюнион, Нт) объясняет концепция взаимодействия генных локусов H/h и Se/se. Теоретически у родителей Hh,Sese х Hh, Sese возможно рождение детей как с фенотипом Бомбей (hh, sese), так и другими Н-дефицитными фенотипами (hh, Sese; hh, SeSe) с наличием выделительства. В действительности такие сочетания генов чрезвычайно редки. Во-первых, аллель h крайне редок. Во-вторых, гены указанных локусов настолько тесно сцеплены между собой, что вероятность рекомбинаций между ними очень мала.
С помощью молекулярно-генетических методов идентифицировано несколько вариантов аллеля h, однако неясно, отличаются ли они между собой в функциональном отношении. Некоторые из указанных аллелей способны кодировать синтез незначительного количества вещества Н. Несмотря на многочисленные доказательства независимости локусов Hh и Sese друг от друга, кодируемые ими фукозил-трансферазы обладают перекрестной способностью к гликозили- рованию соответствующих исходных субстратов. Так, //-специфическая транс- фераза, присоединяющая L-фукозу к цепям типов 2 и 4, проявляет тропность в отношении цепей типов 1 и 3. Соответственно ^-специфическая трансфера- за, гликозилирующая цепи типов 1 и 3, захватывает в этот процесс цепи типов 1 и 4. Такая перекрестная активность в ряде случаев лежит в основе следовой экспрессии антигенов А, В и Н на эритроцитах.
Антигены А, В и Н, адсорбированные из плазмы
Большая часть антигенных веществ А, В и Н синтезируется в процессе эритрогенеза за счет активности соответствующих трансфераз. Вместе с тем неко- тороее количество указанных группоспецифических субстанций эритроциты адсорбируют из плазмы. Гликосфинголипиды, присутствующие в плазме и несущие вещества Н, А или В, могут встраиваться в мембрану эритроцитов.
Renton и Hancock в 1962 г. обнаружили, что эритроциты группы О, перелитые реципиенту с группой А, приобретают А-антиген. Указанные эритроциты реагировали с антителами анти-А,В и лектином анти-Aj из Dolichos biflorus. С сывороткой анти-А лиц группы В эти эритроциты не реагировали. Авторы установили, что антитела анти-А,В взаимодействуют с детерминантами, расположенными на цепях типа 1 и 2, в то время как лектин распознает антигенную детерминанту, локализованную на цепях типа 2. Подобную картину наблюдали в экспериментах с эритроцитами Oh. После контакта с гликолипидной фракцией плазмы лиц О Le(a-b-) выделителей эритроциты Oh приобретали способность агглютинироваться антителами против цепей 1Н-типа, но не агглютинировались анти-Н-антителами, присутствующими у лиц Oh, а также анти-Н-лектином из Ulex europaeus. Очевидно, что антитела анти-Н, имеющиеся у лиц О., подобно анти-Н-лектину из Ulex europaeus, распознают А-антигенную детерминанту на цепях 2Н-типа.
Лимфоциты приобретают антигены Н, А и В из плазмы. Эти антигены встраиваются в мембрану химическим путем в виде гликосфинголипидов, вырабатываемых секреторными клетками. Существует и другое суждение: все групповые АВО-антигенные детерминанты, присутствующие в этх клетках, пассивно адсорбированы ими из плазмы. Изогемагглютинины, нередко содержащиеся в ти- пирующих анти-НЬА-сыворотках, могут реагировать с АВО-антигенами лимфоцитов, адсорбированными из плазмы, и искажать результаты лимфоцитотоксического теста.
На тромбоцитах антигены Н, А и В появляются за счет не только адсорбции указанных субстанций из плазмы, но и собственного синтеза. Тромбоциты лиц А2 несут меньше антигена А по сравнению с людьми, имеющими подгруппу Аг
Race и Sanger [184] предложили разделить подгруппы В на три категории (табл. 3.11).
Приобретенный В-антиген выражен слабее по сравнению с нормальным В-антигеном у лиц группы В и АВ. Отмечены количественные вариации его экспрессии. Его лучше определять антителами анти-В от лиц А2, чем от лиц Аг В сыворотке крови некоторых людей О и А присутствует особая фракция антител, специфически реагирующих с приобретенным В-антигеном. Последнюю можно выделить адсорбцией - элюцией. Некоторые моноклональные антитела анти-В реагируют с приобретенным В-антигеном. При иммунизации животных также удавалось получить антитела, которые специфически реагировали с приобретенным антигеном В.
Группа крови лиц с приобретенным В-антигеном в рутинных тестах интерпретируется как АВ (Gerbal и соавт. [111]). Описано гемотрансфузион- ное осложнение с летальным исходом, когда реципиент группы А с приобретенным антигеном В получил трансфузию эритроцитов АВ (Garratty и соавт. [108]). Отмечено также, что эритроциты, несущие приобретенный В-антиген, нередко обладают полиагглютинабельностью (Veneman и соавт. [216]). Первоначально полагали, что появление антигена В обусловлено адсорбцией на эритроцитах А В-подобных бактериальных гликолипидов. Позднее было показано, что приобретенный антиген В является результатом своеобразного энзимирования эритроцитов, сопровождающегося деацетилированием мембраны (Schenkel-Bnmner [195]). Сыворотки крови некоторых лиц с приобретенным В-антигеном обладали способностью конвертировать эритроциты А в А(В) (Stayboldt и соавт. [204]). Оказалось, что они содержат фермент, вызывающий частичное деацетилирование N-ацетилгалактозамина, в результате чего появляется В-серологическая активность, выявляемая моноклональными антителами (Okubo и соавт. [173]). В пользу деацетилирования как причины указанного феномена свидетельствовали также другие факты: во-первых, только эритроциты группы А способны приобретать антиген В, во-вторых, экспрессия приобретенного антигена В обратно пропорциональна А-серологической активности эритроцитов.
Деацетилазы удалось выделить из культуры Clostridium tertium и некоторых штаммов Escherichia coli. С помощью этих ферментов на эритроцитах А удавалось воспроизвести В-серологическую активность. Эритроциты группы О такой конверсии не поддавались (Herron и соавт. [118]). Обработка эритроцитов, несущих приобретенный антиген В, ангидрид ацетатом устраняла В-серологическую активность, при этом экспрессия антигена А восстанавливалась до первоначального уровня (Gerbal и соавт. [112]).
А-трисахариды, деацетилированные химическим путем, ингибировали активность анти-В-антител по отношению к приобретенному В. По отношению к нормальному антигену В ингибиции не наблюдали. В-трисахариды, в которых галактозный остаток был заменен на аминогруппу, обладали аналогичным эффектом. Агглютинация с приобретенным антигеном В не происходила, если в пробу добавляли галактозамин (Schenkel-Brunner [195]). С помощью молекулярно-генетических методов удалось дифференцировать лиц с обычным (врожденным) и приобретенным антигеном В (Fisher и соавт. [105]).
Н-дефицитные фенотипы
Как уже отмечалось выше, антиген Н является единственным серологически определяемым антигеном системы Hh. Эта система генетически независима от АВО, но вместе с тем обе системы имеют отчетливую фенотипическую связь. Экспрессия антигена Н неодинакова на эритроцитах разных групп, особенно слабых подгрупп, и убывает в последовательности О > А2 > А2В > В > Al > AtB.
У подавляющего большинства людей (99,99 %) эритроциты содержат Н-антиген, однако существуют редкие, Н-дефицитные фенотипы, при которых антиген Н отсутствует [77-79, 81]. К ним относят типы Бомбей и пара-Бомбей.
Оh (Bombay)
В 1952 г. Bhende и соавт. описали 3 жителей Бомбея (Индия), имевших необычную группу О. Сыворотка их крови агглютинировала эритроциты А, В и, что было весьма неожиданным, эритроциты О. При этом собственные эритроциты не агглютинировались. Помимо антител анти-А и анти-В, сыворотки указанных лиц содержали антитела анти-Н, в то время как антиген Н в эритроцитах отсутствовал, что также несвойственно группе О. Фенотип получил обозначение Bombay или Oh. Исследователи предположили, что локус АВО может содержать еще один аллель, который будучи в гомозиготной форме, приводит к формированию фенотипа Oh. Высказано также предположение, что указанный фенотип является результатом действия супрессорного гена, независимого от АВО. В последующие годы были найдены другие образцы крови Бомбей, в основном, среди лиц индийского происхождения (Abu Sin и соавт. [65], Aloysia и соавт. [67], Beattie и соавт. [70], Beranova и соавт. [75], Bhatia и соавт. [77, 78], Hrubishko и соавт. [120], Kitahama и соавт. [130], Moores и соавт. [160], Sringarm и соавт. [202]).
Н-дефицитные фенотипы встречаются крайне редко. Помимо индийцев они выявлены у тамилов - островитян Индийского океана, японцев, американских негров, жителей Таиланда и Судана (Daniels [87]).
Родителями лиц Oh часто являлись кровные родственники (Bhatia и соавт. [77, 79]). Во всех случаях о необычном фенотипе свидетельствовало присутствие антител анти-Н, агглютинирующих эритроциты О.
В слюне лиц Oh вещества А, В и Н отсутствуют.
Посемейные исследования подтвердили, что к возникновению фенотипа Бомбей гены локуса АВО не имеют прямого отношения.
Считается, что аллелем гена Я является молчащий ген h. Таким образом, фенотип Oh, лишенный антигена Н, возникает у лиц, гомозиготных (hh) по этому редкому аллелю (Ogasawara и соавт. [172], Wagner и соавт. [221]). Высказанное авторами предположение подтвердили молекулярно-генетические исследования Lee и соавт. [139], Schenkel-Brunner [195], Wagner и соавт. [221], показавшие,
эритроцитов специально подобранными трансферазами (а-галактозилазой, экстрагированной из Trichomonas foetus) приводила к появлению Н-активности с одновременной утратой антигена В. Далее эти эритроциты (Н+В-) удавалось конвертировать в Ah(A+H~) добавлением А-трансферазы [195].
Эритроциты лиц Oh Reunion выделителей не агглютинируются большинством анти-Н-сывороток и лишь иногда дают слабоположительные реакции с высокоактивными анти-Н-антителами, присутствующими в сыворотках крови некоторых лиц Oh, или с другими анти-Н-реагентами. Эритроциты таких лиц обычно не реагируют с антителами анти-А и анти-В, однако клетки некоторых индивидов OhA выделителей могут вести себя в серологических тестах как Ах, демонстрируя слабоположительные реакции с высокоактивными антителами анти-А,В лиц О. Подобные слабые варианты антигена В описаны у лиц OhB.
В секретах лиц Oh Reunion выделителей содержание вещества Н в норме, субстанции А и В также присутствуют, если данные лица имеют гены А и
В. Сыворотки крови лиц Oh Reunion почти всегда содержат слабые холодовые анти-Н-подобные антитела. Их активность не ингибируется слюной выделителей групповых субстанций, они не реагируют с эритроцитами О новорожденных. Полагают, что эти антитела имеют специфичность анти-HI.
Индивиды, отнесенные к Н-дефицитному типу, найдены среди представителей различных этнических групп - жителей Индии, Европы, Японии, Китая, Юго-Восточной Азии, Среднего Востока, коренных жителей Америки. Их выявляли с частотой от 1 на 5000 среди жителей Таиланда до 1 на 8000 - 1 на 16 000 среди китайцев.
Hm
Еще одна серия Н-дефицитных фенотипов характеризуется следовым количеством или полным отсутствием антигенов А, В и Н на эритроцитах и одновременно нормальным количеством соответствующих группоспецифических субстанций в секретах. Указанные фенотипы обозначены как Omh, Amh и В \ В настоящее время их называют Oh, Ah, Bh выделителями. Угнетение синтеза вещества Н у лиц Нт не столь выражено, как у лиц с фенотипами Бомбей, пара- Бомбей и Реюнион. Эритроциты Нт слабо реагируют с анти-Н-антителами, а строма эритроцитов и слюна таких лиц содержит вещество Н в норме.
Остается неясным: имеет ли указанный фенотип какие-либо селективные преимущества в регионе Индийского океана, где он в основном встречается?
Новости медицины
Много миллионов человек в мире принимают статины, но исследования показывают, что только 55% из тех, кому рекомендуется принимать статины, принимают их. Это большая проблема, потому что исследования также показывают, что те из группы...
Связанное с беременностью высокое кровяное давление может привести к долгосрочным сердечным рискам, показывают новые исследования.
Кэролин Консия, столкнулась с более серьезными последствиями репрессий против назначения опиоидов, когда узнала, почему сын ее подруги покончил с собой в 2017 году.
Новое исследование показывает, что психические заболевания не являются фактором большинства массовых расстрелов или других видов массовых убийств.