Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система RH
Антиген D (резус-антиген, резус-фактор, стандартный резус-антиген) после групповых антигенов А и В имеет наибольшее значение в трансфузиологии и акушерстве. Он присутствует у лиц с генотипом D/D и D/d. Как и другие Rh-антигены, антиген D содержится в мембране эритроцитов. Со слюной он не выделяется и в других жидкостях и тканях организма не представлен. Лица, не содержащие антигена D, естественных антител против него, подобных групповым изогемагглютининам, не имеют.
Формирование эпитопов D кодируется экзонами 4 и 5 гена RHD. Avent и соавт. [143], Huang [355] считают, что конверсия генов в этих экзонах обусловливает крайне низкую экспрессию D-антигена.
У большинства людей D- имеется полная делеция гена RHD [138, 233, 368, 418, 616]. Соответствующего генетического эквивалента в виде d/d у них не найдено.
В редких случаях у людей D- наблюдали частичную делецию гена RHD, особенно среди лиц с фенотипом Cde, cdE, имевших экзоны ДЯО-гена, которые не были функциональными.
У другого человека было выпадение 4 нуклеотидов в секторе экзона 4 [137], что, как полагают авторы, могло привести к повреждению считывания нормального гена, в результате чего ген не проявлял себя фенотипически.
Иммунодоминантные протеины D+ и D- отличаются 36 аминокислотными заменами, из которых 8 расположены на внеклеточных гидрофильных петлях протеина в позиции 169, 170,172,233,238,350,353,354. Эти замены с их молекулярным окружением, по-видимому, и являются D-несущими детерминантами, способными связываться с анти-О-антителами.
Green [319], Le Van Kim и соавт. [418], Schmitz и соавт. [600] полагали, что экспрессию антигенов D, С и с обусловливает цистеиновый остаток, расположенный экзофациально в позиции 285.
Suyama и соавт. [646] не разделяли эту точку зрения, предположив, что Cys 285 не является определяющим в экспрессии антигена D.
Smythe и соавт. [618] применили трансфекцию генов ЛЯ в клетки К562, чтобы экспрессировать антигены Rh. В некоторые клетки К562 вводили мутантный || D, кодирующий в позиции 285 аланин вместо цистеина. Трансфертные клет-и экспрессировали одно и то же количество D-антигена независимо от того, провала вживляемая кДНК в позиции 285 цистеин или аланин.
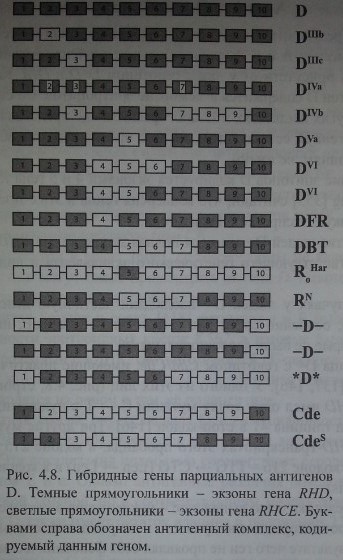
Гибридные гены парциальных антигенов D. Темные прямоугольники - экзоны гена RHD, светлые прямоугольники - экзоны гена RHCE. Буквами справа обозначен антигенный комплекс, кодируемый данным геном.
Moore и Green [481] обнаружили, что в процессе иммунной преципитации полипептидов D и сЕ специфическими антителами одновременно с полипептидами преципитируются N-гликозилированные белки, получившие название RhAG (Rh-ассоциированные гликопротеины), или Rh-гликопротеины. Компоненты этих белков, сопровождающие полипептиды D и еС, имели несколько отличающуюся мол. массу, но одинаковую N-концевую аминокислотную последовательность [147].
Ridgwell и соавт. [565] клонировали фрагменты кДНК, соответствующие
Rh-связанному гликопротеину, и выделили кДНК полной длины из библиотеки кДНК костного мозга человека. Полученный Rh-гликопротеин содержал 409 аминокислот и имел, подобно полипептидам Rh, 12 мембранных доменов с внутриклеточными N- и С-концевыми участками. Аминокислотная последовательность Rh-гликопротеина и Rh-полипептида различалась. Сходство ограничивалось двумя аминокислотными остатками в первом и пятом домене: Glu 13 и Glu 146 - в гликопротеине Rh, Glu 21 и Glu 146 - в полипептиде Rh [565].
Структура генов RH
В 1972 г. Ruddle и соавт. [587] удалось определить, что генный локус системы резус расположен на хромосоме 1. Затем он был картирован на коротком плече хромосомы в участке 1р34.3-р36.13 [211,453,462].
Когда была получена кДНК, соответствующая Rh-полипептидам, ее можно было использовать в качестве зонда в Саузерн-блоте для исследования геномной ДНК, т. е. определения структуры генов RH.
Результаты этих исследований подтвердили, что локус RH включает 2 очень похожих гена (СЕ и £>), а один из этих генов отсутствует в гДНК, выделенной у нескольких неродственных лиц D- [233]. Таким образом была установлена молекулярная основа общего для европеоидов фенотипа Rh-, который часто обусловлен делецией гена D.
Ген D включает 10 экзонов и имеет организацию, похожую на структуру гена СЕ, но не идентичную ей (см. рис. 4.7).
Гены D и СЕ различаются по интрону 4 [138]. В гене СЕ имеется делеция 650 пар нуклеотидов, начинающаяся в интроне 4 от нуклеотида 181 [146]. Интрон 4 гена СЕ имеет 1976 пар нуклеотидов. Нуклеотиды в положении 1-181 и 831-1076 примерно идентичны в генах D и СЕ. Интрон 5 генов DnCE включает 1636 пар нуклеотидов. Имеется 29 нуклеотидных различий между этими двумя генами (98,2 % гомологии).
Организация гена СЕ исследована Cherif-Zahar и соавт. [209]. В связи с тем что антиген D обусловлен геном, отсутствующим у людей Rh-, определение молекулярной структуры антигенов Сс и Ее упростилось.
Mouro и соавт. [496] экстрагировали матричную РНК людей с редким фенотипом СсЕе и использовали синтетические олигонуклеотидные праймеры в присутствии обратной транскриптазы для получения кДНК полной длины, соответствующей продукту гена СЕ.
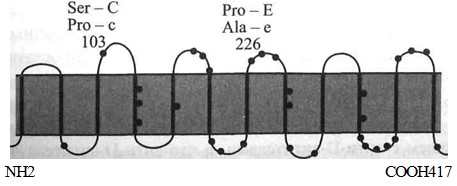
Присутствие антигенов Е и е было обусловлено заменой пролина на аланин в позиции 226. Пролин в этой позиции придавал субстрату специфичность Е, аланин - специфичность е (см. рис. 4.5).
При сравнении кДНК лиц, содержащих антигены С и с, ситуация ока-лась сложнее. Наблюдали 6 различий в нуклеотидах, одна часть из которых (Cysffl6, He 60, Ser 68, Sep 103) коррелировала с экспрессией С, другая (Тгр 16, Leu 60, Asn 68, Pro 103) - с экспрессией с (hr1) [496]. Эта находка была подтверждена амплификацией гДНК от людей с известным фенотипом: экзон 1 и 2 кодировал остатки, специфичные для антигенов Сс, а экзон 5 | специфичные для антигенов Ее.
Cherif-Zahar и соавт. [208] высказали предположение, что, хотя антигены Сс и Ее являются продуктами одного и того же гена и кодированы одним видом мРНК, возможен альтернативный сплайсинг, формирующий несколько белков. Полипептид полной длины кодирует экспрессию антигенов Ее, а не Сс; сплай-сеоформа, в которой отсутствует экзон 5, кодирует экспрессию Сс, но не Ее. Гипотеза подтверждается тем фактом, что из препаратов мРНК людей Rh- могут быть выделены разные продукты гена СЕ.
По мнению Umenishi и соавт. [666], сплайсеоформы не являются производными гена СЕ\ они могут также происходить от гена D. Некоторые сплайсеоформы выделены из незрелых эритробластов.
В экспериментах Smythe и соавт. [618] антигены с и Е были получены de novo на поверхности эритроидных клеток К562, в которые был введен ретро-вирус, комбинированный с кДНК, соответствующей сЕ-экспрессии. Поскольку использованная кДНК была полной длины, это отчетливо подтвердило, что антигены с и Е находятся на одном и том же полипептиде.
Аминокислотная замена, определяющая Е- и е-специфичность [Pro 226 (антиген Е), Ala 226 (антиген е)], находится в четвертой внеклеточной петле полипептида СЕ. Эта локализация полностью соответствует серологическим различиям антигенов Е и е. Однако антигенные различия обусловлены не только аминокислотной заменой, но и соответствующим молекулярным окружением. Полипептид D также имеет остаток аланина в положении 226, но не несет е-антигенности.
Структура антигенов С и с сложнее, потому что полипептиды СЕ имеют 4 аминокислоты для антигена С и 4 - для антигена с, одна из которых [Ser 103 (антиген С) или Pro 103 (антиген с)] расположена на второй внеклеточной петле полипептида.
Три из четырех аминокислот (Не 60, Ser 68, Ser 103), которые отличают С-активный полипептид от с-активного, обнаружены также в D-полипептиде. Этщ 3 аминокислоты кодируются экзоном 2 гена СЕ и экзоном 2 гена D. Не исключено, что именно благодаря этому подобию антигенов D и С антитела анти-D могут содержать анти-С-специфичность даже в тех случаях, когда эритроциты, послужившие антигенным стимулом, не имели серологически выявляемого антигена С, т. е. это был «чистый D». Во многом идентичная топология полипецтидов, кодируемых генами D и СЕ, лежит в основе перекрестных реакций антигенов и антител системы резус.
Считается, что гены RH синтезируют полипептиды, несущие Rh-антигены, не используя субстанций-предшественников.
В 1990-х годах 2 лаборатории независимо друг от друга получили совершенно одинаковые клоны кДНК полипептидов RhcE (Cherif-Zahar и соавт. [208], Avent и соавт. [148]).
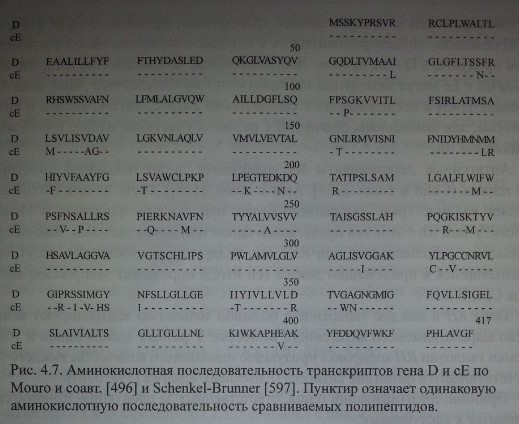
Выделение кДНК, соответствующей полипептиду D, было осуществлено независимо 3 исследовательскими группами (Le Van Kim и соавт. [418], Агсе и соавт. [138], Kajii и соавт. [390]). Последовательность аминокислот в белках, полученных при помощи кДНК RhD, отличалась от аминокислотной последовательности полипептида RhcE по 34-36 аминокислотным остаткам из 417 последовательностей (рис. 4.7).
Аминокислотная последовательность транскриптов гена D и сЕ по Mouro и соавт. [496] и Schenkel-Brunner [597]. Пунктир означает одинаковую аминокислотную последовательность сравниваемых полипептидов.
Полипептиды D и сЕ имеют высокую степень гомологии: клон полипептида D, выделенный Агсе и соавт. [138], был на 96 % идентичен клону полипептида сЕ по последовательности нуклеотидов кДНК и на 92 % идентичен по структуре белка.
Le Van Kim и соавт. [418] показали, что полученные ими клоны кДНК являются продуктом гена Д поскольку фрагменты геномной ДНК, с которыми совпадали эти клоны, были получены от людей с фенотипом D+.
В то же время Kajii и соавт. [390] установили, что полученные ими клоны не были продуктом гена Д поскольку кДНК была идентифицирована у человека с фенотипом D-C+c+E+e+.
Данные о том, что у некоторых людей фенотип D- обусловлен делецией гена Д были получены Colin и соавт. [233] в экспериментах с использованием метода Саузерн-блот.
Целью молекулярно-биологических исследований было ответить на вопрос: находятся ли антигенные детерминанты D, С/с и Е/е на разных белковых структурах или же они присутствуют на одном и том же полипептиде? Другой целью этих исследований было установить молекулярную структуру вариантов Rh-антигенов и кодирующих их генов.
Эксперименты с использованием трансфекции фрагментов ДНК [196, 496, 618] показали, что детерминанты С/с и Е/е расположены на одном полипептидном продукте, a D - на другом. Дополнительные доказательства того, что антигены Сс и Ее могут находиться на одном и том же полипептиде, получены Avent и соавт. [145] в исследованиях с сыворотками анти-С, анти-с, анти-Е и анти-е, которые, как выяснилось, реагируют с разными участками одного и того же полипептида Rh.
Антигенные детерминанты Rh кодируются двумя похожими по структуре генами (Colin и соавт. [233], Агсе и соавт. [138]). Один из них (RHD) определяет наличие трансмембранного белка, придающего эритроцитам D-актив-ность. У лиц Rh+ этот ген представлен одной или двумя копиями. Как уже упоминалось, у большинства лиц Rh- ген, кодирующий субстрат D, отсутствует. Находящийся в прилежащем локусе ген RHCE определяет экспрессию антигенов С, с, Ей е.
Гены RH в каждом гаплотипе с большой точностью контролируют количество вырабатываемого антигенного вещества. У разных членов одной и той же семьи гаплотип RH кодировал продукцию одинакового количества каждого присутствующего в фенотипе антигена (Rosenfield, Kochwa [393, 576]).
Принцип идентификации генов, ответственных за продукцию Rh-антигенов, сводится к следующему:
- выделение несущего Rh-активность белка с помощью преципитации специфическими антителами;
- расшифровка аминокислотной последовательности иммунодоминантного белка, приготовление комплементарных молекулярных зондов и конструкций для идентификации кодирующей ДНК (кДНК);
- вживление (трансфекция) кДНК в клетки или плазмиды, не производящие аналогичного иммунодоминантного продукта;
- идентификация геномного продукта трансфектных клеток или плазмид;
- идентификация геномной ДНК (гДНК), представляющей собой собственно ген с кодовой записью иммунодоминантного продукта.
Антигенные детерминанты Rh расположены на негликозилированных не-фосфорилированных полипептидах с мол. массой 30-32 кДа [129, 295, 483]. Полипептиды RhD и RhcE представляют собой цепь из 12 связанных со скелетом • мембраны доменов [348], пересекающих мембрану эритроцита от эндо- до экзо-целлюлярного уровня (рис. 4.5 и 4.6). Основная часть полипептида размещена в фосфолипидном бислое. На внешней стороне клетки домены соединены 6 выступающими над поверхностью мембраны петлями, на которых также могут располагаться серологически выявляемые Rh-антигены. N- и С-концевые участки полипептида погружены внутрь клетки [196]. Полипептид RhD, полученный искусственно в трансфектных клетках с помощью олигонуклеотидньгх праймеров и соответствующих кДНК людей Rh+, состоит из 417 аминокислот [147,172,590]. Из такого же числа аминокислот состоит полипептид RhcE, полученный таким же способом с использованием кДНК людей Rh- [138,390,418].
Топология мембранных доменов Rh-Hr no Schenkel-Brunner
Полипептид сЕ имеет 6 цистеиновых остатков, 5 из которых расположены в ци-топлазматических петлях. Шестой цистеин (Цис-285) находится в 5-й внеклеточной петле [564]. Цистеин в позиции 311 полипептида RhcE замещен на тирозин в полипептиде RhD. Отдельные последовательности (мотивы), например Cys - His - Leu -Не - Pro в положении 285-289, являются общими для всех эпитопов: D, Сс и Ее.
Высокая степень гомологии между генами RHDи RHCEспособствует генной конверсии, неравновесному кроссинговеру и образованию в результате этого гибридных генов, кодирующих продукцию новых антигенов Rh [597].
Rh-протеины высокогидрофобны и весьма прочно соединены с другими гидрофобными белками мембраны [336]. Обнаружена определенная связь Rh-полипептидов с гликофорином В, антигенами LW, гликопротеином, несущим антигены Duffy, гликопротеином CD47 и так называемым Rh-ассоцииро-ванным гликопротеином.
Rh-антигены устойчивы к воздействию протеолитических ферментов [295]. Антигены D и с (hr') разрушаются под воздействием N-этилмалеинимида, хлор-меркурибензоната и 2-нитробензойной кислоты. Это послужило для исследователей основанием полагать, что Rh-субстанция содержит тиоловые группы [316,319,600,646].
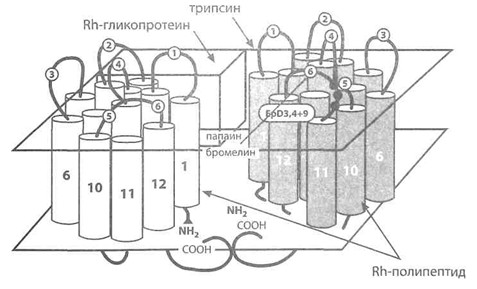
Предполагаемая трехмерная структура доменов Rh-полипептида и Rh-ассоциированного гликопротеина в мембране эритроцита (по Avent [141]). Светлые и темные цилиндры представляют домены Rh-полипептидов D и СЕ с N- и С-терминальными группами. На заднем плане условно представлен Rh-ассоциированный гликопротеин. Указаны участки разрывов при действии трипсина, папаина или бромелина, место расположения эпитопов D3, D4 и D9, экзо- и эндоцеллюлярные петли Rh-полипептида.
Как отмечали Dahr и соавт. [242], серологическая активность D-антигена утрачивалась под действием цистеиновых реагентов. После обработки эритроцитов дитионитробензойной кислотой (ДТНБК) антиген D инактивировался, однако активность его вновь восстанавливалась под действием дитиоэри-тритола. В то же время под действием глютатиона активность D-антигена не восстанавливалась. Обработка эритроцитов хлормеркурифенилсульфониковой кислотой приводила практически к полной потере активности антигена D, которая не восстанавливалась дитиоэритритолом.
Йодацетамид не инактивировал D-антиген - это согласовывалось с предположением Dahr и соавт. о том, что цистеиновые остатки являются непосредственной составной частью D-антигена. Авторы пришли к выводу, что цистеи-новая модификация Rh-протеина, в частности Cys 285 в 5-й внеклеточной петле, приводит к модификации антигена Rh.
Серологическая активность Rh-антигенов, как показал Green [317, 318], во многом зависела от содержания липидов в мембране эритроцитов. После вытяжки липидов из стромы п-бутанолом Rh-активность утрачивалась, а после инкубации стромы с липидным экстрактом она полностью восстанавливалась. Как указывает Schenkel-Brunner [597], липиды необходимы для оптимальной пространственной ориентации других структурных молекул в мембране эритроцита.
Обработка эритроцитов фосфолипазой, расщепляющей жирные кислоты, лектином, фосфатидилэтаноламином или фосфатидилсерином выраженно ин-гибировала активность антигенов с, D и е [320, 3366, 530].
На серологическую активность Rh-антигенов влияло обезвоживание мембраны эритроцитов [154, 181, 609]. Высокий уровень холестерола (соотношение холестерола и фосфолипидов 1,55) совпадал с повышенной вязкостью мембраны и большей выраженностью D-антигена. Низкий уровень холестерола (соотношение холестерола и фосфолипидов 0,55) сопровождался меньшей вязкостью мембраны и менее активным реагированием D-антигена [597].
Отсутствие Rh-полипептидов у людей с фенотипом Rhnul) сопряжено с изменениями в структурной организации липидного слоя мембраны и нарушением водно-ионного транспорта в клетке.
Из ранних работ (до 1960 г.) известно, что резус-антиген термолабилен и слабеет при высушивании (П.Н. Косяков [69]). Сыворотки антирезус снижали свою активность при смешивании со стрептомицином, дериватами рибонуклеиновой кислоты, некоторыми сахарами и другими химическими веществами, из чего авторы делали предположения о возможной химической природе резус-антигена.
Наличие в эритроцитах Rh+ Rh-ассоциированного гликопротеина, по-видимому, вводило в заблуждение исследователей, полагавших, что антигены резус имеют полисахаридную природу.