Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система RH
Клиническое значение парциальных D-антигенов
Эритроциты, не содержащие некоторых D-эпитопов, могут быть типированы как D- и перелиты резус-отрицательным реципиентам. Однако вероятность такой ситуации очень мала. Во-первых, потому что сами парциальные антигены встречаются относительно редко. Во-вторых, доноров D- типируют по антигенам С и Е. В случае ошибочного определения парциального D+ как D-, такие доноры, скорее всего, будут отнесены к резус-положительным, поскольку антигены С и Е сопровождают антиген D в 97 % случаев. В-третьих, современные диагностические реагенты анти-D выявляют частичные D-антигены большинства категорий.
Таким образом, парциальный антиген D у донора не представляет никакой угрозы для реципиента. В противоположность этому парциальный D-антиген у реципиента может оказаться для него фатальным.
Сегодня не вызывает сомнения тот факт, что анти-О-антитела, присутствующие у людей с частичным D, клинически очень важны. Большинство парциальных антител выявлено при анализе причин посттрансфузионных осложнений [668, 670, 671, 706, 716, 717] и ГБН [406, 591, 668, 709]. Некоторые случаи осложнений были тяжелыми, со смертельным исходом.
Парциальные D-антигены так же иммуногенны для резус-отрицательных реципиентов, как эритроциты D+, имеющие полный комплект эпитопов. В этом плане между обычными и парциальными D-антигенами нет существенных различий.
Частота парциальных D-антигенов
Работ по исследованию частоты парциальных антигенов D в литературе пока немного. Первые образцы эритроцитов, содержащих парциальные антигены D, находили случайно: по наличию анти-О-антител у резус-положительных людей. Именно это обстоятельство давало основание утверждать, что эритроциты данного индивида несут парциальный D.
По мере накопления моноклональных анти-О-антител, обладающих узкой антиэпитопной направленностью, появилась возможность более точно ответить на вопрос: какова частота парциальных антигенов D в той или иной популяции?
Другая возможность идентификации парциальных D появилась в связи с применением ПЦР. Оказалось, что эти антигены не столь уж редки. Так, по данным бразильских исследователей Castilho и соавт. [199], из 300 пациентов, получивших множественные трансфузии, 18 (6 %) имели парциальные D-антигены, а 7 из них (2,3 %) содержали парциальные анти-О-антитела. Парциальные антигены распределялись по категориям с частотой 0,6-1,7 % (табл. 4.18).
Таблица 4.18
Частота парциальных антигенов D
|
Всего |
Количество лиц (частота, %), содержащих антиген |
||||||
|
D |
DIVb |
DVa |
Dvi |
DIIIa |
DAR |
dvii |
|
|
300 (100 %) |
(94 %) |
2 (0,6 %) |
2 (0,6 %) |
5 0,7%) |
3 (1 %) |
5 (1,7 %) |
1 (0,3 %) |
Следует отметить, что пациенты, обследованные указанными выше авторами, страдали талассемией и серповидно-клеточной анемией. Возможно, среди таких больных (эритропоэз которых определенно нарушен) парциальные антигены резус встречаются с большей частотой, чем среди здорового населения.
Rios и соавт. [567], исследовав с помощью ПЦР образцы крови 93 негров США и Бразилии, установили, что парциальный антиген DIIIa встречается у 18 % негров. Среди 22 образцов крови доноров европейцев, взятых для контроля, парциальный антиген DIIIa не выявлен.
Описаны случаи появления аутоантител анти-D у лиц с частичным D-фенотипом при первичной иммунизации в результате гемотрансфузии или беремен-сти [216, 375, 454]. Нередко продукция аутоанти-О-антител предшествует одукции аллоанти-О-антител или сопровождает ее.
То что аутоантитела анти-D представляют собой, как теперь полагают, истинные анти-О-антитела, а не мимикрирующие, они не имеют значения в трансфузиологии, поскольку, вопреки ожиданиям, не вызывают лизиса перелитых эритроцитов D+ в кровяном русле реципиента. В некоторых случаях они проявляют слабое гемолитическое действие в отношении собственных эритроцитов, что все-таки свидетельствует об их некотором сходстве с истинными аллоан-тителами, одновременно присутствующими в кровяном русле реципиента.
В одних случаях сначала появлялись аутоанти-О-антитела, которые затем трансформировались в аллоантитела и далее не реагировали с собственными эритроцитами, а также с эритроцитами лиц, имеющих такой же парциальный D-антиген, в других - анти-О-антитела реагировали in vitro с собственными эритроцитами, но in vivo были клинически безвредны. Во всех случаях аутоанти-О-антитела имели транзиторный характер.
Клинический случай. Приводим одно из наблюдений последних лет (Flegel и соавт., 2000 [288]). Пациенту 72 лет, D-, перелили эритроциты нескольких доноров, один из которых, как потом выяснилось, имел слабый антиген D II типа. Через 19 дней у реципиента наблюдали положительную прямую пробу Кумбса и выявили анти-О-антитела в сыворотке и элюате, снятом с его эритроцитов. Через 10 мес. в сыворотке крови пациента присутствовали только аллоанти-О-антитела, аутоантите-ла не определялись. Донор имел фенотип ccDEe со слабым D. Анализ нуклеотидной последовательности его геномной ДНК экзона 9, подтвердил, что донор имел слабый D, обусловленный аллелем слабый D тип 2. Как установили авторы, экспрессия антигена D у донора соответствовала 450 участкам на 1 эритроцит (в норме не менее 10 000). Аналогичный случай аллоиммунизации слабым антигеном D I типа опубликовали Mota и соавт. [491].
Приведенное наблюдение подтверждает положение о том, что процесс аллоиммунизации может сопровождаться продукцией аутоантител и свидетельствует о том, что даже серологически слабовыраженные парциальные антигены с низкой экспрессией могут проявлять иммуногенность.
Поскольку результаты ДНК-типирования пациента авторы не привели, остается не совсем понятным, каким образом специфические анти-О-антитела в аутоиммунном варианте могут связываться, как в рассмотренном случае, с эритроцитами пациента D-. Может быть, пациент все же содержал единичные эпитопы D, образовавшиеся в результате неполной делеции гена RHD.
Тем не менее переключение продукции аутоанти-О-антител на продукцию аллоанти-О-антител у лиц с парциальными D-антигенами факт установленный.
Сыворотка Wiel (см. выделена в 1963 г. Chown и соавт. [227] из сыворотки женщины, миссис Bill cD"E/cde, сенсибилизированной четырьмя трансфузиями и беременностью плодом CuDue/cde. Исходная сыворотка содержала антитела анти-С, анти-Се, анти-Си, анти-V и анти-Dw (Wiel). Очищенные aHTH-Wiel-антитела были получены адсорбцией сопутствующих антител, а также элюцией aHTH-Wiel-антител с эритроцитов, принадлежащих донору Wiel с фенотипом cuDe/cde. В тех случаях, когда говорят о сыворотке Bill, подразумевают цельную сыворотку, а когда о сыворотке анти-Wiel или анти-Dw -адсорбированную сыворотку или элюат, полученный из сыворотки Bill.
Сыворотка анти-Wiel реагирует с антигеном Dw лиц cDwe/cde, CDwe/cde и, по данным Tippett [657], - с антигеном V (ces) лиц D-анти-О категории Dv. С эритроцитами людей CDwe/CDe сыворотка анти-Wiel не реагировала, поскольку ген D в позиции trans формировал у этих лиц нормальный D-антиген. Теперь очевидно, что фактор Dennis является продуктом гена RNM&
Сыворотка Troll найдена в 1958 г. у белой женщины с генотипом Cde/cde.
Причина сенсибилизации не установлена. Женщина имела 2 детей; трансфузий или инъекций крови ей не проводили. Сыворотка содержала антитела анти-Сх, анти-Wr3, анти-Тга, анти-Ву и антитела, обозначенные авторами как Troll-Reynolds. Чистые антитела анти-Troll были получены адсорбцией и элюцией. Они имели такую же специфичность, как и сыворотка Reynolds.
Сыворотка Reynolds найдена Harris в 1961 г. у женщины по имени Elva Reynolds с генотипом CDe/cDE, сенсибилизированной трансфузиями крови (беременностей не было). Ее сыворотка содержала, помимо указанных атипичных антител, антитела анти-Лсь.
Наследование гена RN
Ген RN9 названый так Rosenfield и соавт. [575], был обнаружен у женщины по имени Charlie By и у 3 из 6 ее детей, а также у ее брата и у 3 из 4 его детей. Другими словами, носителями этого гена были сестра и брат семьи By, которые передали его детям. By были неграми, откуда и появился символ N в обозначении этого гена. Далее он был описан в виде генного комплекса, который можно было интерпретировать как (C)Du(e) с сомнительной продукцией антигенов С (rhf) и е (hr").
Rosenfield и соавт. не использовали сыворотки Wiel, Troll и Reynolds. Однако позднее Tippett исследовала мать семьи By и одного из ее детей RN+ и нашла, что оба они Troll положительны. Признак Troll + в этой семье был менее устойчив, чем ген RN, однако сочетание этих редких признаков [слабый С, слабый е и Troll (Reynolds)-] не были взаимосвязаны.
Fred с соавт., а затем Rosenfield и соавт. исследовали семью Co-Gar: мать была Е-е+, ребенок - Е+е-. Позднее был установлен фенотип мужа и бабушки по линии матери. Все они, за исключением мужа, были Wiel+ Troll (Reynolds)+. Фенотип ребенка оказался таким же, как у Dennis'a и By, и все 3 человека были Тго11+.
Интересны их генотипы: муж CDue/cDuE, мать Cueu/cDe, ребенок Cueu/cDuE, бабушка Cueu/CDue. Характерно, что у ребенка антигены С и е слабые, у матери слабый С и, возможно, слабый е, который маскируется нормальным е, унаследованным от отца, имевшего, по-видимому, хромосому cde или cDe. У бабушки слабые антигены Сие маскировались нормальными антигенами Cde.
При серологическом обследовании произвольно взятых лиц некоторые из них оказались Wiel/Troll/Reynolds-положительными:
Мистер Harper - донор-негр. Он был обследован, помимо упомянутых выше Chown и соавт. [224], другими исследователями, в том числе Race и Sanger. Его эритроциты имели антиген D, слабый С, Е, с, слабый е, Rh32. Антигена f они не содержали.
Доктор Molthan исследовала нескольких доноров, родители которых относились к типу RN. ТШегу была одним из них. Ее кровь содержала антиген D, Е, с, слабые Сие.
Миссис Novella Council - негритянка. При тщательном изучении ее эритроцитов было установлено, что она не Cde/Cde, как считали ранее, a CuDue/Cde и относится к типу RN, подобно бабушке из семьи Co-Gar.
Редкий тип крови RN обнаруживают в основном у негров, среди белых он встречается редко. Его не удалось выявить при обследовании 906 лиц белой расы и 1217 их детей.
Закономерен вопрос: не являлся ли ген Dennis геном RN7 Проведено сравнительное изучение крови Dennis'a и образцов крови с фенотипами Wiel+Troll (Reynolds)*, Wiel+Troll (Reynolds)- и Wiel-Troll (Reynolds)-. Образцы крови Dennis'a, матери из семьи Co-Gar и донора ТШегу оказались Wiel+ Troll+ Reynolds+, из чего можно заключить, что ген Dennis идентичен гену RN. Исследование крови другими сыворотками позволило сделать аналогичный вывод. В частности, эритроциты Dennis'a при исследовании их 6 сыворотками анти-С, 3 анти-Се и 1 анти-СЕ показали такие же результаты, как эритроциты матери из семьи Co-Gar, т. е. со всеми сыворотками анти-С не реагировали, с анти-Се реагировали, с анти-СЕ давали слабоположительную реакцию.
Адсорбция - элюция, выполненная в нескольких лабораториях, не опровергла вывод о том, что гены Dennis и идентичны.
По мнению авторов, ген Dennis возник в результате мутации гена CDue, который приобрел способность инициировать наряду с антигенами CDue новый антиген - Troll.
Высказанная гипотеза могла быть подтверждена при обследовании потомков от брака Dennis'a и его супруги, которые могли нести ген RN и содержать антигены Troll и Wiel.
Как отметили авторы, Dennis и его жена, имеющая генотип CDue/CDue, -выходцы из многодетных семей. Однако, несмотря на большое стремление супругов иметь детей, их брак на протяжении многих лет оставался бесплодным. Проведенные специальные исследования не позволили выяснить причину бесплодия.
RHar (Rh33)
Антиген RoHar (DRoHar) получил свое название по имени донора Наг, эритроциты которого были использованы Giles и соавт. [306] для приготовления первой тестовой сыворотки aHTH-Rh33. Донор Наг был резус-отрицательным, однако его эритроциты реагировали с некоторыми сыворотками анти-D и анти-DC. Элюат с эритроцитов Наг после адсорбции одной из сывороток анти-D содержал анти-^Наг-антитела, реагирующие с эритроцитами 2 из 1060 доноров (включая самого Наг).
Эритроциты DRoHar имеют трудно выявляемую форму D-антигена, а также шиженное количество антигенов е, f, и Нго, не содержат часто встречающихся антигенов hrs, G и Нг, то есть содержат набор серологически выявляемых фе-нотипических признаков, отличающих гаплотип RoHar. В связи с этим антиген Rh33 считается маркером гаплотипа ЕЭш сыворотки aHra-Rh33 используют соответственно для идентификации лиц-носителей гаплотипа Лой^в гомо- и гетерозиготной форме. Однако следует заметить, что не все 100 % лиц RoHar являются Rh33+, бывают и исключения.
Антиген Rh33 встречается на эритроцитах с редкими фенотипами: D+G-, e+hrs- и Нг +Нг-
Эритроциты RoHar при использовании обычных серологических методов ти-пируются как D-.
В литературе приведено 2 наблюдения анти-1ШЗ-антител. В одном случае эти антитела присутствовали в сыворотке в комбинации с анти-О-антителами [306], в другом - с антителами анти-D, анти-с, анти-V, анти-К и аутоантите-лами, мимикрирующими под аллоантитела анти-D [Issitt и соавт., Transfusion, 1986, V. 26, R 506]. В обоих случаях анти-РЪЗЗ-антитела удавалось выделить в виде моноспецифической фракции с помощью дифференциальной адсорбции.
По данным Beckers и соавт. [161], гаплотип RoHar, обусловливающий выработку антигена DRoHar, инициирует продукцию частичного D-антигена категории DIV. При гаплотипе DIV(C)- антиген DRoHar также может вырабатываться. Эпитопный состав антигена DRoHar(Rh33) представлен в табл. 4.14 и 4.16 в строке DRoIiar. Известен случай ГБН, вызванный антителами aHTH-Rh33. Лица с фенотипом RoHar легко вырабатывают анти-О-антитела [161].
Исследуя эритроциты DRoIiar с помощью панели моноклональных анти-D-антител, Wallace и соавт. [697] пришли к выводу, что этот антиген кодируется гаплотипом (D)c(e) Rh33 и является парциальным. Авторы нашли, что при указанном гаплотипе не экспрессированы эпитопы epDl-epD4, epD8 и epD9, в то время как способность экспрессировать эпитопы epD5 и epD6/7 сохранена.
Антиген D у лиц DRoHar отличается от других парциальных D-антигенов. В противоположность слабым D-антигенам, которые выявляются неполными IgG-антителами, а с полными IgM-антителами не реагируют, D-антиген на эритроцитах DRoHar хорошо реагирует с полными антителами и не реагирует с большинством реагентов, содержащих неполные антитела. Wallace и соавт. [697] подтвердили эти данные, показав в своих исследованиях, что моноклональные антитела IgM лучше выявляют антиген DRotlar, чем IgG.
Как установлено молекулярно-биологическими исследованиями Beckers и соавт. [160, 161], продукция антигена DRoHar обеспечивается геном RHce, в котором экзон 5 замещен эквивалентным экзоном ДЯО-гена.
Riv(Rh45)
Антиген Riv обнаружен в 1983 г. Delehanty и соавт. [257] у людей с фенотипом DIV(C)-, с другими фенотипами антиген Riv не был найден.
Присутствие антигенов Goa, Evans, Dw, BARC, Tar, Rh32, Rh33, Riv и др. (табл. 4.17) может быть использовано как признак того, что данные эритроциты принадлежат к категории частичного D. Например, умчелове-ка с генотипом CDIve/cde парциальный 01У-антиген выявляют с помощью специфических сывороток aHTH-epD4-epD8. У человека с 1
CDIve/cDe антиген D выражен нормально и маскирует парциальный DIV, который при этом серологически установить не удается. О наличии такого антигена у родителей можно судить по передаче его детям при условии, что они получат генотип CDIve/cde. Однако о присутствии парциального D1V у человека CDlve/cDe можно судить на основании того, что его эритроциты являются Go(a+) и могут нести также другие редкие антигены, связанные с парциальным D этой категории: Riv, FPTT или Evans. В такой же мере маркером эритроцитов (C)D(e), (c)D(e) с ослабленными формами антигенов С, с и е могут служить антигены Rh32, Rh35, Rh48 (JAL), Rh36 (Bea).
Таблица 4.17
Редкие антигены, ассоциированные с гаплотипом CDe
|
Гаплотип |
Ассоциированные антигены |
Выраженность антигенов |
|
DIUCe |
— |
С, D и e норма |
|
DIVaCe |
Goa, Riv |
D| |
|
DmCe |
Evans |
|
|
DVaCe |
Dw |
DJ |
|
DnCe |
BARC |
|
|
DC(Cf(e) |
cw |
D норма, С и е 1 |
|
DCX(C) (e) |
Cx |
D норма, С и е 1 |
|
D(C)(e) |
Rh35, FPTT |
D норма, С и е [ |
|
D(C)(e) JAL |
JAL |
Сие| |
|
D(C)(e) Lisa |
Rh33 |
D норма, С и е [ |
|
D(C)(e) |
Rh32 |
D|, С и е | |
|
Dm(Q- |
Goa, Rh33, Riv, FPTT |
D|, С j, е отсутствует |
|
D(CW)(C)- |
cw |
Df, С J, ,CW|, е отсутствует |
|
*n* |
Evans |
D|f, СсЕе отсутствуют |
|
|
Tar |
Djf, СсЕе отсутствуют |
Примечание. Норма - активность антигена не изменена, I - антиген слабо выражен, | - антиген сильно выражен.
Часто отсутствие одного антигена сопровождается наличием другого. На этом принципе построен поиск новых специфичностей в иммуносерологии. Этот же принцип лежит в основе структуры клеточной мембраны: нет одного субстрата, значит, на его месте должен быть другой. Указанная закономерность не могла не проявиться и в парциальных антигенах D, в которых отсутствуют отдельные эпитопы. В связи с тем, что парциальные D-антигены встречаются редко, то и антигены, «замещающие» их отсутствие, также редки. Приводим их описание.
Goa(JUi30)
В 1964-1967 гг. Alter с соавторами [135,136] описали антитела анти-Ооа, послужившие причиной гемолитической болезни новорожденного у негритянки по фамилии Gonsales из Пуэрто-Рико. В настоящее время известно много случаев выявления анти-Ооа-антител у негров.
По данным Alter и соавт. [135], антиген Goa встречается с частотой 1,86 % среди американских негров, но не был обнаружен при исследовании более чем 3000 англичан и канадцев. Частота Goay негров, по данным Lovett и Crawford [448], составляет 2,8 %.
Lewis и соавт. [436], Lovett и Crawford [448] установили, что Goa является частью системы резус. К такому же заключению пришли Chown и соавт. [223], исследуя 2 большие негритянские семьи. Авторы подтвердили ассоциацию Goa с системой резус и установили, что антиген Goa присутствует на эритроцитах, ко-
торые несут парциальный D-антиген категории D. При отсутствии этого антигена антитела анти-Go3 практически не реагируют с эритроцитами D+.
В настоящее время известно, что антиген Goa находится на эритроцитах категории DIVa и наследуется в виде комплекса DIVaGo(a+), а на эритроцитах категории DIvb он отсутствует. Антиген Goa встречается у людей, имеющих гаплотип Dlvce, DlwCe, DlvcE или D^fC)', и, по-видимому, не встречается при генотипе cde/cde.
Присутствие антигена Goa у лиц с фенотипом cDE сопровождается ослаблением антигена Е, что проявляется в менее выраженной, чем обычно, агглютинации с анти-Е-сыворотками. Как отмечают Delehanty и соавт. [257], гаплотип DIV(C)~ кодирует редко встречающиеся антигены Goa, Rh33, Riv (Rh45) и FPTT (Rh50).
Антиген DCor, обнаруженный Rosenfield, Haber и Gibbel в 1956 г. у негров, и антиген Goa, открытый десятью годами позже, представляют собой один и тот же антиген, однако, несмотря на приоритет в открытии этого антигена Rosenfield и соавт., в литературе укоренилось обозначение Goa.
Evans (Rh37)
Антиген Evans (Rh37) был обнаружен Wiener и соавт. в 1966-1968 гг. у членов одной семьи англичан, фенотип которых напоминал фенотип -D-, но не был ему идентичен. Пробанд, его сестра, отец и дед по отцу имели антиген Evans. Мать пробанда, бабушка по материнской линии и ее сестра этого антигена не имели. AHTH-Evans-антитела не реагировали с эритроцитами гомо- и гетерозигот -D-.
Спустя десятилетие Contreras и соавт. [236] установили, что антиген Evans присутствует на эритроцитах категории DIvbGo(a-) и является маркером антигена D указанной категории. Антиген Evans присутствует также на эритроцитах *D*, хотя в других фенотипах Rh-делеций он отсутствует (см. Фенотипы делеции). AHra-Evans-антитела найдены как сопутствующие в сыворотках, которые содержали анти-Goа-антитела [244]. Моноспецифические антитела анти-Evans, без aHTH-Goa, не обнаружены.
Dw(Rh23)
Антиген Dw (Wiel) выявили Chown и соавт. [227] в 1962-1964 гг. с помощью сыворотки, содержащей комбинированные антитела анти-Dw, анти-С, анти-Сwи другие, которые удалось разделить адсорбцией. Антиген Dw присутствовал у 9 из 235 обследованных негров. У 13 ООО обследованных белых людей этот ан-тиген отсутствовал.
Антиген Dw присутствовал только на эритроцитах с парциальным антигеном категории DVa [227,439]; на эритроцитах с другим фенотипом его нет (см. R1*).
Reid и соавт. [558] нашли 2 сыворотки, которые реагировали с эритроцитами Dw+Rh32- и Dw-Rh32+. Антитела анти-D^ anra-Rh32 (amn-RN) в этих сыворотках не сепарировались и представляли собой комплекс, направленный к общему антигену, сопровождающему как фенотип Dw, так и фенотип Rh32 (RN).
ранее было известно, что некоторые сыворотки анти-Dw содержат несепари-руемый компонент, слабо реагирующий с антигеном RN(Rh32). Сыворотки, полученные Reid и соавт., давали одинаково сильные реакции с эритроцитами Dw+ и эритроцитами RN+ и, по-видимому, выявляли комплексный антиген DW/RN.
Rouillac и соавт. [581, 582], Beckers и соавт. [158, 160], считают, что аминокислотные замены, приводящие к образованию парциальных антигенов DVa, RN, RoHar, DDBT обусловлены сходными конверсиями гена D и СЕ в экзонах 4 и 5. результатом указанных конверсии, очевидно, и является продукция антигенов Dw, RN, а также DW/RN, идентифицируемых с помощью антител affra-Dw/RN.
BARC (Rh52)
Антиген BARC, который обнаружили Green и соавт. [314], выявляют только на эритроцитах лиц, имеющих гаплотип CD71 е. На эритроцитах лиц, имеющих гаплотип CD VIE, антиген BARC отсутствует. Из 78 образцов эритроцитов лиц CDne/cde 76 были BARC+; в группе обследованных людей cDnE/cde (21 человек) все оказались BARC-.
Mouro и соавт. [498] делят антигены категории D^ на 2 генетических типа. Гаплотип cDnE, кодирующий только антиген D^, является типом 1. Гаплотип CDne, который кодирует антигены D^ и BARC, представляет собой тип 2. Не исключено, что образцы эритроцитов лиц CDVIe/cde BARC- и лиц CDne/cde BARC+ представляют собой еще одну разновидность фенотипов в рамках категории D^, помимо 2 указанных выше типов. Образование генов CDne и CDVIE обусловлено конверсией.
Tar (Rh40)
Редко встречающийся антиген Таг обнаружили Lewis и соавт. [437] на некоторых эритроцитах D+ и эритроцитах с частичным D. Категория D-антигенов, реагирующих с сывороткой анти-Tar (Rh40), по предложению Lomas и соавт. [444], обозначена D^1. Антиген D на эритроцитах Таг+ дает более слабую, чем в норме, реакцию с поликлональными сыворотками анти-D. Лица Таг+ вырабатывают анти-О-антитела против недостающих у них D-эпитопов [444].
FPTT (Rh50)
В 1994 г. Lomas и соавт. [445], используя панель моноклональных эпитоп-специфических сывороток анти-D, открыли новый парциальный D-антиген, названный DFR. Этот антиген присутствовал у 17 человек D+, двое из которых имели анти-О-антитела. В результате семейных исследований установлено, что антиген DFR чаще наследуется в комбинации с аллелем Се, чем сЕ. Авторы отметили, что на всех образцах эритроцитов DFR присутствует антиген FPTT (Rh50), не встречающийся на других эритроцитах. Оба антигена (DFR и FPTT) ||§вязаны друг с другом. Определив один антиген на эритроцитах, можно с большой долей вероятности полагать, что исследуемые эритроциты содержат и второй антиген.
Антиген FPTT сопровождает также некоторые фенотипы с подавленной экспрессией антигенов Rh: RoHar(Rh33), DIVa(C)-, D(C)(e) (табл. 4.17>§
Эритроциты DFR (и FPTT) несут половину (15 из 30) эпитопов антигена D.
RN(Rh32)
Редко встречающийся антиген Rh32 считается продуктом гаплотипа RN у негров и гаплотипа (C)D(e) у белых. Оба гаплотипа кодируют ослабленную форму антигена С и е [130, 224]. Установлено, что этот антиген присутствует на эритроцитах, содержащих парциальный D-антиген, известный как DBT.
Антиген Rh32 фенотипически выражен только при отсутствии гена D в обеих позициях, цис и транс. Однако эритроциты Rh32+ вряд ли можно отнести к резус-отрицательным, поскольку они содержат включения антигена D.
Эритроциты RN (Rh32+) характеризуются слабой выраженностью антигенов С и е, а также отсутствием в них антигена с (hrf) и широко распространенного антигена Sec (Rh46).
Молекулярно-генетическое обследование 3 доноров RN(Rh32+), проведенное Rouillac и соавт. [582], показало, что этот антиген является продуктом гибридного гена RHCe-D-Ce, в котором экзон 4 (в одном случае часть экзона 3) гена RHCe заменен эквивалентной частью гена RHD.
Гибридный полипептид, кодируемый геном RN, отличается от протеина, кодируемого нормальным геном RHCe, наличием седьмого или восьмого аминокислотного остатка, специфичного для RHD-протеина.
Как полагает Schenkel-Brunner [597], 3 аминокислоты (Met 169, Met 170 и Не 172), расположенные в 3-й экстрацеллюлярной петле гибридного полипептида, обусловливают присутствие антигена Rh32 и соответственно отсутствие антигена Sec (Rh46).
Ген Dennis
Приводим описание варианта гена RN- гена Dennis. Chown и соавт. [224] наблюдали семью с необычным распределением генов RH. Мать CDe/CDe, отец CDe/cDE имели 7 детей, 4 из которых были CDe/CDe, 2 — CDe/cDE и 1 по имени Dennis, - cDuE/Cueu.
Эритроциты Dennis'a имели нормально реагирующие антигены cDuE, но давали слабую или отрицательную реакцию с сыворотками анти-С и анти-е. Их фенотип мог быть обозначен как cDuE- или c(C)DuE(e). Вместе с тем они реагировали с сывороткой Bill, которая содержала антитела, способные связываться с эритроцитами Du. Эритроциты родителей Dennis'a и его 6 братьев и сестер не реагировали с сывороткой Bill. Обследование 4 сестер матери Dennis'a и 212 лиц, так или иначе связанных родством с наблюдаемой семьей, показало, что все они дают отрицательную реакцию с сывороткой Wiel, т. е. не содержат антигена RN (Rh32).
Оказалось, что Dennis содержит простую дозу антигенов с и Е, а его мать ц 4 братьев и сестер - двойную дозу антигенов С и е. На основании этого авторы предположили, что мать Dennis'а имеет гаплотипы CDue/CDe и не несет антигенов Сии еи, которые, будучи ассоциированными с CDue, реагируют с сыворотками Wiel, Troll и Reynolds. У представителей другой семьи наблюдали эритроциты CDue/Cueu, реагирующие с указанными тремя сыворотками.
Появилось сомнение: не является ли Dennis чужим ребенком. Однако тщательное изучение обстоятельств рождения Dennis'а, исследование документов роддома, где он родился, опрос персонала, серологическое обследование двух детей, родившихся в тот же день, и их родителей, позволило установить, что Dennis является ребенком упомянутой выше супружеской пары. Щ Эритроциты Dennis'a давали слабые или негативные реакции с сыворотками анти-С и анти-е, но в то же время реагировали с сывороткой Wiel, обнаруживающей присутствие антигена, ассоциированного с Du, а также с двумя сыворотками (Troll и Reynolds), которые не реагировали с эритроцитами Du. Следовательно, эритроциты Dennis'a содержали антиген, который не мог являться антигеном Wiel. Из этого также следовало, что фенотип Dennis'a не является продуктом генного комплекса cDuE, а является продуктом другого гена, который авторы назвали геном Dennis.
Указанные 3 сыворотки позволили выделить три группы людей:
- Wiel+Troll (Reynolds)+. Этот фенотип очень редко встречается среди европеоидов и в 1 % у негроидов. Он обнаружен у женщин по имени Charlie By и Co-Gar, а также у мужчины-негра по имени Harper (см. ниже).
- Wiel+Troll (Reynolds)-. Этот фенотип редок у европеоидов. Он встречается у 4 % резус-положительных негроидов.
- Wiel-Troll (Reynolds)-. Частота этого фенотипа более 99 % у европеоидов и 98 % среди негроидов.
С 1951 г. по 1963 г. опубликована серия исследований, показавших, что лица D+, так же как D-, могут вырабатывать анти-О-антитела [216, 386, 446, 614, 645, 658, 671], реагирующие со всеми образцами эритроцитов D+, за исключением собственных. Авторы подчеркивали, что антиген D мозаичен и представлен на эритроцитах многими эпитопами, которые могут выступать в качестве самостоятельных иммуногенов.
Обычно эпитопы присутствуют на эритроцитах людей D+ в полном составе. Люди, имеющие неполный комплект эпитопов, способны вырабатывать антитела к отсутствующим у них компонентам. Фенотип таких людей назван частичным, или парциальным, D.
При адсорбции сывороток анти-D, полученных от людей D-, эритроцитами разных категорий частичного D не удавалось выделить фракции, способные распознавать отдельные эпитопы D-антигена. Элюаты, как правило, содержали антитела, идентичные тем, что находились в сыворотке изначально. Другими словами, антитела анти-D не сепарировались на отдельные эпитопные специфичности и представляли собой единую рецепторную структуру, направленную одновременно против множества D-эпитопов.
Антитела анти-D, присутствующие у лиц с парциальным D, имеют более узкий диапазон реагирования, чем анти-О-антитела лиц D-, поскольку в них отсутствуют рецепторы к отдельным эпитопам D. Иными словами, антитела, продуцируемые людьми с парциальным D, также являются парциальными.
По характеру перекрестного реагирования парциальные антитела разделили на группы.
Wiener, Unger и другие исследователи [216, 614, 645, 671, 716 ], установившие, что Rho-aHTHreH состоит из 4 компонентов (RhA, RhB, Rhc и RhD), предложили классификацию RhQalPhabet. Если один из компонентов в фенотипе присутствовал, его обозначали индексом с заглавной буквой, если отсутствовал -строчной буквой. Таким образом, эритроциты фенотипа Rh^^ содержали компоненты RhA и RhB, а компоненты Rhc и RhD в них отсутствовали. Как обнаружили исследователи, антитела, полученные от человека с эритроцитами RhA, реагировали с нормальными эритроцитами Rho и эритроцитами Rha, но не реагировали с эритроцитами RhA. Антитела, продуцируемые человеком, имевшим эритроциты RhB, реагировали с эритроцитами Rho и эритроцитами Rhb, но не реагировали с эритроцитами RhB и т. д.
В настоящее время алфавитную классификацию Rhoalphabet не используют и она упоминается лишь как имеющая научно-познавательное значение.
Классификация по категориям, существенно расширенная в настоящее время, предложена Tippett и Sanger [657, 661].
Первая ее версия опубликована в 1962 и 1963 гг. Суммируя результаты исследования сначала 18, а затем 29 сывороток анти-D, полученных от лиц с парциальными D-антигенами, авторы выделили 6 категорий антигенов, отличающихся неодинаковым перекрестным реагированием (табл. 4.12).
КI категории D-антигенов был отнесен обычный D-антиген. Люди с антигеном категории DI анти-О-антител не вырабатывают.
Ко II категории отнесен антиген D, содержащийся у людей, которые продуцируют антитела против D-антигенов I, III, IV и V категории. К D-антигенам II и VI категории такие люди антител не вырабатывают.
К III категории отнесен антиген D, встречающийся у лиц, продуцирующих антитела против D-антигенов I, II и IV категории.
Антиген D IV категории отличается от антигена D лиц первых трех категорий. Люди, имеющие этот антиген, способны вырабатывать антитела к D-антигенам всех категорий, за исключением IV.
Отличительные признаки D-антигенов V и VI категории сводятся к тому, что люди, имеющие эти антигены, способны продуцировать антитела к антигенам D других категорий, но лишены этой способности в отношении собственного D-антигена.
Эритроциты, содержащие антигены D разных категорий, различаются по частоте реагирования со стандартными сыворотками анти-D, полученными от людей D-. Образцы эритроцитов, отнесенные к категории IV, агглютинировались 96 % сывороток анти-D, категории V - 74 %. Эритроциты категории VI реагировали только с 35 % сывороток анти-D.
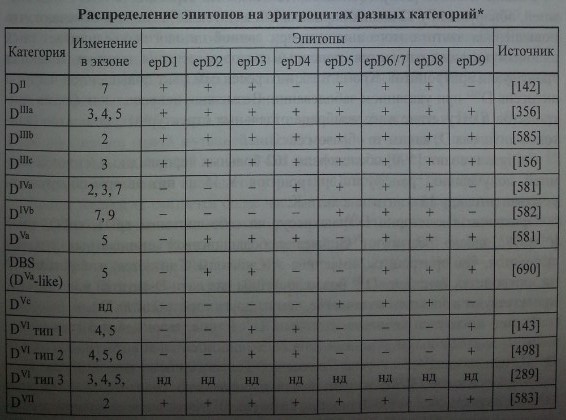
Из данных, представленных в табл. 4.12, можно заключить, что не все эпитопы D одинаково иммуногенны. По-видимому, эпитопы, отсутствующие на эритроцитах DVI, как раз и являются более иммуногенными, поскольку их отсутствие обусловливает низкий процент реагирующих с этими эритроцитами сывороток. Напротив, высокая частота реагирования Dn, DIH, DIVсвидетельствует о том, что они лишены менее иммуногенных эпитопов. Если судить по данным табл. 4.14, к более иммуногенным следует отнести все эпитопы от epDl до epD9, а к менее иммуногенным - те, которые «прячутся» за знаком минус (отсутствие сильного эпитопа).
Вторую, обновленную версию своей классификации Tippett и Sanger опубликовали в 1977 г. [660]. Она включала 5 категорий парциальных D-антигенов (табл. 4.13). Категория I была исключена, так как выяснилось, что некоторые образцы крови, отнесенные к этой категории в первоначальной версии, содержали транзиторные анти-О-антитела. Категории III, IV и V подразделены на субкатегории: Ша, Illb, Шс; IVa, IVb и т. д. Новая версия не внесла принципиальных изменений в первоначальную, но, как комментировали Issitt и Anstee [374]: «дала элегантный серологический прогноз тех особенностей, которые позднее были обнаружены с помощью моноклональных эпитопспецифических aHTH-D-антител, а также в результате исследования генов, кодирующих частичные D-антигены». Позднее субкатегория Vc была упразднена, так как с помощью моноклональных aHTH-D-антител было показано, что антигены DVc и Divb представляют одну группу. Кроме того, были детализированы другие позиции (см. табл. 4.13).
Таблица 4.13
Взаимодействие эритроцитов и сывороток людей, содержащих парциальные D-антигены и парциальные анти-О-антитела*
|
Категория эритроцитов |
Реакция анти-В-антител, полученных от лиц, имеющих эритроциты категории |
|||||||||||
|
II |
Ша |
ШЬ |
Шс |
IVal |
IVa2 |
IVb |
Va |
Vb |
Vc |
Vli |
Vlii |
|
|
II |
— |
+ |
+ |
+ |
+ |
+ |
± |
+ |
+ |
I |
+ |
+ |
|
Ша |
|
— |
+ |
— |
|
+ |
+ |
|
+ |
+ |
|
+ |
|
ШЬ |
+ |
— |
— |
— |
+ |
+ |
+ |
± |
|
+ |
+ |
+ |
|
Шс |
|
— |
4- |
— |
+ |
+ |
+ |
+ |
+ |
+ |
|
+ |
|
IVa |
— |
1 |
|
— |
— |
— |
— |
+ |
+ |
— |
+ |
+ |
|
IVb |
— |
1 |
|
|
— |
— |
— |
— |
— |
1 |
+ |
— |
|
Va |
+ |
— |
|
— |
+ |
|
+ |
— |
± |
— |
+ |
— |
|
Vb |
+ |
— |
|
— |
+ |
— |
— |
— |
— |
— |
— |
—■ |
|
Vc |
+ |
— |
+ |
— |
| |
— |
|
— |
— |
— |
|
— |
|
VI |
— |
— |
+ |
— |
+ |
— |
+ |
— |
— |
— |
— |
— |
* По Tippett, Sanger [660] и другим источникам.
Лица, имеющие эритроциты категории DHI (a, b и с), содержат 2 разных анти-О-антитела. Об этом свидетельствует тот факт, что эритроциты D11, D111 и других категорий реагируют с этими сыворотками неодинаково. В частности, анти-О-антитела людей DIIIb агглютинируют эритроциты D11, D1113"^. В то же время эритроциты DIIIa и Dlllc сыворотками лиц DIIIb практически не агглютинируются. Такая же двойная специфичность характерна для антител, продуцируемых лицами DVI. Так, лица и D™' продуцируют 2 типа антител, один из которых реагирует с эритроцитами DIVb, DVa и DVc, а другой с этими эритроцитами не реагирует. Анти-О-антитела, вырабатываемые лицами DIVa и DIvb практически однотипны, так же как и антитела, вырабатываемые лицами DVa, Dvb и DVc.
Эритроциты DIIIb представлены двумя группами. К одной группе относят эритроциты, содержащие антиген G (G+), к другой Ё не содержащие этого антигена (G-). Некоторые образцы эритроцитов категории DIVa не содержат антигена Goa (Go8-), другие содержат (Goa+). Щ'
Моноклональные антитела анти-D, будучи узконаправленными, более контро-астно дифференцируют отдельные эпитопы D-антигена в отличие от поликло-нальных парциальных антител, часто комбинированных с другими антителами.
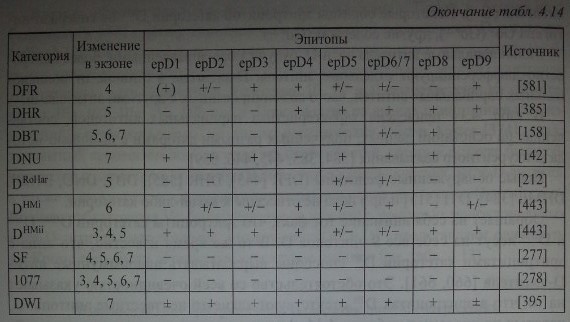
В табл. 4.14 приведена характеристика парциальных антигенов, составленная на основании данных, полученных разными авторами с помощью метода конкурентного связывания [384,385,445,446,659].
Новые обнаруженные фенотипы (DFR [445], DHR [385], DBT, DNU, DHMi, DHMii [384], DTI [513] и др.) пока не отнесены к какой-либо категории.
Обращает на себя внимание тот факт, что эритроциты категории DIIIa, DIIIbи DIIIC несут на себе все 9 эпитопов D. В то же время известно, что лица с эритроцитами категории D111 способны вырабатывать аллоиммунные анти-О-антитела [660, 661]. Это обстоятельство со всей очевидностью указывает на то, что в эритроцитах D111 отсутствуют какие-то неизвестные эпитопы D, которые не внесены в таблицу 4.14. Антитела к этим эпитопам пока не найдены. Аналогично ведут себя эритроциты категории Dn,DIV, DvhDVI1, которые в одних случаях реагируют с сыворотками анти-D, а в других не реагируют в зависимости от совпадения специфичности парциальных антигенов и парциальных антител.
Castilho и соавт. [198], обследовав 130 больных серповидно-клеточной анемией, обнаружили у 12 из них парциальный антиген DIIIa. Авторы отмечают, что повышенная частота этого антигена при данной патологии увеличивает риск аллоиммунизации пациентов, основным методом лечения которых являются трансфузии эритроцитов. Кроме того, интересен сам факт повышенной частоты антигена DIIIa при указанном заболевании. Возможно, неправильная форма эритроцитов и отсутствие в их мембране отдельных структурных элементов (эпитопов антигена D) каким-то образом связаны.
Calligas и соавт. [190] обследовали 162 больных серповидно-клеточной анемией, получавших трансфузии эритроцитов. У 15 из них авторы обнаружили резус-антитела, у 13 - антитела анти-К.
Эритроциты категории DIVa не несут на себе эпитопов epDl, epD2, epD3 и epD9, однако реагируют сильнее с большинством стандартных анти-D-сывороток, чем эритроциты, имеющие эти эпитопы. Считается, что эпитопы D на эритроцитах категории DIVa более доступны для анти-Б-антител и, возможно, присутствуют в большем количестве, чем на других эритроцитах D+.
У лиц, носителей антигена категории DVI I типа, экзоны 4 и 5 гена сЕ замещены аналогичными экзонами гена D. У лиц, носителей антигена категории DVIII типа, экзоны 4, 5 и 6 гена Се замещены аналогичными экзонами гена D.
Wagner и соавт. [690] нашли новый парциальный D-антиген - DBS, или Dv-like, являющийся разновидностью антигена DVa. Этот антиген |содируется ги-^щ^фт геном RHD-R^^(5)-RHD с делецией интрона 4 и частщэкзона 5. На эритроцитах Dv-like отсутствуют эпитопы epD4, ерШ2, epD17, epD18 и epD22, которые обычно присутствуют на эритроцитах DVa. Указанное отличие антигена Dv-like от антигена DVa было ассоциировано только с одной нуклеотидной заменой А 226 Р, которая, видимо, и привела к выпадению некоторых эпитопов. Ранее Wagner и соавт. [691] описали разновидности парциальных антигенов Divb-like, DNU-like и DFR-like, различающиеся точками мутаций в RHD-тене и отсутствием некоторых эпитопов (табл. 4.15). По данным Zhou и соавт. [729], полиморфизм антигена DVa обусловлен гибридным геном RHD/CE, в котором экзон 5 и интрон 5 гена D замещен гомологичными последовательностями гена СЕ.
Таблица 4.15
Разновидности парциальных антигенов DIV, DNB, DFR
|
Фенотип (категория парциального D-антигена) |
Количеств о случаев |
Нуклеотидная замена в гене RHD |
Недостающие эпитопы D на эритроцитах |
|
D^-like (D™ IV типа) |
3 |
D350 m Н, G353 ^W,A354-+N |
1-6,23,31 34-36 |
|
DNU-like (DNB) |
2 |
G355 Ш S |
6,31 |
|
DFR-like (DFR) |
1 |
Н166 Р |
10,11,22,31,32 |
Flegel и соавт. [288,289] обнаружили III тип парциального антигена D^. В категории III типа экзоны 3, 4, 5 и 6 гена D замещены эквивалентными частями гена Се. Авторы нашли, что число антигенных участков на 1 клетку для разных типов антигена составляет: для I типа - 500, для II типа - 2400 и для
Ш типа - 12 000. Таким образом, эритроциты, несущие антиген III типа, содержат нормальное для эритроцитов D+ количество антигенных участков.
Два типа эритроцитов (I и III) содержат антиген BARC (Rh52), эритроциты II типа не содержат этого антигена.
Jones и соавт. [385] описали новый парциальный антиген - DHR. Фенотип DHR обусловлен одной мутацией - G 686 —► А - в экзоне 5 гена Д которая приводит к замене Arg 229 —► Lis в 4-й экзофациальной петле полипептида D. Аминокислотная замена приводит к утрате epD 1, epD2, epD 12 и epD20.
Генная конверсия считается более частым механизмом появления парциального D-фенотипа. Однако есть несколько примеров простых замен, обусловливающих парциальные антигены D различных категорий: Dm - Leu ПО —► Pro [589, 694], D"-Ala 354 У Asp [144], DNU - Gly 353 Л Arg [144], DHMi - Thr 285 -* He [384].
В 2004 г. Kormoczi и соавт. [395] описали парциальный D-антиген, названный ими DWI. Он был обнаружен у 74-летней жительницы Восточной Австрии, имевшей группу крови 0(1) Rh+. Сыворотка женщины содержала анти-О-антитела, что послужило основанием заподозрить у нее парциальный вариант D. В анамнезе имелись 2 беременности от мужа D+ и несколько ге-мотрансфузий в связи с гинекологической операцией. Женщина и 2 ее родственницы (сестра и племянница) имели генотип DWICe/cde. На эритроцитах
DWI+ отсутствовали редкие антигены ЦЦ V9 VS, Dw, Goa, Evans, Tar, Riv, FPTT, BARC, JAL, которые ассоциированы с парциальными антигенами D, Сс или Ее. Антигенная емкость эритроцитов DWI+ составила 8000-8600 антигенных участков на 1 эритроцит. При семейном исследовании установлено, что антиген DWI передается с гаплотипом DWICe, но не с DWIce. При эпитоп-ном картировании зафиксирована незначительная модификация антигена D, проявляющаяся в виде ослабленной экспрессии эпитопов Dl.l, D9.1 и D16.1. При ДНК-типировании авторы нашли в экзоне 7 гена RHD простую нуклео-тидную замену Т 1073 —> С, приводившую к замещению Met 358 —> Thr в 6-й экстрацеллюлярной петле D-полипептида.
Эритроциты DWI+ не агглютинировались одной из 79 моноклональных анти-D-cbmopoTOK, хорошо реагировавших с другими фенотипами D+. Авторы применили эту сыворотку для отсева лиц D+, с тем чтобы среди оставшихся нереагирующих или слабореагирующих образцов найти DWI+. Однако среди 2288 резус-положительных австрийцев антиген DWI выявлен не был, за исключением трех упомянутых выше женщин.
Вначале была предложена 9-эпитопная модель парциальных D-антигенов. Специально отобранные моноклональные антитела дифференцировали 8 эпитопов антигена D (epDl-epD9). Эпитопы D6 и D7 были объединены в epD6/7, так как серологические реакции эритроцитов, несущих эти эпитопы, оказались практически одинаковыми.
Faas и соавт. [276] предложили 15-эпитопную модель, в которой эпитопы epDl, epD2, epD5, epD6/7 и epD9 подразделяют на субэпитопы (Dl.l, D1.2; D5.1, D5.2; D9.1, D9.2 и т. д.) - от 2 до 10 субэпитопов в каждом эпитопе. Кроме того, авторами установлено 6 новых эпитопов, получивших номера с 10 по 15.
Jones и соавт. [386] разработали модель, включающую 30 серологически различимых эпитопов D (табл. 4.16). Как видим, эпитопная конструкция антигена D, сложившаяся к настоящему времени, еще далека от своего завершения.