Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система Diego
Протеин полосы 3 тесно связан в мембране эритроцитов с гликофорином А. Антитела к протеину полосы 3 преципитировали как этот белок, так и гликофорин A (Wainwright и соавт. [169], Tanner [160]). Антитела против гликофорина А существенно снижали подвижность протеина полосы 3 (Nigg и соавт. [125], Che, Sherry [26], Paulitschke и соавт. [130]).
По мнению Groves, Tanner [53] гликофорин А способствует переносу вновь образовавшихся молекул белка полосы 3 в мембрану эритроцитов. Однако гликофорин А не является строго обязательной структурой, необходимой для экспрессии белка полосы 3, хотя при его дефиците протеин полосы 3 медленнее движется к мембране и его прикрепление к ней остается незавершенным. В эритроцитах, дефицитных по гликофорину А, протеин полосы 3 имеет более высокую мол. массу и, несмотря на его нормальное количественное содержание, транспорт анионов через мембрану таких эритроцитов затруднен. Эритроциты мышей, у которых направленно был инактивирован ген белка полосы 3 (нокаутные мыши), имели низкое содержание как протеина полосы 3, так и гликофорина А, что дало основание полагать, что белок полосы 3 важен для формирования гликофорина А на мем-бране эритроцитов (Hassoun и соавт. [57]). Однако эти экспериментальные данные вряд ли можно экстраполировать на человека, поскольку у человека в процессе гемопоэза йшкофорин появляется на мембране эритроцитов раньше белка полосы 3 (Southscott и соавт. [156], Daniels, Green [38]). В то же время эритролей-кемическая линия клеток человека К562 экспрессирует гликофорин А, а протеин полосы 3 не экспрессирует (Gahmberg, Andersson [48], Beckman и соавт. [11]).
Ribeiro и соавт. [142] описали ребенка с полным отсутствием бежа полосы 3, однако его эритроциты при этом содержали, хотя и в небольшом количестве, гликофорин А.
Эритроциты трансгенных мышей экспрессировали гликофорин А человека, но в то же время содержание в них мышиного гликофорина А было снижено. Это указывает на возможную конкуренцию двух разных в видовом отношении гликофоринов, участвующих в формировании белка полосы 3 (Auflfray и соавт. [10]).
Антиген Wrb не экспрессируется в отсутствие гликофорина А. Эритроциты с дефицитом гликофорина А имеют фенотип Еп(а-) по системе MN и Wr(a-b-) по системе Diego (Issitt и соавт. [68, 69]). Образцы эритроцитов Wr(a-b-), которые содержали некоторое количество гибридных гликофоринов, реагировали с антителами анти-Епа. Эритроциты индивидов Wr(a+b-) имели нормальную экспрессию антигенов М, N, S, s и Ena(Dahr и соавт. [35]). Секвенирование гена GYPA у лиц Wr(a+b-) не выявило каких-либо особенностей (Bruce и соавт. [17]).
Большинство моноклональных антител к гликофорину А преципитировало указанный гликофорин, но не преципитировало белк полосы 3. Преципитация гликофорина А происходила с анти-АУгь-антителами (Ridgwell и соавт. [144, 145]), которые одновременно преципитировали и протеин полосы 3 (Telen, Ghasis [163], Ring и соавт. [147]), обнаруживая тем самым структурное сходство обоих антигенных субстратов. Шесть образцов сывороток с аутоантитела-ми также вызывали преципитацию протеина полосы 3 и гликофорина A (Leddy и соавт. [97]). Антитела анти-\Угь содержались лишь в 3 из 6 упомянутых сывороток с аутоантителами, и это свидетельствует о том, что могут существовать другие антигенные эпитопы, общие для протеина полосы 3 и гликофорина А.
Гемагтлютинирующую активность аллоиммунных антител airra-Wrb оказалось возможным ингибировать очищенными фрагментами гликофорина А, но ингибиру-ющая активность была низкой и ее можно было выявить лишь в присутствии липи-дов (Dahr и соавт. [35]). Активность одного образца моноклональных антител анти-Wrb угнеталась синтетическим пептидом, имеющим аминокислотную последовательность, свойственную гликофорину А в положениях 56-70. Этот синтетический пептид не снижал активность аллоиммунных, аутоиммунных, а также двух образцов моноклональных антител анти-\¥гь (Rearden [139]). Моноклональные антитела не связывались с клеточными линиями человека, не экспрессирующими гликофорин А и белок полосы 3 (Telen, Chasis [163]). Клеточная линия К562 экспрессирует гликофорин А без протеина полосы 3 и антигена Wrb, однако трансфекция клеток кДНК бежа полосы 3 индуцировала экспрессию антигена Wrb (Beckman и соавт. [11]). В экспериментах с искусственным эритропоэзом in vitro белок полосы 3 и антиген Wrb появлялись на клетках в одно время, после гликофорина A (Daniels, Green [38]). Связывание антител с экстрацеллюлярным доменом гликофорина А вызывало одновременно иммобилизацию протеина 3, этот эффект был заметно снижен при использовании эритроцитов Wr(a+b-) (Paulitschke и соавт. [130]).
Вшсе и соавт. [17], Huang и соавт. [61], Poole [132] сравнили аминокислотную последовательность гликофорина А, гибридного гликофорина GP(B-A)Sch., ассоциированного с антигеном Wrb, а также гибридов GP(A-B)Hil и GP(B-A)Dantu, ассоциированных с фенотипом Wr(a-b-). Результаты позволили заключить, что аминокислоты в позициях 55-68 а-спирального региона, близкого к месту встраивания гликофорина А в мембрану эритроцитов, могут играть важную роль в экспрессии антигена Wrb. Аминокислотные замены Gin 63 Lys и Ala 65 Pro ассоциированы с необычно высокой экспрессией антигена Wrb. На эритроцитах с гибридными гли-кофоринами, экспрессирующими антиген SAT, фактор Wrb отсутствовал, несмотря на наличие аминокислот, происходящих из участков 1-70 или 1-71 гликофорина А. Вероятно, что взаимодействие протеина полосы 3 и гликофорина А происходит через трансмембранный домен гликофорина А и восьмой трансмембранный домен белка полосы 3, а также через экстрацеллюлярные участки, находящиеся рядом с этими трансмембранными доменами.
Таким образом, связь гликофорина А и протеина полосы 3 очевидна. Эритроциты En(a-) MkMk не содержат гликофорина А и являются Wr(a-b~). Антиген Wrb отсутствует на эритроцитах, несущих гибридные гликофорины GRHil, GP.TSEN, GP.SAT, GP.TK или GP.Dantu. Во всех случаях в позиции 658 протеина полосы 3 присутствует глютаминовая кислота, однако для экспрессии антигена Wrb еще необходимы соответствующие аминокислоты в составе указанных гликофоринов. Экспрессия Wrb ослаблена на эритроцитах с гибридными гли-кофоринами GP.HAG и GP.MARS, которые несут фрагменты гликофорина А с заменами аминокислот Gin 63 Lys и Ala 65 Pro соответственно (см. Система MVS).
Остается невыясненным, требуется ли присутствие самого гликофорина А для экспрессии антигена Wr\ Попытки исследовать компоненты эритроцитар-ной мембраны иммунопреципитацией моноклональными антителами анти-Wr3 успеха не принесли (Ring и соавт. [147]).
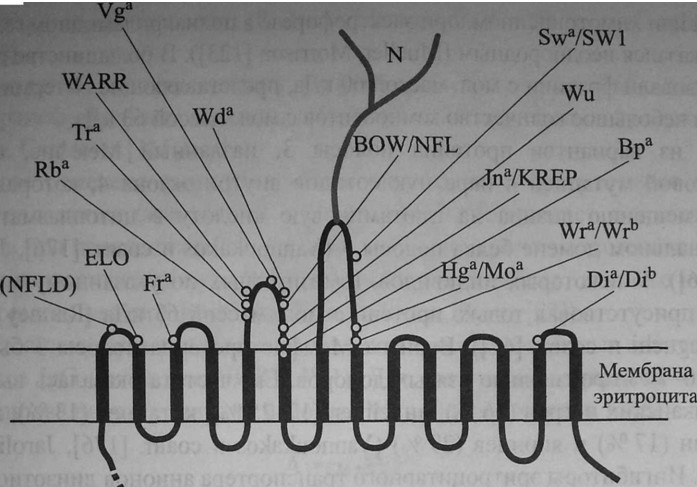
Белок полосы 3, отвечающий за транспорт анионов (АЕ1, или CD233), входит в структуру гликопротеинов эритроцитарной мембраны. Каждый эритроцит содержит примерно 1,2 млн молекул этого белка, который легко выявляют электрофорезом в полиакриламидном геле после обработки субстрата до-децилсульфатом натрия (SDS-PAGE). Он мигрирует в область структур, имеющих мол. массу 100 кДа (Bruce, Tanner [18], Tanner [158,159]).
Ген SLC4A1, контролирующий синтез белка полосы 3, имеет величину 18 кб и включает 20 экзонов (Schofield и соавт. [151]). Клонирование и секвенирование геномной ДНК белка полосы 3 подтвердило, что эта структура состоит из 3 доменов. Цитоплазматический N-терминальный домен состоит из 403 аминокислот, гидрофобный трансмембранный домен представлен 479 аминокислотами, С-терминальный - 29 (см. рис. 12.2, 12.3) (Tanner и соавт. [160], Lux и соавт. [112]). Терминальный N-домен взаимодействует с
анкирином цитоскелетона. Трансмембранная часть белка полосы 3 в эритроците включает 14 доменов, экстрацеллюлярная часть представлена 7 петлями (см. рис. 12.2). Участок, связанный с олигосахаридами в области Asn 642 на четвертой экстрацеллюлярной петле, обладает серологической активностью в отношении антител анти-Н, анти-А, анти-В, анти-I и анти-i. Количественные вариации протеина полосы 3 подсчитаны по числу повторяющихся N-ацетил-лактозаминовых группировок. Белок полосы 3 в мембране эритроцитов представлен олигомерами (ди-, три-, тетра- и т. д.) (Popov и соавт. [136], Fujinaga и соавт. [46]). Тетрамеры преимущественно связаны с анкирином (Van Dort и
[167], Zafar, Reid [180]).
Аминокислотная последовательность протеина полосы 3 эритроцитов человека.
Посемейными исследованиями установлено, что ген Dia передается по наследству как доминантный признак (Сапп и соавт. [23], Graninger [51], Lewis и соавт. [104], Race, Sanger [137], Levine, Robinson [98], Layrisse и соавт. [96]).
Протеин полосы 3, полученный из эритроцитов, подвергнутых обработке проназой или химотрипсином, при электрофорезе в полиакриламидном геле (SDS-PAGE) оказался неоднородным (Mueller, Morrison [123]). В большинстве образцов присутствовали фракции с мол. массой 60 кДа, представляющие N-терминальный регион, и небольшое количество компонентов с мол. массой 63 кДа.
Один из вариантов протеина полосы 3, названный Мемфис, обусловлен точковой мутацией в паре нуклеотидов внутри экзона 4, которая приводит к замещению лизина на глютаминовую кислоту в цитоплазматическом N-терминальном домене белка полосы 3 (Yannoukakos и соавт. [176], Jarolim и соавт. [76]). У некоторых индивидов, гомозиготных по указанному мутантно-му гену, присутствовал только протеин с мол. массой 63 кДа (Ranney и соавт. [138], Ideguchi и соавт. [62]). Вариант Мемфис протеина полосы 3 был обнаружен у 6-7 % произвольно взятых доноров. Его частота оказалась выше среди американских негров (16 %), индейцев (17-25 %), китайцев (13 %), жителей Филиппин (17 %) и японцев (29 %) (Yannoukakos и соавт. [176], Jarolim и соавт. [76]). Ингибиторы эритроцитарного транспортера анионов диизотиоцианат-стилбен (DIDS) и его дигидрат (H160mIDS) ковалентно связывались с лизином в позиции 539 белка полосы 3 (Tanner и соавт. [160]). У некоторых индивидов с Мемфис-вариантом белка полосы 3 отмечено повышенное связывание H160mIDS (Hsu, Morrison [60]). Такой тип белка полосы 3 был обозначен как Мемфис-вариант II для дифференцировки с Мемфис-вариантом I, которому свойствен нормальный уровень связывания Н IDS.
Spring et al [157] указали на ассоциацию между фенотипами системы Diego и вариантами протеина полосы 3 при исследовании в SDS-PAGE. Они установили, что наличие Мемфис-варианта II всегда было ассоциировано с наличием на эритроцитах антигена Dia. Белок полосы 3 таких эритроцитов связывал в 3 раза больше H160mIDS с радиоактивной меткой, а клетки Di(a-) проявляли нормальный уровень связывания H160mIDS. Таким образом, эпитопы Dia ассоциированы с протеином полосы 3 Мемфис-варианта II, а другие варианты этого белка (Мемфис-вариант I и обычный) - с антигенными эпитопами Dib.
Bruce и соавт. [16], проведя амплификацию кодирующего региона бежа полосы 3 для выделения кДНК, сумели доказать, что экспрессия антигена Dia и Мемфис-варианта II ассоциированы с заменой С 2561 Т в экзоне 19: ген Dia кодирует лейцин в позиции 854, а в присутствии Dib это положение занимает пролин. Кроме того, внутри гена Dia отсутствуют сайты рестрикции Mspl и Nael. В соответствии с моделью, в которой трансмембранная часть протеина полосы 3 представлена 14 доменами, аминокислотные замены имеются в 7 экстрацеллюлярных петлях белка (рис. 12.2). Повышенное связывание H160mIDS происходит в связи с локальными пространственными изменениями, влияющими на перекрестные связи между лизином в положении 851 на седьмой петле и той же аминокислотой в положении 539 в трансмембранном домене (Salhany и соавт. [150]).
При исследовании генотипа с помощью ПЦР у 72 бразильских индейцев племени Паракана из Амазонии выявлено 26 индивидов Dia/Dia, 26 - Dia/Dib
Локализация антигенных эпитопов Diego на эритроците и топология протеина полосы 3
и 19 - Dib/Dib. Таким образом, в этой этнической группе гены Dia и Dib имели частоту 0,56 и 0,44 соответственно (Castilho и соавт. [24]). Анализ вариантов Мемфис белка полосы 3 с рестрикцией Msp\ подтвердил корреляцию аллелей Dia и Dib с кодонами Glu 56 и Lys 56 соответственно. Исключение составили индивиды Dia/Dia, гетерозиготные по Glu 56 и Lys 56 кодонам.
Jarolim и соавт. [74] описали 2 европеоидов Di(a+b-), гетерозиготность которых (Dia/Dib) подтверждалась молекулярно-генетическими тестами. У одного из них выявлена мутация, изменявшая рамку считывания, у другого - нонсенс-кодон внутри Dib.
Антигены Dia и Dib устойчивы к действию папаина, трипсина, а-химотрипсина, проназы, сиалидазы и сульфгидрильным редуцентам (Daniels [36]).
Иногда антиген Dib может быть слабо выражен. Описана мексиканская женщина, фенотип которой при первичном исследовании был определен как Di(a-b-). Однако последующие исследования выявили у нее слабый антиген Dib (Biro и соавт. [14]). Низкий уровень экспрессии антигена Dib у нескольких мексиканцев с фенотипом Di(a+) описали Edwards-Moulds, Alperin [42]). При обследовании 784 жителей Америки испанского происхождения Issitt и соавт. [70] установили, что все они имеют антиген Dib, в 11 случаях последний был слабо выражен. Исследование этих образцов с сыворотками анти-Di3 лишь в одном случае выявило этот антиген. Таким образом, феномен слабой экспрессии антигена Dib не был связан с эффектом дозы. Сниженная экспрессия антигена Dib имелась у лиц с овалоцитозом, встречающимся в Юго-Восточной Азии (Kusnierz-Alejska, Bochenek [89]).
Антитела airra-Wrb были впервые найдены у лиц Wr(a-b-) (Adams и соавт. [4], Dahr и соавт. [34]). Информации о клиническом значении этих антител мало. Больной En(a-)Wr(b-) с наличием антител анти-Епа и анти-\¥гь перенес гемолитическую посттрансфузионную реакцию замедленного типа после переливания ему 6 доз донорской крови En(a+) (Furuhjelm и соавт. [47]). Эритроциты новорожденного Wr(b+), родившегося от матери, имевшей анти-\¥гь-антитела, давали положительную прямую антиглобулиновую пробу, однако обменного переливания крови для лечения ребенка не потребовалось (Langley и соавт. [91]). Результаты хемилюминесцентных тестов дали основание полагать, что антитела amn-Wrbспособны ускорять разрушение эритроцитов Wr(b+) in vivo (Poole и соавт. [133]).
Антитела анти-\¥гь нередко имеют аутоиммунную природу. Golgfinger и соавт. [50], Issitt и соавт. [67], изучая элюаты с эритроцитов больных аутоиммунной гемолитической анемией с положительным прямым антиглобулиновым тестом, у 110 пациентов выявили антитела, не относящиеся к системе Rh; у 46 - идентифицированы аутоантитела aHra-Wrb, при этом у 4 они были моноспецифическими. У 2 больных указанные аутоантитела явились причиной внутрисосудистого гемолиза со смертельным исходом (Dankbar и соавт. [40], Ainsworth и соавт. [5]).
Получен ряд серий мышиных моноклональных анти^гь-антител (Ridgwell и соавт. [145], Anstee, Edwards [8], Rouger и соавт. [148], Gardner и соавт. [49]), одна гибридома, продуцирующая анти^гь-антитела, получена из мононуклеа-ров обезьян Macacus rhesus (Reid и соавт. [140]).
Антитела анти-Wr3 встречаются часто. В различных сообщениях их частота среди здоровых лиц варьирует от 1: 13 (McGuire, Funkhouser [113]) до 1 : 56-1 : 100 (Wallis и соавт. [171], Greendyke, Banzhaf [52], Lubenko, Contreras [111], Hardman, Beck [55]). Частота указанных антител существенно выше среди больных, родильниц и сенсибилизированных лиц, имеющих аллоантитела другой специфичности (Wallis и соавт. [171]).
Greendyke, Banzhaf [52] обнаружили анти^га-антитела у каждого 3-го больного аутоиммунной гемолитической анемией.
С.А. Фатьянов и соавт. [2, 3] исследовали 1823 сыворотки крови здоровых лиц (доноров крови), беременных, сенсибилизированных к антигенам системы Rh, а также пациентов с сосудистой патологией (атеросклероз сосудов нижних конечностей, варикозное расширение вен, тромбофлебит) и заболеваниями соединительной ткани (ревматоидный артрит, системная красная волчанка) на наличие антител к антигену Wra. Антитела выявляли непрямым ан-тиглобулиновым и ферментным методами с эритроцитами редких фенотипов: OCCDeeWr(a+), OccDEeWr(a+) и OccddeeWr(a+) - предоставленными доктором Marcela Contreras и доктором Jeoff Poole из Национальной службы крови Великобритании (Лондон, Бристоль). Антитела анти-Wr3 выявили у 1,2 % доноров, у 10,51 % беременных, у 11,42% больных системными заболеваниями соединительной ткани, у 17,83 % больных сосудистой патологией. Среди Rh-отрицательных лиц, аллоиммунизированных антигеном D, частота этих антител составила 18,52 %.
По мнению некоторых авторов, образование антител aHTH-Wra в организме Wra-OTpn4a^bHbix лиц в отсутствие специфической стимуляции может указывать на существование особого иммунного механизма элиминации эритроцитов in vivo, в основе которого лежит модификация протеина полосы 3 в мембране эритроцитов с возникновением de novo Wra-noflo6Hbix антигенных детерминант. В частности, присутствие анти^га-антител коррелировало с интенсивностью гемолиза эритроцитов in vivo (Issitt, Anstee [65]).
Первые 2 найденных образца антител aHra-Wra явились причиной тяжелой ГБН. Позднее появились другие аналогичные сообщения (Holman [59], Arriaga и соавт. [9], Wiener, Brancato [173], Daw [41], Jorgensen, Jakobsen [77]). Антитела анти-Wr3 описаны также в качестве причины гемолитически ансфузионных реакций (Metaxas, Metaxas-Buhler [117], van Loghem и соавт. [168]).
Несмотря на высокую частоту антител aHTH-Wra, случаи ГБН, так же как и посттрансфузионные реакции, обусловленные ими, регистрируют редко (Lubenko, Contreras [111]).
Как уже отмечено выше, анти-\Уга-антитела часто присутствуют одновременно с аллоантителами другой специфичности. Это создает дополнительные трудности при производстве серологических стандартов из аллогенных сывороток, поскольку антитела aHTH-Wra требуется адсорбировать, для чего необходимы эритроциты редкого фенотипа Wr(a+) (Byrne, Byrne [22]).
К настоящему времени получены мышиные моноклональные антитела анти-Wra класса IgG (гибридома BGU1-WR). Для получения гибридомы животных иммунизировали эритроцитами человека Wr(a+) (Ring и соавт. [146]).
Новости медицины
Много миллионов человек в мире принимают статины, но исследования показывают, что только 55% из тех, кому рекомендуется принимать статины, принимают их. Это большая проблема, потому что исследования также показывают, что те из группы...
Связанное с беременностью высокое кровяное давление может привести к долгосрочным сердечным рискам, показывают новые исследования.
Кэролин Консия, столкнулась с более серьезными последствиями репрессий против назначения опиоидов, когда узнала, почему сын ее подруги покончил с собой в 2017 году.
Новое исследование показывает, что психические заболевания не являются фактором большинства массовых расстрелов или других видов массовых убийств.