Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
В систему Lutheran (Лютеран) включено 19 антигенов (табл. 8.1). Некоторые из них образуют антитетичные пары: Lua и Lub, Lu6 и Lu9, Lu8 и Lul4, Aua и Aub. Известен нулевой фенотип - Lunull, или Lu(a-b-), при котором все антигены LU отсутствуют.
Таблица 8.1
Антигены системы Lutheran
|
Обозначение антигенов |
Год открытия |
Частота, % |
||
|
авторское |
традиционное |
ISBT |
||
|
Lua |
Lua |
LU1 |
1945 |
7,7 |
|
Lub |
Lub |
LU2 |
1956 |
99,9 |
|
Luab; LuaLub |
Lu3 |
LU3 |
1963 |
>99,9 |
|
Barnes (Ba) |
Lu4 |
LU4 |
1971 |
>99,9 |
|
Beal, Fox |
Lu5 |
LU5 |
1972 |
>99,9 |
|
Jankowski (Jan) |
Lu6 |
LU6 |
1972 |
>99,9 |
|
Gary (Ga) |
Lu7 |
LU7 |
1972 |
>99,9 |
|
Taylor, M.T. |
Lu8 |
LU8 |
1972 |
>99,9 |
|
Mull |
Lu9 |
LU9 |
1973 |
1,7 |
|
Reynolds (Re) |
Lull |
LU11 |
1974 |
>99,9 |
|
Muchowski (Much) |
Lul2 |
LU12 |
1973 |
>99,9 |
|
Hughes |
Lul3 |
LU13 |
1983 |
>99,9 |
|
Hofanesian (Hof) |
Lul4 |
LU14 |
1977 |
1,5-2,4 |
|
|
Lul6 |
LU16 |
1980 |
>99,9 |
|
Delcol, Pataracchia |
Lul7 |
LU17 |
1979 |
>99,9 |
|
Auberger |
Aua,Lul8 |
LU18 |
1961 |
82 |
|
|
Aub, Lul9 |
LU19 |
1989 |
51 |
|
|
Lu20 |
LU20 |
1992 |
>99,9 |
|
|
Lu21 |
LU21 |
2002 |
>99,9 |
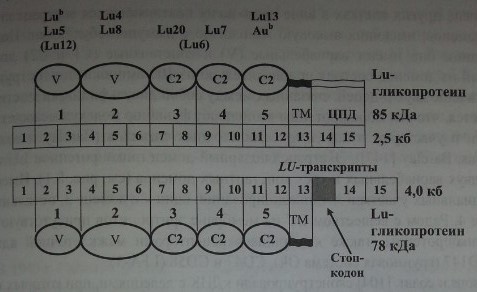
Антигены системы Lutheran располагаются на 2 гликопротеинах с мол. массой 78 кДа (CD239) и 85 кДа, выполняющих роль рецепторов межклеточной адгезии (рис. 8.1).
Локус LU картирован на хромосоме 19; показана его взаимосвязь с генами других групповых систем, расположенных на этой хромосоме: LE, Н, LW, а также с локусом Se, контролирующим выделительство.
Ген LU и домены гликопротеина Lutheran
Изомеры гликопротеина удалось выделить из мембраны эритроцитов посредством иммунопреципитации моноклональными антителами анти-Ьиь, а также анти-ЬиЗ, -Lu4, -Lu6, -Lu8, -Lul2, -Aua, -Aub (Daniels и соавт. [33, 38], Parsons и соавт.[106]). Указанные компоненты отсутствовали в цитоскелете эритроцитов LunuU.
Отмечено некоторое снижение мол. массы гликопротеинов после обработки сиалидазой (Daniels и соавт. [38]). Гликопротеины разрушались сульфидре-дуцентами, что указывало на наличие в их структуре дисульфидных связей. Обработка мембран эритроцитов эндогликозилазой-F приводила к появлению 2 компонентов с мол. массой 73 и 66 кДа, что было связано с утратой части jV-связанных олигосахаридных цепей (Parsons и соавт. [106]).
Parsons и соавт. [105], изучив аминокислотную последовательность полипептида LU, создали олигонуклеотидные праймеры и с помощью ПЦР выделили клон ДНК (2417 пн) из библиотеки ДНК плаценты человека. Кодируемый протеин с мол. массой 85 кДа состоял из 597 аминокислот; 518 из них составляли экстрацеллюлярные домены, 19 - трансмембранный домен, 59 - цитоплазматический. Цитоплазматический участок протеина непосредственно связан с цито-скелетом (Gane и соавт. [55]).
Изомер с мол. массой 78 кДа лишен части цитоплазматического домена (Parsons и соавт. [105]). Позднее было показано, что антиген эпителиального рака (В-САМ) также представляет собой изоформу гликопептида с мол. массой 78 кДа (Campbell и соавт. [18], Rahuel и соавт. [115]).
Гликопротеины LU отсутствуют на лейкоцитах, но в то же время имеются на многих других клетках в виде нескольких повторяющихся экстрацеллюляр-ных доменов, имеющих высокую гомологию с иммуноглобулинами. Подобно последним они имеют вариабельные (V) и константные (С1 и С2) домены.
Каждый из доменов состоит приблизительно из 100 аминокислот и структурирован в виде двух р-цепей, связанных между собой дисульфидными мостиками. Считается, что эти гликопротеины выполняют функцию молекул межклеточной адгезии и участвуют в передаче межклеточных сигналов (Barclay и соавт.[7], Williams, Barclay [147]). Экстрацеллюлярный домен гликопротеинов LU состоит из двух вариабельных и трех константных доменов (см. рис. 8.1). Имеется 5 потенциальных участков JV-гликозилирования: один - в домене 3, остальные - в домене 4. Рядом с веществом LU на мембране эритроцитов присутствуют другие гликопротеины, также являющиеся рецепторами межклеточной адгезии: LW, CD147 (групповая система Ok), CD47 и CD58 (LFA-3).
Parsons и соавт. [104] сконструировали кДНК с делениями, при которых гликопротеин LU синтезировался без одного, двух, трех или четырех доменов. Образцы таких дефицитных гликопротеинов авторы исследовали в проточной цитофлюо-рометрии с антителами анти-LU разной специфичности, что позволило установить локализацию антигенных эпитопов на том или ином домене (см. рис. 8.1).
Таблица 8.2
Организация гена LU
|
Экзон |
Кодируемый домен |
Число кодонов |
Размер интрона, кб |
|
1 |
5'UT + лидер-пептид |
105 |
2,0 |
|
2 |
1IgSF(V) |
122 |
0,7 |
|
3 |
1 IgSF(V) |
229 |
0,09 |
|
4 |
2IgSF(V) |
71 |
0,5 |
|
5 |
2IgSF(V) |
95 |
0,09 |
|
6 |
2IgSF(V) |
185 |
0,53 |
|
7 |
3 IgSF(C2) |
137 |
0,31 |
|
8 |
3IgSF(C2) |
157 |
3,5 |
|
9 |
4 IgSF(C2) |
116 |
0,1 |
|
10 |
4 IgSF(C2) |
142 |
0,17 |
|
11 |
5 IgSF(C2) |
137 |
0,15 |
|
12 |
5 IgSF(C2) |
145 |
0,09 |
|
13 |
Трансмембранный и 19 позиций цитоплазматического |
145 |
0,97 |
|
14 |
Цитоплазматический |
118 |
0,09 |
|
15 |
Один аминокислотный остаток в цитоплазматическом (для изоформы 85 кДа) |
498 |
|
Ген LU состоит из 15 экзонов размером 12,5 кб (см. рис. 8.1, табл. 8.2). Экзон 1 кодирует сигнальный пептид, экзоны 2-12 кодируют 5 доменов; вариабельный ^Н^Е кодируется экзонами 4, 5 и 6. Экзон 13 кодирует трансмембранный домен.
обеих изоформ гликопротеина LU; экзоны 14 и 15 - терминальный участок, состоящий из 40 аминокислот (см. табл. 8.2). Терминальный участок присутствует только в изоформе с мол. массой 85 кДа (El Nemer и соавт. [51], Parsons и соавт. [104]). Выделены два транскрипта гена LU. Один из них, величиной 2,5 кб, кодировал гликопротеин с мол. массой 85 кДа, другой гликопротеин, величиной 4,0 кб, кодировал гликопротеин 78 кДа (Rahuel и соавт. [115]). Транскрипты отличались альтернативным сплайсингом интрона 13. В транскрипте 2,5 кб интрон 13 отсутствовал, экзоны 14 и 15 кодировали С-терминальный участок из 40 аминокислот.
Клиническое значение
Антитела системы Lutheran не считаются клинически значимыми. По данным ряда авторов, ГБН, обусловленная антителами анти-Lu3 и анти-Lu15, протекала в легкой форме и не требовала лечения, не считая фототерапии. В то же время прямая антиглобулиновая проба с эритроцитами новорожденных была положительной, содержание билирубина повышено (Boulton [11], Dube, Zoes [43], Francis, Hatcher [53], Inderbitzen, Windle [70], Kissmeyer-Nilssen [77], Molthan, Crawford [95], Scheffer, Tamaki [122]). Одной из возможных причин легкого течения ГБН при несовместимости по факторам LU является их слабая выраженность на эритроцитах новорожденных. Существует и другое объяснение: значительная часть материнских антител адсорбируется на клетках плаценты, которые содержат гликопротеины Lutheran, что в значительной мере смягчает воздействие антител на организм плода.
Антитела системы Lutheran не вызывали гемолитических посттрансфузионных реакций. Castillo, Leveque [20], Greenwalt, Sasaki [61], Mollison и соавт. [94], Molthan, Crawford [95] описали единичные случаи замедленных посттрансфузионных реакций с легким течением и умеренно выраженной желтухой. Эритроциты Lu(a+) с радиоактивной меткой, будучи введенными больным, имеющим анти^иа-антитела, имели нормальную продолжительность жизни (Greendyke, Chorpenning [60]). Аналогичные исследования в отношении анти-Lub-affnrren подтвердили, что лишь часть меченых эритроцитов выводится из сосудистого русла (Boulton [11], Cutbush, Mollison [32], Tilley и соавт. [138])
Фенотип Lu null
Как и другие групповые системы эритроцитов, система Lutheran может быть представлена нулевым фенотипом. Фенотип Lunull, впервые описанный Crawford и соавт. [27] в 1961 г. как Lu(a-b-), возникает вследствие трех причин:
- гомозиготность по рецессивному аллелю LU-;
- наличие доминантного супрессорного гена In(Lu) независимого от LU;
- гомозиготность по Х-сцепленному супрессорному гену.
Истинным нулевым фенотипом является первый из указанных в табл. 8.3, поскольку только в этом случае отсутствие антигенов LU обусловлено собственно геном LU9 в 2 других случаях следовые количества вещества Lutheran на эритроцитах удается выявить специальными методами исследования.
Таблица 8.3
Характеристика фенотипа Lunull
|
Тип наследования |
Вовлеченный ген |
Вещество LU |
Антиген AnWj (Anton) |
Антигены PI, i, CD44 |
|
Рецессивный |
Lu |
Отсутствует |
Присутствует |
Нормальные |
|
Доминантный |
In(Lu) |
Ослаблено |
Отсутствует |
Ослаблены |
|
Х-сцепленный |
XS2 |
Ослаблено |
Присутствует |
Нормальные |
Фенотип Lunull преимущественно обусловлен доминирующим геном In(Lu). Так, при исследовании 50 семей, среди членов которых имелись лица Lunull, доминантный тип наследования супрессорного гена был доказан в 41 случае. В 9 других случаях причину фенотипа Lunull точно установить не удалось, хотя серологические данные (наличие следовых количеств групповых субстанций Lutheran) также указывали на наследование супрессорного гена (Rowe и соавт. [118], Shaw и соавт. [123]).
Несколько обширных исследований, проведенных в Англии Darnborough и соавт. [41], Gibson [57], Rowe и соавт. [118], Shaw и соавт. [123], позволили установить частоту фенотипа Lunull - 0,005-0,012 % (табл. 8.4). Среди негров Детройта (США) этот показатель соответствовал 0,027 % (Winkler, Hamilton [149]), у доноров Хьюстона (США) - 0,02 % (Udden и соавт. [145]); у жителей Портленда частота фенотипа LunuI1 - 0,12 % (Lukasavage [82]). В последнем случае данные могут быть не совсем точными, поскольку автор использовал сыворотку, содержащую антитела анти-AnWj к часто встречающемуся антигену Anton (Lul5), который на протяжении ряда лет считали частью системы Lutheran. Broadberry и соавт. [14] нашли фенотип Lu у китайцев.
Таблица 8.4
Частота фенотипа Lu в некоторых популяциях
|
Жители городов |
Количество обследованных |
Выявлено лиц Lu п null |
Частота Шт % |
Источник |
|
Лондон, Англия |
250 ООО |
79 |
0,03 |
[123] |
|
Шеффилд, Англия |
18 069 |
1 |
0,01 |
[41] |
|
Кембридж, Англия |
3 197 |
1 |
0,03 |
[57] |
|
Южный Уэльс, Англия |
75 614 |
15 |
0,02 |
[118] |
|
Хьюстон, США |
42 ООО |
8 |
0,02 |
[145] |
|
Портленд, США |
2 400 |
3 |
0,12 |
| [82] |
|
Детройт, США, негры |
7 314 |
2 |
0,03 |
[149] |
|
Тайвань, китайцы |
1 922 |
1 |
0,05 |
[14, 152] |
Lua и Lub
В 1945 г. Callender и соавт. [17] обнаружили у женщины, страдавшей системной красной волчанкой, антитела, которые образовались у нее после трансфузии крови донора по фамилии Lutheran. Таким образом, первый антиген системы Lutheran - Lua, открытый авторами, и сама система своим названием обязаны указанному донору.
Десятью годами позднее Cutbush и Chanarin [31] описали антитела, открывавшие антиген, антитетичный фактору Lua, который обозначили Lub.
Частота антигена Lua около 8 % среди европеоидов и негроидов. Он встречается очень редко или отсутствует у монголоидов (Bertinshaw и соавт. [9], Callender, Race [16], Chown и соавт. [23, 24], Dublin и соавт. [44], Hartmann и соавт. [66], Mainwaring, Pickles [84], Mourant и соавт. [99], Yung и соавт. [152]).
Последующие популяционные исследования с использованием двух сывороток, aHTH-Lua и aHTH-Lub, выявили лиц редкого нулевого фенотипа Lu(a-b-) (Rowe и соавт. [118], Shaw и соавт. [123]).
Посемейными исследованиями показано кодоминантное наследование генов Luaи Lub (Chown и соавт. [23,24], Lawler [79], Race, Sanger [113]).
Молекулярно-генетическими исследованиями последнего десятилетия установлено, что специфичность антигенов Lua и Lub обусловлена мутацией в экзоне 3 гена LU, приводящей к замене гистидина на аргинин в положении 77 (Е1 Nemer и соавт. [51], Parsons и соавт. [104]).
Серологические исследования выявили вариабельность экспрессии антигенов Lutheran у разных лиц. Однако у членов одной и той же семьи выраженность антигенов примерно одинакова (Race, Sanger [113]). Другой особенностью антигенов Lutheran является выраженный эффект дозы (Cutbush, Chanarin [31], Greenwalt и соавт. [61,62], Kissmeyer-Nilssen [77], Metaxas и соавт. [93]).
Реагирование антигенов и антител системы LU имеет свои особенности. Так, антиген Lub на эритроцитах лиц Lu(a+b+) в отдельных случаях выявляют только с помощью метода адсорбции - элюции. Агглютинация, вызываемая антителами системы Lutheran, нередко имеет смешанный характер: наряду с аг-глютинатами присутствует значительное количество свободных эритроцитов (Callender, Race [16], Cutbush, Chanarin [31], Daniels [34], Issitt, Anstee [72]).
оличество антигенных участков Lub на эритроцитах невелико: при фенотипе Lu(a-b+) на 1 эритроците размещено 1640-4070 антигенных участков; при фенотипе Lu(a+b+) - 850-1820 (Merry и соавт. [92]). Антигены LU выражены слабее у детей, чем у взрослых. Антиген Lua обнаруживали у 12-недельных плодов, Lub -у 10-недельных (Race, Sanger [113], Toivanen, Hirvonen [142]). К 15 годам экспрессия антигенов LU достигает уровня взрослых (Greenwalt и соавт. [62]).
Анти-Lu*
Как отмечено выше, первый образец антител анти-Lu3 был получен от женщины, имевшей гемотрансфузии. В ее сыворотке, помимо анти-Lu3, содержались антитела анти-с, анти-С^, анти-Крс и анти-N. Через некоторое время после гемотрансфузии активность антител анти-Lu3 постепенно снизилась. Попытки повысить их титр инъекциями небольших доз крови донора Lutheran не дали желаемого результата (Callender, Race [16]).
О выявлении антител анти-Lu3 во время беременности или после гемотрансфузии сообщили Francis, Hatcher [53], Greendyke, Chorpenning [60], Greenwalt и соавт. [61, 62], Inderbitzen, Windle [70]. Их часто обнаруживали одновременно с другими антителами, особенно с анти-Bg (HLA-антитела, реагирующие с эритроцитами) (Crawford [26]).
Gonzenbach и соавт. [58], Shaw и соавт. [125] описали анти-Еи3-антитела естественного происхождения у лиц, не имевших беременностей и гемотрансфузии.
Антитела анти-Lu3 в основном IgM, при этом в сыворотке могут присутствовать фракции IgG и IgA (Gonzenbach и соавт. [58], Issitt, Anstee [72], Reid, Lomas-Francis [117], Shaw и соавт. [125]). Активные анти-Еи3-сыворотки, пригодные для фенотипирования, встречаются редко.
Анти^и3-антитела вызывают прямую агглютинацию эритроцитов Lu(a+) при комнатной температуре (20-22 °С). Некоторые сыворотки реагируют также при 37 °С в антиглобулиновой пробе, и лишь отдельные, содержащие только IgG, проявляют себя исключительно в непрямой пробе Кумбса (Francis, Hatcher [53], Issitt, Anstee [72], Mollison и соавт. [94]).
Анти-Ьиь
Антитела aHra-Lub встречаются реже, чем aHra-Lub, однако многократно описаны в литературе и детально изучены (Boulton [11], Chattoraj и соавт. [22], Croucher и соавт. [30], Dube, Zoes [43], Greenwalt и соавт. [61, 62], Kissmeyer-Nilssen [77], Metaxas и соавт. [93], Molthan, Crawford [95], Parsons и соавт. [106], Peters и соавт. [108], SchefTer, Tamaki [122]). Чаще всего они моноспецифические. В большинстве случаев причиной их образования были беременности или гемотрансфузии. Антитела airra-Lub естественного происхождения не описаны. Оптимальным методом их выявления является непрямая антиглобулиновая проба, хотя и описаны образцы, агглютинирующие эритроциты в прямой реакции при температуре 20-22 °С (Cutbush, Chanarin [31], Greenwalt и соавт. [62], Kissmeyer-Nilssen [77],
axas и соавт. [93]). В большинстве случаев антитела анти-Ьиь являлись смесью IgM и IgG, некоторые сыворотки содержали также фракцию IgA (Adkins [3], Dube, Zoes [43], Mollison и соавт. [94], Peters и соавт. [108]). Анти-Ьиь чаще были представлены субклассом IgGl, однако встречались также IgG2 и IgG4 (Hardman, Beck [65], Herron и соавт. [69], Novotny и соавт. [102]).
Описаны 2 образца мышиных моноклональных антител анти-Ьиь, которые не были идентичны аллогенным. В тестах адсорбции - элюции они частично реагировали с эритроцитами Lu(a+b-) и Lunull (Daniels [35], Inglis и соавт. [71], Judson и соавт. [75], Telen [135]).
Анти-ЬиЗ
Всех индивидов с рецессивным типом Lu удалось выявить по наличию в их крови антител к антигену с очень высокой частотой встречаемости. Эти антитела первоначально были обозначены как анти-ЬиаЬ и позднее - анти-ЬиЗ (Bove и соавт. [12], Melonas, Noto [91]). Указанные антитела не являются простой смесью анти-Ьиа и анти-Ьиь и реагируют одинаково интенсивно с эритроцитами Lu(a-b+) и Lu(a+b-) и могут быть адсорбированы клетками любого из указанных фенотипов. Адсорбция антител эритроцитами Lu(a-b+) полностью устраняла их способность агглютинировать эритртроциты Lu(a+b-), а адсорбция эритроцитами Lu(a+b-) устраняла их способность агглютинировать эритроциты Lu(a-b+) (Darnborough и соавт. [41], Myhre и соавт. [100]). Антиген Lu3 всегда присутствует на эритроцитах, если они экспрессируют какой-либо из антигенов системы Lutheran. Эритроциты лиц с другими типами Lunull (доминантным и Х-связанным) не агглютинируются антителами анти-ЬиЗ, однако способны их адсорбировать, что было показано с помощью адсорбции - элюции.
Имеются сообщения о получении мышиных моноклональных антител, специфичность которых близка к анти-ЬиЗ. Указанные антитела реагировали со всеми образцами эритроцитов, за исключением Lunull (Parsons и соавт. [105], Telen [135], Zelinski и соавт. [154]).
Lunull рецессивного типа
Фенотип Lu „, сформировавшийся за счет рецессивного гена, впервые описан Darnborough и соавт. [41] у англичанки, миссис LB. Сыворотка ее крови содержала антитела, реагировавшие с эритроцитами всех обследованных лиц за исключением членов ее семьи (Crawford и соавт. [27]). Титрование сывороток airra-Lub эритроцитами детей миссис LB показало, что эти эритроциты содержат только 1, а не 2 дозы указанного антигена. Авторы пришли к выводу, что миссис LB гомозиготна по рецессивному аморфному гену Lu ", находящемуся под контролем локуса LU.
Позднее 7 индивидов с рецессивным типом Lunull были найдены в одной канадской и двух японских семьях (Brown и соавт. [15], Mallinson и соавт. [85], Myhre и соавт. [100]). В этих семьях родители были кровными родственниками. Авторы подтвердили рецессивный характер наследования молчащего гена Lu .
В сыворотках крови 5 лиц Lu ц присутствовали антитела, реагировавшие со всеми образцами эритроцитов, за исключением Lu,.. Антитела получили обозначение aHTH-Lu3.
В одном случае женщина Lu.. (с предполагаемым генотипом Lu~fLu~\ имевшая анти^иЗ-антитела, состояла в браке с мужчиной Lu(a+b+) (генотип Lua/Lub). Ее дети имели фенотип Lu(a-b+) и Lu(a+b-) (генотип Lu~ILub и Lua/Lu~ соответственно). Таким образом, антигенный статус детей не мог служить источником ее аллоиммунизации антигеном Lu3, который представляет собой антиген Lu** а не Lua + Lub.
Обследование 3 упомянутых выше семей показало, что в браках Lunullх не-LunuU не было детей Lu uI1. Это со всей очевидностью указывало на рецессивный характер наследования молчащего аллеля Lu~.
Обнаружение антител анти-ЬиЗ в сыворотке крови одной американской негритянки давало основания полагать, что она имела рецессивный тип LunulI, однако при обследовании ее семьи это доказать не удалось (Melonas, Note [91]).
Дополнительные сведения в пользу существования молчащего аллеля Lu были получены Brown и соавт. [15]. Авторы нашли семьи, в которых родители Lu(a+b+) х Lu(a-b+) имели детей с фенотипом Lu(a+b-). Вероятно, в этих случаях имела место гетерозиготность родителей Lu(a-b+) по гену Lu'. В браках родителей Lua/Lubх Lub/Lu~ были дети Lua/Lu~9 что фенотипически проявлялось как Lu(a+b-).
На эритроцитах лиц с рецессивным типом Lunull все, без исключения, антигены системы Lutheran отсутствуют. Их не удавалось обнаружить методом адсорбции - элюции.
В одной японской семье пробанд Lu(a-b-), имевший антитела анти-ЬиЗ, оказался гомозиготным по нонсенс-мутации С 733 А в экзоне 6 гена LU. Последняя преобразует кодон Cys 237 в стоп-кодон (Mallinson и соавт. [85]). Родители пробанда были гетерозиготными по указанной мутации.
Lunull доминантного типа
Обследование трех поколений семьи первого из выявленных пробандов Lunullпоказало, что этот признак находится под контролем гена, имеющего доминантный тип наследования (Crawford и соавт. [27]). Позднее появились другие аналогичные сообщения (Contreras, Tippett [25], Gibson [57], Rowe и соавт. [118], Shaw и соавт. [123], Stanbury, Francis [133], Taliano и соавт. [134], Wright, Moore [150]).
В отличие от лиц Lu u рецессивного типа, которых выявляли случайно в связи с наличем у них антител, лиц Lu " доминантного типа обнаруживали при плановом фенотипировании доноров сыворотками анти-Lu3 и aHra-Lub.
В обследованных семьях 52 пробанда Lunull имели 63 сибса Lunull и 61 сибса не Lunull (Gibson [57], Race, Sanger [113], Rowe и соавт. [118], Shaw и соавт. [123]). Статистический анализ результатов обследования детей у родителей Lunull х He-Lunull показал, что соотношение частоты фенотипов равно 1:1. Таким образом, имелись все основания полагать, что ген Lu „ является кодоминантным.
Taliano и соавт. [134] обозначили супрессорный ген, приводящий к Lunп доминантного типа, буквами In(Lu). Авторы предположили, что должен существовать его аллель in(Lu), не оказывающий супрессорного эффекта на антигены системы Lutheran. Однако последующее открытие супрессорного действия In(Lu) на антигены Р1 и i, не входящие в систему Lutheran, побудило Race и Sanger [113] высказать сомнения относительно концепции Taliano и соавт.
Marsh и соавт. [89] предлагали переименовать In(Lu) в SYN-1 и SYN-1В, нарушающие нормальный биосинтез некоторых групповых антигенов, и SYN-1A, в присутствии которого биосинтез происходит нормально.
Эта номенклатура была признана неудовлетворительной, поскольку в ней подразумевалось, что ген In(Lu) модифицирует биосинтез на уровне субстанций-предшественников, в то время как механизм действия этого гена неизвестен (Shaw, Tippett [124]). По этой причине в настоящее время предпочитают использовать обозначения In(Lu) (для гена) и In(Lu) (для фе-нотипических проявлений).
Эритроциты лиц, имеющих ген In(Lu), не обладают истинным фенотипом Lunull, поскольку способны адсорбировать антитела системы Lutheran (Moulds, Shah и соавт. [97], Stanbury, Francis [133], Telen и соавт. [136], Tippett [139]). Однако отрицательные результаты экспериментов с адсорбцией - элю-цией антител системы Lutheran нельзя расценивать как абсолютное доказательство того, что обследуемый относится к группе Lu п рецессивного типа.
Некоторым исследователям не удавалось элюировать антитела Lutheran с эритроцитов In(Lu) (Crawford и соавт. [27], Wright, Moore [150]).
В то же время адсорбция - элюция антител aHTH-Lua и aHTH-Lub позволяют выявить истинный рецессивный тип Lunull у некоторых лиц In(Lu). Посемейные исследования выявили рекомбинацию генов LU и In(Lu) (Taliano et. al. [134]). На рис. 8.2 представлена родословная семьи, показывающая независимость супрессорного гена In(Lu) от локуса LU. Исследования в других семьях позволили установить рекомбинации In(Lu) и генов, контролирующих системы АВО, MNS, PI, Rh, Kell, Kidd, Cartrwrigh, Colton, Se и HLA (Rowe и соавт. [118], Shaw и соавт. [123]). Статистический анализ подтвердил отсутствие коррелятивной связи гена In(Lu) с перечисленными локусами групп крови.
О выявлении каких-либо антител системы Lutheran в сыворотках крови лиц, имеющих фенотип In(Lu), ни разу не сообщалось. Вероятно, иммунная система таких индивидов не реагирует на антигенные детерминанты указанной системы как на чужеродные. Антитела не были найдены в сыворотках крови 12 женщин группы In(Lu), родивших детей с нормально выраженными антигенами Lu (Shaw и соавт. [123], Wright, Moore [150]).
Ген In(Lu) подавляет синтез антигенов Lutheran. Кроме того, на эритроцитах лиц In(Lu) снижена экспрессия ряда других антигенов, не относящихся к системе Lutheran. Интересен тот факт, что у индивидов с рецессивным типом Lunullэти антигены выражены нормально.
Присутствие гена In(Lu) вызывает супрессию антигена Р1, хотя этот эффект менее выражен, чем в отношении факторов Lutheran. Crawford и соавт. [27], Gibson [57], Shaw и соавт. [123] привели данные обследования 236 человек, членов 41 семьи, среди которых были индивиды In(Lu) (табл. 8.5). Распределение антигенов ¥х и Р2 среди носителей фенотипа In(Lu) существенно отличалось от распределения этих антигенов у лиц с фенотипом He-In(Lu). У 36 лиц Lunull антиген ?х был выражен нормально, что могло быть обусловлено присутствием высокоактивного аллеля Р1+, или гомозиготностью по нему, или обеими причинами одновременно. У лиц с рецессивным типом Lu л выраженность антигена ?х также не отличалась от нормы. В 3 семьях у родителей P2Lunull х P2Lu(a-b+) были дети PjLu(a-b+), что подтверждает ингибиру-ющий эффект гена In(Lu) на ген Р1
Наследование фенотипа In(Lu) в семье жителей о. Сардиния. Италия. Ген In(Lu) (черные фигуры) и фенотипы членов семьи по системе Р1 [25]. Члены семьи II-1 и Ш-4 имеют фенотип Р2 в отсутствие теш1п(Ьи)9 в то время как 1-2 имеет фенотип Pj и обладает геном In(Lu), 1-2, вероятно, гомозиготна по гену Р1 • поэтому экспрессирует Р1 в присутствие тев&1п(Ьи).
К антигенам, экспрессия которых снижена в присутствии гена In(Lu), относят фактор i. Антиген i хорошо выражен на эритроцитах новорожденных, однако его экспрессия резко снижена у детей In(Lu) (Crawford и соавт. [29]).
У взрослых людей, имевших фенотип LunuI1, антиген I был выражен нормально: какого-либо супрессорного влияния на ген / ген In(Lu) не оказывал.
На эритроцитах In(Lu) слабо экспрессированы антигенные детерминан-ы CD44. Этот кластер дифференцировки несет антигены 1па и Inb системы Indian, которые, помимо эритроцитов, экспрессированы на других клетках, нтигенные детерминанты Inb у лиц In(Lu) ослаблены. У лиц с рецессивным тспом Lunull антигенные детерминанты CD44, в том числе антиген Inb, выраже-ы нормально (Spring и соавт. [132], Telen, Green [137]).
По данным Poole, Giles [109], Marsh и соавт. [88], со структурой CD44 ассоциирован часто встречающийся антиген AnWj (Anton). Он слабо выражен на эри-юцитах In(Lu)9 в связи с чем сначала был причислен к системе Lutheran и по-ш обозначение Lul5. Однако далее выяснилось, что антиген AnWj нормально выражен на эритроцитах лиц с рецессивным типом Lu ... По этой причине антиген AnWj был исключен из описываемой системы, а обозначение Lul5 - из номенклатуры групп крови и его более не используют (Poole и соавт. [110]).
Ген In(Lu) угнетает также экспрессию антигенов системы Knops: Кпа, МсСа, Sla и антигенов Yka, Csa коллекции 205 Cost (Daniels и соавт. [40]). Известно,
что указанные антигенные детерминанты являются рецепторами компонентов СЗ/С4 системы комплемента, CR1 (CD35), однако In(Lu) не влияет на экспрессию CR1 (Moulds, Shah [97]).
Ингибирующий эффект In(Lu) установлен также в отношении антигена MER2 системы RAPH (Daniels [36]).
Интересный феномен, связанный с фенотипом по системе Lutheran, обнаружен в экспериментах с лошадиным антилимфоцитарным иммуноглобулином, который применяют в трансплантологии для профилактики кризов отторжения. Оказалось, что он значительно слабее реагирует с эритроцитами In(Lu) по сравнению с любыми другими, включая Lunull (Anderson и соавт. [4], Postoway, Garratty [112]).
Слабая агглютинация эритроцитов In(Lu) отмечена также с конканавали-ном А - растительным лектином, агглютинирующим эритроциты человека. Указанный лектин реагирует главным образом с протеином полосы 3 (band 3 protein), транспортером анионов. В связи с этим высказано предположение, что гликозилирование анионных транспортеров на клетках In(Lu) отличается от нормального (Udden и соавт. [145]).
Вместе с тем на эритроцитах имеется уникальная структура - CDw75, выраженность которой усиливается в присутствии гена In(Lu). Этот лиганд, помимо эритроцитов, содержится в лимфоцитах и распознается моноклональ-ными антителами. Биохимическая природа и физиологические функции эпи-топа CDw75 до конца не выяснены, известно лишь, что для его экспрессии необходимо присутствие N-гликанов с остатками а2,6-сиаловых кислот (Bast и соавт. [8], Guy и соавт. [63, 64]). Эпитоп CDw75 выражен нормально на эритроцитах лиц Lunull рецессивного типа, но отсутствует у индивидов LunullХ-ассоциированного (Tippett, Guy [141]). На эритроцитах пуповинной крови CDw75 отсутствует.
Лица, имеющие фенотип In(Lu), соматически здоровы и не обнаруживают каких-либо признаков анемии (снижение уровня гемоглобина, ретикулоцитоз), хотя у членов трех семей, наследовавших In(Lu), имелся акантоцитоз (Ballas и соавт. [6], Udden и соавт. [145]). Выживание аутологичных эритроцитов In(Lu) in vivo было нормальным (Ballas и соавт. [6]), осмотическая резистентность эритроцитов соответствовала норме. Инкубация эритроцитов In(Lu) в плазме в течение 24 ч при 37 °С повышала их осмотическую резистентность. При этом отмечали утрату значительной части ионов калия и относительное повышение содержания натрия; в целом концентрация катионов снижалась. Эти изменения позволяют объяснить повышение осмотической резистентности (Udden и соавт. [145]). Выраженный гемолиз эритроцитов In(Lu) наблюдали при хранении их в растворе Алсевера (глюкозидцитратный консервант для эрмассы) при 4 °С, разрушение клеток уменьшалось после добавлении глюкозы или АТФ.
По мнению Tippett [140], ингибирующий эффект гена In(Lu)9 оказываемый одновременно на несколько различных локусов, контролирующих групповые антигены эритроцитов, является уникальным. Моделей, которые могли бы объяснить этот феномен, пока не предложено.
Marcus и соавт. [86] высказали предположение, что Lunull доминантного типа может быть результатом действия гликозилтрансферазы, присоединяющей дополнительные сахара к структуре-предшественнику.
Udden и соавт. [145] полагают, что частичное редуцирование рецепторов для конканавалина А на эритроцитах In(Lu) обусловлено необычным гликозижровани-ем углеводных последовательностей, общих для гликопротеинов и гликолипидов.
Shaw и Tippett [124] считают, что в присутствии In(Lu) могут возникать кон-формационные изменения некоторых мембранных структур, затрудняющие их связывание с антителами.
По мнению Daniels и соавт. [40], ген In(Lu) кодирует ДНК-связывающий протеин или какой-либо из факторов транскрипции, ингибирующий функции генов, ответственных за синтез мембранных структур.


![Наследование фенотипа In(Lu) в семье жителей о. Сардиния. Италия. Ген In(Lu) (черные фигуры) и фенотипы членов семьи по системе Р1 [25]. Члены семьи II-1 и Ш-4 имеют фенотип Р2 в отсутствие теш1п(Ьи)9 в то время как 1-2 имеет фенотип Pj и обладает геном In(Lu), 1-2, вероятно, гомозиготна по гену Р1 • поэтому экспрессирует Р1 в присутствие](/images/stories/stat/aa8.jpg)

