Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система Duffy
Moore и соавт. [115], используя методы иммунопреципитации, установили, что антиген Fya присутствует на 3 протеинах, имеющих мол. массу 39, 64 и 85 кДа. Иммуноблоттинг с антителами анти-Fy* позволил выявить структуры с мол. массой 35 - 43 (Hadley и соавт. [60]) и 40-50 кДа (Tanner и соавт. [156]). Субстрат, выделенный электроэлюцией из протеинов 35-43 кДа, ингиби-ровал антитела анти-Fy3 [60]. Аналогичные результаты получили Nichols и соавт. [124], Riwom и соавт. [140], использовавшие иммуноблоттинг с монокло-нальными антителами анти-Руб.
Обработка эритроцитов эндо-Р-гликаназой, N-гликаназой и сиалидазой снижала мол. массу выделяемых с помощью иммуноблоттинга Fy-гликопротеинов до 4 кДа (Hadley и соавт. [60], Tanner и соавт. [156]).
Riwom и соавт. [140] и Wasniowska и соавт. [172] выделили низкомолекулярные фракции из очищенных Fy-гликопротеинов и третичных структур, полученных из них. Указанные исследования свидетельствовали о том, что Fy-гликопротеины N-гликозилированны и слабо О-гликозилированы. Разная степень N-гликозилирования, вероятно, и обусловливает колебания мол. массы Fy-гликопротеинов в широком диапазоне (Chaudhuri и соавт. [30]).
Chaudhury и соавт. [30] посредством иммунопреципитации моноклональны-ми антителами анти-Руб выделили Fy-гликопротеин с мол. массой 36-43 кДа вместе с олигомерами большей мол. массы, последние также реагировали с указанными антителами. Другие из сопутствующих протеинов не реагировали в реакции иммунного окрашивания с антителами анти-Руб. Картирование пептидов, выделенных из эритроцитов Fy(a+b-) и Fy(a-b+), существенных различий не выявило (рис. 10.2).
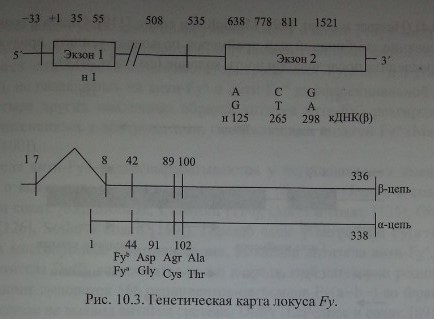
Chaudhury и соавт. [28], изучив последовательность аминокислот в очищенных Duffy-гликопротеинах, сконструировали олигонуклеотидные прай-меры и с помощью ПЦР изменили кодирующий участок ДНК, полученной от лиц Fy(a-b+). Затем этот продукт был использован для выделения кодирующей ДНК из библиотеки ДНК костномозговых клеток человека. В результате исследования получен пептид из 338 аминокислот с мол. массой 35,7 кДа (рис. 10.3).
Neote и соавт. [123] установили, что Fy-гликопротеин структурирован в виде а-спиралей, 7 раз пересекающих мембрану эритроцитов, имеет экстрацеллюлярный N- и цитоплазматический С-домены (см. рис. 10.1). Такое строение свойственно хемокиновым рецепторам (Л и соавт. [81], Murdoch, Finn [120]). Экстрацеллюлярный домен, состоящий из 65 аминокислот, имеет 3 участка N-гликозилирования - позиции 16, 27 и 33. Антитела анти-Руб реагировали с синтетическим пептидом, представляющим собой фрагмент N-терминального домена Fy-гликопротеина.
Первая из полученных образцов Duffy кДНК была представлена одним эк-зоном (Chaudhuri и соавт. [29], Iwamoto и соавт. [79], Tournamille и соавт. [160]).
Позднее Iwamoto и соавт. [77] показали, что в неэритроидных тканях преобладают транскрипты, состоящие из двух экзонов, разделенных 479 парами кодонов. Первый экзон кодирует семь N-терминальных аминокислот Fy-гликопротеина, включая инициирующий трансляцию метиониновый кодон. Терминальный участок молекул Fy-гликопротеина представлен последовательностью MGNCLHRAEL (Iwamoto и соавт. [77]).
В регионе 5! гена FY нет ТАГА- и СААТ-боксов, однако имеется несколько участков SP1 и GATA, препятствующих транскрипции (Iwamoto и соавт. [79], Tournamille и соавт. [160]).
Фенотип Fy(a-b-) был впервые выявлен Sanger и соавт. [144] при исследовании крови доноров (американских негров) сыворотками aHra-Fya и анти-Fyb. Оказалось, что большинство лиц указанной расовой принадлежности являются Fy(a-b-). Такие результаты позволили высказать предположение о существовании рецессивного аллеля в локусе Duffy. Этот молчащий аллель получил обозначение Fy. Частота фенотипа Fy(a-b-) составила 63 % среди негров Нью-Йорка, Вест-Индии (Race, Sanger [136]) и Южной Африки (Olsson и соавт. [127]), а среди других африканских популяций она оказалась еще более высокой (Mourant и соавт. [118]). Все 1168 обследованных жителей сельских районов Гамбии имели фенотип Fy(a-b-) (Welch и соавт. [176]).
Данные посемейных исследований в 53 негритянских семьях позволили подтвердить первоначальное предположение о существовании молчащего аллеля Fy (Race, Sanger [136]). Эффект дозы, выявляемый некоторыми образцами антител анти-Fy3, позволил установить, что практически все европеоиды Fy(a+b-) имеют генотип Fya/Fya и содержат двойную дозу антигена Fya, а негроиды имеют генотип Fya/Fy, их эритроциты несут 1 дозу антигена Fya и реагируют с антителами анти-Fy3 менее интенсивно, чем эритроциты Fy(a+) европеоидов (Sanger и соавт. [144]).
Хотя эритроциты Fy(a-b-) лишены ^^-гликопротеина (Chaudhuri и соавт. [28, 30]), последний у негроидов экспрессирован на клетках эндотелия посткапиллярных венул в мягких тканях и синусах селезенки (Peiper и соавт. [132]). Транскрипты гена F7 (иРНК) не были выявлены в костном мозге лиц Fy(a-b-), однако их обнаружили в других тканях (легкие, селезенка, толстая кишка) (Chaudhuri и соавт. [29]). Кодирующая последовательность аллеля Fy оказалась идентичной кодирующей последовательности аллеля Fyb (Chaudhuri и соавт. [28, 29], Iwamoto и соавт. [79], Mallinson и соавт. [99], Peiper и соавт. [132], Tournamille и соавт. [164]), однако в промоторной области имелась нуклеотидная замена Т > С, расположенная на 33 позиции выше стартовой точки считывания для эритроидных транскриптов, на 66 позиций выше такой же точки для образования большого транслирующего кодона (позиция 67), включая участок рестрикции Styl (Iwamoto и соавт. [78], Tournamille и соавт. [160]). Эта мутация внутри последовательности GATA (с заменой СТТАТСТ на СТТА£СТ) прерывает связывание эритроидспецифического фактора транскрипции GATA-1 и тем самым препятствует экспрессии антигенов FY на эритроидных клетках, при этом другие типы клеток не затрагиваются.
Iwamoto и соавт. [78], Tournamille и соавт. [160] провели эксперименты по трансфекции эритроидной клеточной линии человека (HELa) и линии эн-дотелиальных клеток промоторным регионом гена Fybn гена, кодирующего хлорамфениколацетилтрансферазу (ХАТ). В клетках, подвергнутых трансфекции, отметили высокий уровень ХАТ-активности. Трансфекция клеток фрагментами ДНК, содержавшими Fy-специфическую Т 33 С GATA-мутацию, не приводила к появлению ХАТ-активности в эритроидных клетках, однако в клетках эндотелиальной линии ее наблюдали.
Из 1062 обследованных жителей Папуа - Новой Гвинеи 23 оказались гетерозиготными по /^-специфической последовательности Gly 42 и GATA-мутации, типичной для аллеля Fy. Частота аллеля составила 0,022 (Zimmerman и соавт. [184]). По-видимому, указанный аллель ведет себя как молчащий в отношении эритроидных клеток, поскольку эритроциты таких лиц имеют слабую экспрессию антигена Fy6 по сравнению с эритроцитами гомозигот Fya/Fya.
Фенотип Fy(a-b-), типичный для негроидов, встречается крайне редко среди представителей других рас и этнических групп (Mourant и соавт. [118]). Он не был найден среди 6 тыс. белых жителей Австралии при их обследовании с помощью сыворотки aHTH-Fy3 (Albrey и соавт. [10]).
Chown и соавт. [35], Lewis и соавт. [92] рассчитали, что частота гена Fy среди лиц белой расы составляет около 0,001; ожидаемая частота фенотипа Fy(a-b-) - 1 на 1 млн. В нескольких семьях выявлено необычное наследование генов Fya и Fyb, обусловленное, как полагают Chown и соавт. [35], присутствием аллеля Fyx.
Людей Fy(a-b-) среди европеоидов и монголоидов обычно идентифицировали в связи с обнаружением в сыворотках их крови активных антител анти-Fy3. У одной из австралийских женщин Fy(a-b-) имелась делеция 14 пар кодонов гена FY (Albrey и соавт. [10]), которая изменяла рамку считывания и приводила к прекращению трансляции (Mallinson и соавт. [99]). Молекулярно-генетические методы исследования позволили выявить у 3 неродственных лиц гомозиготность по нонсенс-мутациям, приведшим к формированию фенотипа Fy(a-b-):
- G 408 А (Trp 136 Stop) в гене Fya у англичанки (Rios и соавт. [139]);
- G 407 А (Trp 96 Stop) в гене Fyby ливанской еврейки (Rios и соавт. [139]);
- G 287 А (Trp 136 Stop) в гене Fyay индианки из Канады (Buchanan [23], Rios и соавт. [139]).
Tsuneyama и соавт. [165] наблюдали японку Fy(a-b-), без антител, имевшую делецию С327, которая приводила к остановке считывания 12 кодонов ниже 120-го.
Каждая из мутаций, описанных выше, проявляла себя отсутствием экспрессии антигенов Duffy на эритроцитах в отличие от GATA-мутаций, способствующих формированию африканского варианта фенотипа Fy(a-b-), при котором Duffy-гликопротеины экспрессированы на неэритроидных клетках.
Фенотип Fy(a-b-) без антител анти-Fy 3 описан у чешских цыганок (Libich и соавт. [94], Pisacka и соавт. [134]), белой женщины шотландско-швейцарского происхождения, имевшей GATA-мутацию, характерную для негроидов.
Фенотип Fyx проявляет себя наличием необычного антигена Fyb, который реагирует не со всеми образцами сывороток aHTH-Fyb. Специфических антител анти-Fyx не найдено. Это свидетельствует в пользу того, что антиген Fyx как самостоятельная единица не существует. Тем не менее признак Fy* наследуется кодоминантно, так же как Fya nFyb (Chown и соавт. [34, 35], Lewis и соавт. [92]).
Некоторые образцы сывороток анти-Fy3 реагируют слабо с эритроцитами FyaFyx (Chown и соавт. [35], Lewis и соавт. [92]). По адсорбции - элюции высокоактивных анти-Руь-антител можно отличить лиц, имеющих генотип Fyb/Fybот лиц, имеющих генотип Fyb/Fy*, однако более четкие результаты получают при использовании ПЦР (Murphy и соавт. [121]).
Фенотип Fyx [Fy(a+bw)] описывали главным образом у лиц белой расы, среди которых он встречается не столь редко. Среди 1108 обследованных 11 человек были Fy(a+bw), 1 Fy(a~b+W); частота гена Fyx составила 0,015 (Lewis и соавт. [92]).
Фенотип Fy* описан у индейцев Канады (Buchanan и соавт. [23]). Сообщалось о нескольких лицах, которые были гомозиготны по гену Fy*. Фенотип двоих при первичном тестировании был определен как Fy(a-b-) (Cedergren, Giles [25], Cook и соавт. [39], Habibi и соавт. [58], Lewis и соавт. [92], Parasol и соавт. [131]).
Помимо супрессии антигена Fyby гомозигот Fy*/Fy* заметно снижена выраженность других часто встречающихся антигенов Duffy: Fy3, Fy5 и Fy6 (Buchanan и соавт. [23], Habibi et al [58, 59], Mallinson и соавт. [99], Marsh [101], Olsson и соавт. [128], Tournamille и соавт. [162], Yazdanbakhsh и соавт. [183]). Подсчет антигенных участков Fy6 с помощью проточной цитофлюориметрии показал, что их количество на эритроцитах Fy(a-b+) составляет 2200-2400, на эритроцитах Fyx - от 150 до 250 (Tournamille и соавт. [162]). низкий уровень связывания антител анти-Руб, обусловленный геном Fy*, наблюдали Tournamille и соавт. [162], Yazdanbakhsh и соавт. [183], используя метод иммуноблоттинга. Авторы полагают, что в присутствии гена Fy* имеет место угнетение синтеза ликопротеина Fy, но не конформация его молекулярной структуры с образованием новой специфичности.
Гены Fya9 Fyb и Fy* имеют одинаковые кодирующие последовательности за исключением одной нуклеотидной замены (С 265 Т), приводящей к замещению Arg 89 Cys (Gassner и соавт. [53], Li и соавт. [93], Olsson и соавт. [128], Tournamille и соавт. [162]) (табл. 10.4). Указанная замена затрагивает первую экстрацеллюлярную петлю гликопротеина Fy (рис. 10.1).
Трехмерная модель Fy-гликопротеина по Mallinson и соавт. [99]. Экстрацеллюлярный домен содержит 3 участка N-гликозилирования. Черными кружками отмечены 5 цистеиновых остатков.
Клетки млекопитающих, подвергнутые трансфекции кДНК-Fy с искусственно встроенным кодоном цистеина в позиции 89, продуцировали меньшее количество субстанций Fyb, Fy3 и Fy6 по сравнению с клетками, подвергнутыми трансфекции кДНК нормальных генов Fya и Fy*, в которых вместо Arg в позиции 89 присутствует Lys (Tamasauskas и соавт. [155]).
Ген Fy* кодирует треонин в позиции Ala 100 Thr, а также имеет замену С 190 Т в интроне гена FY (Gassner и соавт. [53]). Эксперименты по направленному мутагенезу со встраиванием участков ДНК, кодирующих Ala 100 Thr, показали, что замены в этой позиции не влияют на экспрессию антигенов Duffy (Yazdanbakhsh и соавт. [183]).
Генная частота Fyx9 установленная по мутации Arg 89 Cys при обследовании 100 шведов и 300 австрийцев, соответствовала 0,025 и 0,015; при обследовании 100 южноафриканских негров ген Fy* не обнаружен (Gassner и соавт. [53], Olsson и соавт. [128]). Тем не менее, ген Fy*проявлял некоторые признаки гетерогенности. У одних индивидов, имеющих фенотип Fyx, последовательность, кодирующая антиген Fyb, не отличалась от нормы, у других наблюдали делецию на участке SP-1, расположенном выше стартовой точки считывания (Moulds и соавт. [117]).
Молекулярная основа
Секвестрование ДНК ретикулоцитов показало, что специфичность антигенов Fya и Fyb обусловлена заменой нуклеотидов в позиции 125, которая приводит к замене глицина на аспарагин в положении 42 гликопротеина Fy (Adams и соавт. [9], Chaudhuri и соавт. [29], Iwamoto и соавт. [79], Mallinson и соавт. [99], Tournamille и соавт. [164]) (табл. 10.4). Результаты этих исследований подтверждены трансфекцией соответствующих кодирующих ДНК-клонов в клетки линии COS-7 обезьян. В результате трансфекции указанные клетки начинали экс-прессировать антигены Fya и Fyb, что можно было выявить с помощью проточной цитофлюориметрии (Tournamille и соавт. [164]). Участок рестрикции алле-ля Fya обозначен Вап\.
Замена Ala 100 Thr в домене 2, обусловленная мутацией G 298 А, не влияла на специфичность антигенов.
Как показали Olsson и соавт. [128], у доноров шведов, имевших фенотип Fy(a-b+), гликопротеин Fy в позиции 100 содержал треонин. Среди доноров Fy(a+b-) лиц с аналогичным размещением треонина в гликопротеине Fy не обнаружено.
Таблица ЮЛ
Аллели, изменяющие экспрессию антигенов Duffy на эритроцитах
|
Аллели локуса Fy |
Нуклеотид в позиции 67 |
Нуклеотид в позиции 125, аминокислота в положении 42 |
Нуклеотид в позиции 265, аминокислота в положении 89 |
Нуклеотид в позиции 298, аминокислота в положении 100 |
|
Fya |
Т |
G |
С Аргинин |
G Алании |
|
Fyb |
Т |
А Аспарагин |
С Аргинин |
G или А Алании или треонин |
|
Fyx |
Т |
А Аспарагин |
Т Цистеин |
А Треонин |
|
|
С |
А Аспарагин |
С Аргинин |
G Алании |
Гликопротеин Fy, гомологичный на 99 % гликопротеину Fy человека, найден у шимпанзе. У обезьян Macacus rhesus, сурков и белок гомология составила 93-94 % (Chaudhuri и соавт. [29]). Все без исключения приматы имели ген, кодирующий в положении 42 аспарагин, из чего был следовал вывод, что аллель Fya в эволюции человека появился раньше (Chaudhuri и соавт. [29], Li и соавт. [93]).
Действие ферментов
Антигены Fya и Fyb разрушаются большинством протеолитических ферментов: папаином, фицином, бромелином, проназой и химотрипсином. Трипсин не влияет на указанные антигены (Judson, Anstee [83], Miller и соавт. [ПО], Morton [116]). Обработка эритроцитов сиалидазой также не сказывается на факторах Fya и Fyb. Ранние сообщения о влиянии трипсина на антигены системы Duffy были обусловлены, как полагают Daniels [43] и Issitt, Anstee [76], искажением результатов из-за примеси химотрипсина.
Хранение нативных эритроцитов в изотоническом растворе хлорида натрия при 12 °С в течение 2 недель приводит к частичой утрате антигенной активности факторов Fya, Fyb, Fy3 и других Fy-субстанций, специфически ингибирую-щих соответствующие антитела (Williams и соавт. [179]).
Антигены Fya и Fyb
Как уже указывалось выше, антитела анти-Fy3 были впервые обнаружены Cutbush и соавт. [40,41] в 1950 г. у больного гемофилией, получившего большое количество гемотрансфузии. Вновь открытый антиген был обозначен последними буквами фамилии больного, мистера Duffy, поскольку к тому времени буквы Du уже обозначали слабый антиген Du системы резус.
Через год, в 1951 г., Ikin и соавт. [73] описали антитела, открывавшие антитетичный антиген Fyb.
Race и соавт. [137] отметили, что некоторые образцы антител анти-Fy3, особенно агглютинины, проявляли отчетливый эффект дозы. Буквами Fyx Chown и соавт. [35] обозначили ген, кодирующий слабый вариант антигена Fyb.
Частота антигенов Fya и Fyb среди представителей разных рас и этнических групп неодинакова (табл. 10.2).
Таблица 10.2
Распределение фенотипов и генотипов Duffy у представителей разных рас*
|
Фенотип |
Генотип |
Частота (%) среди |
||
|
европеоидов |
негроидов |
монголоидов |
||
|
Fy(a+b-) |
Fy'/Fy" (Fya/Fy-) |
20 |
10 |
81 |
|
Fy(a+b+) |
Fy7Fy* |
48 |
3 . |
15 |
|
Fy(a-b+) |
Fyb/Fb (Fyb/Fy-) Щ |
32 |
20 |
4 |
|
Fy(a-b-) |
Fy~/Fy~ |
67 |
||
* по Mourant и соавт. [118].
Chown и соавт. [35], Lewis и соавт. 92] обследовали 2182 канадца с помощью сыворотки aHTH-Fyb5 выявляющей сильный и слабый варианты указанного антигена. Авторы установили, что частота генов Fya, Fyb и Fx составляет 0,425, 0,557 и 0,016, а частота фенотипов Fy(a+b~), Fy(a+b+) и Fy(a-b+w) - 0,1823, 0,4735 и 0,004 соответственно. Лиц Fy(a-b-) среди канадцев не обнаружено.
Среди жителей Северной Европы чаще встречался ген Fyb, чем Fya. Среди жителей Дальнего Востока, наоборот, аллель Fyb выявляли реже, чем Fya (Lewis и соавт. [91], Mourant и соавт. [118], Shimizu и соавт. [148]).
Частота генов FyanFyby негроидов оказалась более низкой по сравнению с европеоидами (табл. 10.2). Среди монголоидов частота антигена Fya превышает 96 %.
В табл. 10.3 приведены данные генотипирования европеоидов и негроидов, полученные Olsson и соавт. [127] с помощью ПЦР.
Частота фенотипов и генотипов Duffy у негров Южной Африки и шведов
|
Фенотип |
Генотип |
Частота генотипа (%) среди |
Аллель |
Частота аллеля (%) среди |
||
|
шведов (n=100) |
негров (п=100) |
шведов |
негров |
|||
|
Fy(a+b-) |
Fya/Fya |
21 |
Fya |
41 |
3 |
|
|
|
Fy°/Fy |
4 |
Fyb |
59 |
15,5 |
|
|
Fy(a+b+) |
Fya/Fyb |
40 |
2 |
Fy |
79,5 |
|
|
Fy(a-b+) |
Fyb/Fyb |
39 |
2 |
|
|
|
|
|
Fyb/fy |
|
29 |
|||
|
Fy(a-b-) |
Fy/FyljU |
63 |
||||
Гены Fya и Fyh наследуются кодоминантно. При обследовании членов 1091 семьи с помощью сывороток aHra-Fya и aHTH-Fyb ожидаемая и фактическая частота фенотипов Dufly совпала (Chown и соавт. [35], Lewis и соавт. [92]).
Среди 1445 обследованных жителей Москвы 1077 (74,84 %) были Руа-положительными, 368 (25,16 %) - Руа-отрицательными (Т.М. Пискунова [6]).



![Трехмерная модель Fy-гликопротеина по Mallinson и соавт. [99]. Экстрацеллюлярный домен со¬держит 3 участка N-гликозилирования. Черными круж¬ками отмечены 5 цистеиновых остатков](/images/stories/stat/a17.jpg)

