Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
В растворимой форме DAF содержится в секретах и других жидкостях организма, включая плазму крови и мочу (Medof и соавт. [61], Laird-Fryer и соавт. [43], Levene и соавт. [46], Sistonen и соавт. [89]).
Рядом исследователей установлена связь антигенов Cromer с DAF: антитела анти-Cromer (анти-Сга, -Тса, -Dra, -IFC, -WESa, -WESb и -UMC) взаимодействуют с этим фактором (Telen и соавт. [99], Parsons и соавт. [72], Daniels и соавт. [14, 21]). Локализацию антигенов Cromer на гликопротеине DAF подтвердили Petty и соавт. [73,74] в экспериментах со специфической иммобилизацией антител, а также Telen и соавт. [100, 101], Daniels и соавт. [19], которые показали, что фрагменты рекомби-нантного DAF ингибируют агглютинацию эритроцитов анти-Сготег-антителами.
Эритроциты больных пароксизмальной ночной гемоглобинурией (ПНГ) лишены GFI-ассоциированных протеинов, в том числе DAF, и не содержат антигенов Cromer (Nicholson-Weller и соавт. [-$7]).
Антигены и антитела Cromer
В систему Cromer включено 15 антигенов: 3 - редко встречающихся, 12 -часто встречающихся (табл. 21.1). Нулевой фенотип, получвший обозначение Inab, сочетается с наследственным дефицитом фактора деградации комплемента (Storry, Reid [93]). На эритроцитах Dra- антигены Cromer выражены слабо.
Антигенный полиморфизм системы обусловлен мутациями в различных точках гена DAF(Telen и соавт. [101], Lublin и соавт. [52, 54, 55], Udani и соавт. [104], Wang и соавт. [106], Daniels и соавт. [18]). Каждому антигену соответствует аминокислотная замена в той или иной позиции гликопротеина.
Антигены Cromer разрушаются а-химотрипсином, но устойчивы к действию трипсина, папаина и сиалидазы, по этим признакам их дифференцируют с антигенами других групповых систем (Daniels [15]). Обработка эритроцитов сульфидредуцентами - 2-аминоэтилизотиоурониумбромидом (АЕТ). Данный феномен представляется весьма необычным, поскольку домены полипептида Cromer имеют дисульфидные связи.
Таблица 21.1
Антигены системы Cromer
|
Обозначение |
Частота |
Связь с другими антигенами |
Молекулярная основа |
|
|
традиционное |
ISBT |
|||
|
Сга |
CROM1 |
T |
|
Ala 193 (Pro) |
|
Тса |
CROM2 |
t |
Антитетичен Тс и Тсс |
Arg 18 (Leu или Pro) |
|
Тсь |
CROM3 |
1 |
Антитетичен Тса и Тсс |
Leu 18 (Arg или Pro) |
|
Тсс |
CROM4 |
i |
Антитетичен Тса и Тсь |
Pro 18 (Arg или Leu) |
|
Dra |
CROM5 |
T |
У лиц Dr(a-) антигены CROM экспрессированы слабо |
Ser 165 (Leu) |
|
Esa |
CROM6 |
r |
|
He 46 (Asn) |
|
IFC |
CROM7 |
t |
|
Инактивирующая мутация |
|
WESa |
CROM8 |
1 |
Антитетичен WESb |
Arg 48 (Leu) |
|
WESb |
CROM9 |
t |
Антитетичен WESa |
Leu 48 (Arg) |
|
UMC |
CROM10 |
t |
|
Thr216(Met) |
|
GUTI |
CROM11 |
t |
|
Arg 206 His |
|
SERF |
CROM12 |
t |
|
Pro 182 Leu |
|
ZENA |
CROM13 |
t |
|
His 242 Gin |
|
CROV |
CROM14 |
T |
|
Glul56Lys |
|
CRAM |
CROM15 |
T |
|
Gin 247 Arg |
Примечание. Частота здесь и далее: | - высокая, | - низкая.
№ помощью метода задержки реакции агглютинации показано, что антиген-ные субстанции Cromer, присутствующие в растворенном виде в плазме, точно соответствуют имеющимся на эритроцитах
Расовые и этнические особенности фенотипов системы Cromer
|
Антиген |
Частота |
У кого обнаружен |
|
Сга |
t |
Cr(a-) у негров и 1 испанца |
|
Тса |
t |
Тс(а-) у европейцев и негров |
|
Тсь |
i |
У негров |
|
Тсс |
1 |
У европейцев |
|
Dra |
T |
Dr(a-) у узбекских евреев и японцев |
|
Esa |
t |
|
|
IFC |
t |
У 3 японцев, 2 итальянцев, 1 еврея |
|
WESa |
4 |
WES(a+) у финнов и негров |
|
WESb |
t |
WES(b-) у финнов и негров |
|
UMC |
T |
UMC- у японцев |
|
GUTI |
T |
GUTF- у индейцев мапуче |
|
SERF |
t |
SERF- у тайцев |
|
ZENA |
t |
|
|
CROV |
t |
CROV- у хорватов |
|
CRAM |
T |
|
Активность антител анти-Сга, -Тса, -Dra, -IFC и -UMC ингибировалась концентрированной мочой лиц, эритроциты которых содержали указанные антигены (Daniels и соавт. [14, 21]).
Распределение антигенов системы Cromer имеет расовые и этнические особенности (табл. 21.2).
Сга
В 1965 г. McCormick, Francis и Gelb [58] исследовали сыворотку беременной негритянки, миссис Cromer. Сыворотка реагировала с эритроцитами более чем 4000 доноров негров, но не реагировала с собственными эритроцитами и эритроцитами сестры. Поскольку обе женщины имели антиген Goa системы RH, авторы полагали, что обнаруженные ими антитела открывают новый часто встречающийся антиген - Gob, антитетичный редко встречающемуся антигену Goa. Однако вскоре выяснилось, что сыворотка миссис Cromer реагирует с эритроцитами , поэтому антитела не могут быть atfra-Gob и не относятся к системе резус.
Stroup и МсСгеагу [95], обнаружившие второй образец таких антител, обозначили их как анти-Сга и установили связь с антителами анти-Тса, относящимися к системе Cromer.
Позднее были найдены другие образцы антител анти-Сга (Smith и соавт. [90], Ross, McCall [84], Leatherbarrow и соавт. [45], Whitsett, Oxendine [107], Dickson и соавт. [23]). Все сенсибилизированные, за исключением одного, негры.
Winker и Hamilton [109] обследовали 8858 доноров негров в г. Детройте (США) и выявили только 2 с фенотипом Сг(а~). Посемейные исследования показали, что наследование гена Сгапроисходит в соответствии с законом Менделя [58,90,95].
Трансфекция яйцеклеток китайского хомячка образцами кДНК с делениями по четырем ККП-доменам полипептида DAF показала следующее. Лизаты всех клеток, за исключением тех, в которые была введена кДНК, дефицитная по ККП-4, реагировали с антителами анти-Сга. У лиц Сг(а-) в геномной ДНК имелась мутация G 679 С, ведущая к замене Pro 193 Ala в домене ККП-4 (Coyne и соавт. [12], Telen и соавт. [101]).
Антитела анти-Сга удавалось извлечь из сыворотки путем адсорбции как эритроцитами, так и тромбоцитами лиц, содержащих этот антиген (Sacks, Garratty [86], Judd и соавт. [38]).
Тс% Тсь, Тсс и ТсаТсь
Daniels и соавт. [22] нашли два образца антител, которые, так же как и анти-Сга-антитела, не реагировали с эритроцитами Inab. Они получили обозначение анти-Тса после обнаружения Laird-Fryer и соавт. [43] еще одного образца таких же антител.
При обследовании 950 доноров негров с использованием сыворотки анти-Тса был выявлен только один с фенотипом Тс(а-), все остальные были Тс(а+). Фенотип Тс(а-) отсутствовал у 5000 доноров европейцев и 5000 доноров японцев (Laird-Fryer и соавт. [43]).
Антитела анти-Тсь, найденные Lacey и соавт. [41], присутствовали в сыворотке одновременно с анти-Ооа-антителами (anra-Rh30). Они реагировали с эритроцитами 6 % американских негров, фенотип которых был соответственно Тс(Ь+). Среди европеоидов фенотип Тс(Ь+) не обнаружен. Все негроиды с фенотипом Тс(а-) имели группу Тс(Ь+). Посемейные исследования показали, что гены Тсаи Тсьявляются аллельными (Lacey и соавт. [41]). По результатам обследования 350 американских негров рассчитана частота генов Тс" (0,97) и Тсь (0,03), а также генотипов Тса/Тса(0,941), Тса/Тсь(0,058) и Тсb/Tcb(0,001).
На эритроцитах белой женщины и ее сестры, имевших фенотип Тс(а-Ь-), Law и соавт. [44] обнаружили редкий антиген, обозначенный Тсс. Таким образом, фенотип женщин в действительности соответствовал Тс(а-Ь-с+). Через 6 мес. после рождения ребенка у одной из женщин появились антитела анти-Тса,Тсь, которые не удалось разделить путем адсорбции эритроцитами Тс(а+Ь-) и Тс(а-Ь+). Антитела не реагировали с эритроцитами Тс(а-Ь-с+), но давали положительные реакции с эритроцитами Тс(а-Ь+с-) и Тс(а+Ь-с-).
Второй образец антител анти-Тса,Тсь выявили Bell и соавт. [4] у европейки, имевшей фенотип Тс(а-Ь-).
Эксперименты с трансфекцией клеточных линий показали, что эпитопы Тса несет домен ККП-4 DAF. Трансверсии G —► Т и G —> С в нуклеотиде 155, кодирующие замены Arg 18 Leu и Arg 18 Pro, приводили к экспрессии антигенов Тс и Тсс соответственно (Telen и соавт. [101], Udani и соавт. [104], Lublin и соавт. [52]).
Dra
Levene и соавт. [46, 47], Nakache и соавт. [66] выявили трех индивидов, узбекских евреев, содержавших антитела, получившие обозначение анти-Dr3. Соответственно указанные лица имели фенотип Dr(a-).
Лица Dr(a-), у которых имеются анти-Ога-антитела, найдены как среди узбекских евреев (Reid и соавт. [79]), так и среди японцев (Daniels и соавт. [18]) и русских (Lublin и соавт. [54], Reid и соавт. [82]).
Выявлены лица Dr(a-), у которых анти-Ога-антитела отсутствуют (Nakache и соавт. [66], Uchikawa и соавт. [103]).
Эритроциты Dr(a-) несут слабовыраженные антигены Cromer: их экспрессия составляет 40 % от обычной (Wang и соавт. [106]). При этом фактор DAF не претерпевает качественных изменений, они носят количественный характер (Lublin и соавт. [55], Daniels, Levene [20]).
Иногда эритроциты Dr(a-) ошибочно идентифицировали как Inab и относили к нулевому фенотипу (Lublin и соавт. [54], Reid и соавт. [82]).
Lublin и соавт. [52, 54] секвенировали геномную ДНК четырех неродственных лиц Dr(a-). У всех четырех обнаружена мутация С 596 Т в экзоне 5 гена DAF, сопровождавшаяся заменой серина на лейцин в домене ККП-3 протеина DAF. Эта мутация приводила к потере участка рестрикции Taql. Выявлены два DylF-транскрипта: полной длины, присутствовавший в небольшом количестве, и укороченный за счет делеции 44 нуклеотидов. Данная мутация изменяла рамку считывания с образованием стоп-кодона. Полипептиды, синтезируемые в результате трансляции больших транскриптов, включали лидер-пептид, 165 аминокислот двух первых ККП-доменов и половину третьего домена. Полипептиды DAF кодировались короткими транскриптами, что, по-видимому, обусловливало низкую экспрессию антигенов Cromer на эритроцитах Dr(a-).
WESaи WESb
WESa - редко встречающийся антиген, выявлен у 61 из 10 982 финнов (Sistonen и соавт. [89]), 2 из 1610 белых американцев и 7 из 1460 американских негров (Copeland и соавт. [11]), 5 из 245 негров - жителей Лондона (Daniels и соавт. [17]). Он отсутствовал у 210 обследованных бельгийцев, 747 поляков, 1073 венгров, 707 латышей, 500 японцев и 1026 жителей Сомали.
Антитетичным по отношению к редкому антигену WESa является широко распространенный антиген WESb. Выявлено два образца антител анти-WES15, оба у негритянок WES(a+b-) (Daniels и соавт. [17], Poole и соавт. [75]). Эксперименты с трансфекцией клеточных линий фрагментами кДНК гена
DAF показали, что антигенные эпитопы WESa и WESb расположены в ККП-1-домене гликопротеина DAF (Telen и соавт. [100]). Амплификация и секвенировашие экзона 2 гена DAFпозволили выявить точковую мутацию Т 245 G, ведущие к замене лейцина на аргинин в положении 48. Таким образом, антигенные различия WIS8/WESb обусловлены одной аминокислотной заменой.
Мышиные МКА против домена ККП-1 DAF блокировали связывание анти-рл анти-Тса, в то время как в отношении антител aHra-WESb оставались инерт-|цйми. Как полагают Petty и соавт. [74], проводившие эти эксперименты, эпигоны Тса и WESb расположены на разных участках домена ККП-1, что согласуется с молекулярной моделью, предложенной Kurtner-Kondo и соавт. [40].
Esa
Антиген Esa широко распространен. В связи с этим лиц Es(a-), способных вырабатывать анти-Еза-антитела, очень мало. Известно всего два образца антител aHTH-Esa. Первый обнаружен в 1984 г. Tregellas [102] у мексиканки, родители которой были двоюродными братом и сестрой. Два из трех сибсов про-банда также имели фенотип Es(a-), третий был Es(a+). Принадлежность анти-Еза-антител к системе Cromer подтверждалась тем, что сыворотка не реагировала с эритроцитами Inab (Cr ..).
Второй образец анти-Е8а-антител нашли в 1996 г. Reid и соавт. [83] у мужчины негра.
Другие лица Es(a-), за исключением 4 упомянутых выше, не выявлены. Из 3400 обследованных доноров все были Es(a+).
Отмечено (Daniels и соавт. [17]), что эритроциты Es(a-) слабее реагируют с aHTH-WESb-affnn^aMH, чем эритроциты Es(a+). Эритроциты WES(a+b-) в свою очередь реагируют с антителами анти-Es3, однако очень слабо, только при использовании метода адсорбции - элюции.
Репу и соавт. [73] установили, что эпитопы Esa расположены на домене ККП-1 гликопротеина DAF.
Секвенирование гена DAFупомянутого негра Es(a-) выявило его гомози-готность по мутации Т 239 А, кодирующей замену Не 46 Asn в домене ККП-1 (Lublin и соавт. [52]). Указанная аминокислотная последовательность расположена вблизи позиции Leu 48 Arg, которая обусловливает специфичность антигенов WESa и WESb. Этим, очевидно, объясняется перекрестное реагирование антигенов Esa и WESb с сыворотками aHra-WESb и анти-Es3 соответственно.
имс
Wang и соавт. [106] обнаружили у японки антитела с очень высокой частотой реагирования и обозначили их анти-UMC. Фенотип этой женщины соответствовал UMC -. Один из трех ее сибсов имел такой же фенотип. Рстальные из 45 610 японских доноров, обследованных сывороткой анти-UMC, были UMC+.
|£ помощью метода задержки реакции агглютинации рекомбинантными фрагментами DAF установлено, что анти-иМС-антитела распознают эпито-Щ ^положенные на домене ККП-4 (Daniels и соавт. [19]). В молекулярно-генетических исследованиях выявлена гомозиготность пробанда по мутации С 749 Т в экзоне 6 гена DAF, кодирующей Thr 216 Met.
GUTI
Антиген GUTI открыт в Чили в 2002 г. Storry и соавт. [94]. Антитела анти-GUTI присутствовали в сыворотке крови индейской женщины. Она и ее сестра имели фенотип GUTI-. Среди чилийских индейцев племени мапуче, к которому принадлежали эти женщины, 15 % были гетерозиготными по молчащему гену GUTI'. Экспрессия антигена GUTI была слабой на эритроцитах Dr(a-) (Reid, Lomas-Francis [81]). Молекулярно-генетические исследования показали, что у лиц GUTI- в домене ККП-4, в позиции 206, содержится гистидин, тогда как в полипептиде DAF дикого типа эту позицию занимает аргинин (Storry и соавт. [94]). Перемещение Arg 206 His было обусловлена нуклеотидной заменой G 719 А в экзоне 6 гена DAF.
SERF
Антиген SERF открыт в 2004 г. Banks и соавт. [3] с помощью антител, обнаруженных авторами в сыворотке крови женщины из Таиланда. У женщины имелась мутация С 647 Т в экзоне 5 гена DAF. Результатом последней являлась аминокислотная замена Pro 182 Leu в ККП-3-домене DAF. Сенсибилизированная женщина оказалась гомозиготной по указанной мутации.
Среди жителей Таиланда мутантный ген SERFвстречался с частотой 1,1 % (Palacajornsuk и соавт. [71]).
ZENA, CROVи CRAM
В 2005-2006 гг. появились сообщения об открытии сразу трех новых антигенов системы Cromer. Все они встречались с высокой частотой, идентифицировались специфическими аллоиммунными антителами, которые были выявлены у лиц, не содержавших эти антигены. Антитела к этим антигенам не реагировали с эритроцитами Inab. Молекулярно-генетические исследования показали, что все три пробанда были гомозиготными по мутациям в разных участках гена DAF(Daniels и соавт. [16], Ivankovik и соавт. [37], Hue-Roye и соавт. [33, 34]). Мутация His 242 Glu сочеталась с фенотипом ZENA, мутация Glu 156 Lis -с фенотипом CROV, мутация Glu 247 Arg - с фенотипом CRAM-.
Установлено, что антигенные эпитопы CROV содержатся в ККП-2-домене, в то время как участки антигенов ZENA и CRAM расположены в домене ККП-4 (Daniels и соавт. [16], Ivankovik и соавт. [37], Hue-Roye и соавт. [34]).
Лица CROV- были выявлены среди хорватов (Ivankovik и соавт. [37]).
Антитела анти-CRAM, присутствовавшие у сенсибилизированной женщины, в период беременности исчезли.
антиггигены ZENA, CROV и CRAM получили обозначения ISBT: CROM13, CROM14 и CROM15 соответственно (Daniels и соавт. [16], Hue-Roye и соавт. [33]).
Нулевой фенотип - Inab, характеризующийся отсутствием антигенов Cromer, встречается редко. Описаны 6 обладателей указанного фенотипа: 3 японца (Wang и соавт. [106], Daniels и соавт. [18, 22], Hue-Roye и соавт. [35]), американский еврей (Walthers и соавт. [105]), американка итальянского происхождения и ее брат (Lin и соавт. [48]).
У двух других лиц, первоначально отнесенных Reid и соавт. [82] и Holguin и соавт. [31] к группе Inab, позднее было выявлено небольшое количество вещества DAF (Lublin и соавт. [54]), один из них имел фенотип Dr(a-). Транзиторный фенотип Inab с наличием антител анти-IFC описан у пациента негра. Годом позже в эритроцитах этого мужчины обнаружено нормальное количество вещества DAF (Matthes и соавт. [57]).
Эритроциты Inab не реагировали с моноклональными мышиными и кроличьими антителами анти-DAF (Telen и соавт. [98, 99], Parsons и соавт. [72], Merry и соавт. [62]). В то же время комплементчувствительные эритроциты больных пароксизмальной ночной гемоглобинурией не реагировали с антителами анти-CROM (Telen и соавт. [99], Parsons и соавт. [72]).
Lublin и соавт. [54], секвенируя геномную и кодирующую ДНК одного из упомянутых выше японцев с фенотипом Inab, выявили носенс-мутацию в ко-доне 53 гена DAF, экзон 2. Кодон триптофана TGG был заменен на стоп-кодон TGA, в связи с чем в ККП-1-домене синтез полипептидной цепи в позиции 53 прекращался. Второй обладатель фенотипа Inab, также японец, оказался гомозиготным по указанной мутации; его родители были гетерозиготами (Daniels и соавт. [18]). У третьего японца фенотип Inab сочетался с трансверсией С 1579 А 24 нуклеотидов в области 3' экзона 2, которая инициировала новый участок сплайсинга (TGGTCAGA на TGgtaaga) и приводила к делеции внутри РНК-транскрипта, смещению рамки считывания с возникновением стоп-кодона в точке мутации (Wang и соавт. [106]). Соответственно трансляция прекращалась в области, кодирующей первые шесть аминокислот ККП-2. Имелась точковая мутация в геномной ДНК, приводящая к утрате участка сплайсинга Mbol.
Сыворотка крови 4 носителей фенотипа Inab содержала анти-ГРС-антитела, которые реагировали со всеми образцами эритроцитов за исключением собственных (Daniels и соавт. [18, 22], Walthers и соавт. [105], Lin и соавт. [48], Yazer [111]). Эксперименты с задержкой гемагтлютинации рекомбинантными фрагментами DAF показали, что анти-ШС-антитела являются смесью фракций, реагирующих с участками, находящимися на разных ККП-доменах.
Антитела со специфичностью анти-IFC были найдены в сыворотке крови больного 12-летнего негра (Daniels и соавт. [18]). Его эритроциты не были фе-нотипированы по системе Cromer, однако более вероятно, что он имел транзиторный фенотип Inab. Анти-ШС-антитела исчезли из сыворотки крови больного после того, как нормализовалось содержание вещества DAF на его эритроцитах Matthesи соавт. [57]).
У 3 из 6 лиц с истинным фенотипом Inab, а также упомянутого мальчика негра, имелась патология кишечника: энтеропатия, сопровождавшаяся потерей белка (Daniels и соавт. [18, 22]), болезнь Крона (Walthers и соавт. [105]), геман-гиома тонкой кишки (Daniels и соавт. [18]).
У остальных обладателей фенотипа Inab, среди которых была японка, 86-летня итальянка и ее 70-летний брат, никакой патологии не отмечено (Lin и соавт. [48], Wang и соавт. [106]).
В настоящее время получено несколько серий мышиных МКА к гликопроте-ину DAF, последние распознают эпитопы на всех четырех ККП-доменах (Spring и соавт. [91], Daniels и соавт. [19], Coyne и соавт. [12], Moulds, и соавт. [64]). В целом их специфичность подобна специфичности анти-ШС-антител: они не реагируют с эритроцитами Inab и дают слабоположительные реакции с эритроцитами Dr(a-) (Moulds и соавт. [64]).
Следует упомянуть два аспекта, привлекающие внимание исследователей к антигенам и антителам системы Cromer. Первый: антитела этой системы имеют прямое отношение к функции комплемента. Неясен и тем более интересен феномен их исчезновения во время беременности. Второй: у большинства антигенов отсутствуют антитетичные партнеры. Их следует искать на эритроцитах лиц, имеющих редкие фенотипы Cromer. Можно полагать, что в ближайшем будущем система Cromer пополниться новыми антигенами, характер распределения которых также может иметь этнические особенности.
Антитела системы Cromer представлены преимущественно классом IgG (Daniels [15]), встречаются анти-Сга-антитела IgM (Dickson и соавт. [23]). Большинство антител IgG относится к субклассу IgGl, однако описаны антитела, относящиеся к субклассам IgG2, IgG3 и IgG4 (Dickson и соавт. [23], Issitt, Anstee [36], Nakache и соавт. [66], Reid и соавт. [79, 80, 83], Sistonen и соавт. [89], McSwain, Robins [59], Anderson и соавт. [1], Byrne и соавт. [7]).
Антитела системы Cromer не имеют существенного значения в трансфузио-логии. Опубликованы сообщения о благополучных исходах трансфузий эритроцитов, несовместимых по антигенам этой системы, реципиентам, которые имели антитела анти-Сга (Smith и соавт. [90], Whitsett, Oxendine [107], Chapman и соавт. [9]) и анти-Тса (Hoffer и соавт. [30]).
Вместе с тем описаны постгрансфузионные реакции, причиной которых были антитела анти-Сга (Byrne и соавт. [7]) и анти-Тса (Kowalski и соавт. [39]). В последнем случае реципиенту перелили шесть доз эритроцитов Тс(а+), из которых первые три гемолизировались invivoв день проведения трансфузии.
Попытки оценить клиническое значение антител Cromer с помощью экспериментальных тестов invivoи invitroне дали однозначных результатов.
Smith и соавт. [90], Leatherbarrow и соавт. [45] и другие авторы [4, 9, 23, 66, 79, 84, 86, 107,] сделали вывод об отсутствии клинического значения антигенов и антител этой системы.
В других случаях были получены данные, свидетельствующие о способности антител Cromer уменьшать продолжительность циркуляции перелитых эритроцитов [1, 7,27, 38, 39, 43, 59, 79, 83,105].
При введении эритроцитов IFC+ реципиенту, имевшему анти-ШС-антитела, отмечалось следующее. В одном случае через сутки после инъекции в кровотоке сохранилось 38 % эритроцитов (Walthers и соавт. [105]), в другом случае наблюдали исчезновение IFC-несовместимых эритроцитов через 15 мин после введения (Daniels [15]).
Антитела анти-Тса IgGl, IgG2 и IgG4 проявляли себя как клинически значимые при испытании в монослое моноцитов. Через 2 года антитела того же лица содержали только IgG2 и IgG4 и не проявляли себя invitroкак клинически значимые (Anderson и соавт. [1]).
Трансплантация почки от донора Dr(a+) реципиенту Dr(a-), имевшему анти-Ога-антитела IgG2 и IgG4, была успешной: приживление трансплантата и его функционирование было нормальным, повышения титра анти-Ога-антител отмечено (Nakache и соавт. [66]).
Антитела системы Cromer не вызывали ГБН. Антигены Cromer присутствуют на трофобласте, который вследствие этого способен адсорбировать материнские антитела анти-Cromer (Holmes и соавт. [32]).
У 2 женщин с наступлением беременности титр антител анти-Сга снизился 11 :128 и 1 : 512 до 1 : 2 (Sacks, Garratty [86]). У других женщин высокоактивные антитела анти-Сга, анти-Dr3 и aHTH-WESb перестали выявляться со II и III триместра беременности; кратковременное их появление отмечалось после родов (Reid и соавт. [79], Poole и соавт. [75]). Описанный феномен можно объяснить тем, что плацента адсорбирует материнские антитела, тем самым защищая от них плод. В одном случае описана персистенция высокоактивных антител anti-Dra на протяжении двух беременностей, однако дети родились без признаков ГБН (Rahimi-Levene [78]).
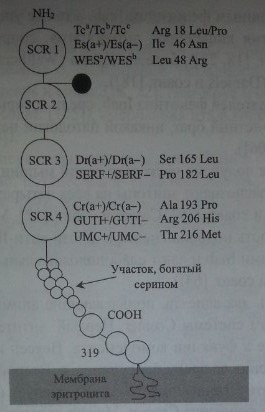
Фактор DAF, выделенный из эритроцитов, имеет мол. массу 70 кД, богат сиаловыми кислотами, имеет 15 участков О-гликозилирования и один участок N-гликозилирования (Lublin и соавт. [53]).
Caras и соавт. [8], Medof и соавт. [60]) показали, что кДНК гена DAF, выделенная из эпителиальной клеточной линии HeLa и линии HL-60 промиело-цитарного лейкоза, кодирует синтез полипептида, состоящего из 327 аминокислот. Полипептид DAF имеет четыре гомологичные области, включающие примерно по 60 аминокислот, которые получили название «короткие конценсусные повторы» (ККП). Далее следует О-гликозилированный участок из 70 аминокислот, богатый серином и треонином, и гидрофобный фрагмент, включающий 24 аминокислоты (рис. 21.1). Расшифрована аминокислотная последовательность DAF-гликопротеина (рис. 21.2).
Меньшая по величине кДНК гена DAFимела вставочную последовательность Aluиз 118 нуклеотидов (табл. 21.3), образовавшуюся в результате альтернативного сплайсинга (Caras и соавт. [8]).
Генный локус системы Cromer - DAF (CD55) - картирован на длинном плече хромосомы 1 в позиции lq32 (Post и соавт. [76]). Ген DAF имеет величину около 40 кб и представлен 11 экзонами (см. табл. 21.3).
Строение гликопротеина Cromer.
Организация гена DAF
|
Экзон |
Размер интрона, кб |
Положение аминокислот |
Кодируемый регион DAF |
Кодируемые антигены |
|
|
№ |
размер, ПН |
||||
|
1 |
|
0,5 |
-34--1 |
Участок 5' не транслируется, сигнальный пептид |
|
|
2 |
186 |
2,3 |
-1-62 |
ККП-1 |
Esa,WESa/WESb, CROV |
|
3 |
192 |
0,9 |
62 -126 |
ККП-2 |
|
|
4 |
100 |
1,0 |
126-159 |
ККП-3Д А |
Tca/Tcb/Tcc, CRAM |
|
5 |
86 |
4,3 |
159-188 |
ккп-зв |
Dra, SERF |
|
6 |
189 |
5,4 |
188-251 |
ККП-4 |
Cra, UMC, GUTI |
|
7 |
126 |
0,6 |
251-293 |
Область Ser/Thr. А |
|
|
8 |
81 |
1,9 |
293-320 |
Область Ser/ThrD |
|
|
9 |
21 |
1,2 |
320-327 |
Область Ser/Thrc |
|
|
10 |
118 |
19,8 |
(327-366) |
Alu (альтернативный сплайсинг) |
|
|
И |
956 |
|
327-347 |
Гидрофобный участок, 3 не транслируется |
|
Аминокислотная последовательность DAF
Фактор DAF предохраняет эритроциты, лимфоциты, тромбоциты и соматические клетки от повреждения собственным комплементом. Он блокирует связывание компонентов С4Ь2а и СЗЬВЬ, ускоряет диссоциацию СЗ-конвертазы при активации комплемента по классическому и альтернативному пути (Coyneet и соавт. [12]).
Фактор DAF, содержащийся в эпителиальных клетках трофобласта, защищает плод от проникновения в его организм комплемента из крови матери (Holmes и соавт. [32]).
Белок CD59 - мембранный ингибитор реактивного лизиса (MIRL), также относится к гликопротеинам, регулирующим функцию комплемента. Он принадлежит семейству Ly-б, ингибирует связывание компонентов С8 и С9 и тем самым предотвращает образование комплекса, разрывающего оболочку клетки. CD59 присутствует на мембране эритроцитов, но не несет групповых антигенов.
CD59 гликозилирован в позиции Asn 18, его мол. масса около 18 кДа. Так же как и DAF, CD59 соединен с мембраной эритроцита GPI-якорем - глико-зилфосфатидилинозитолом (Fletcher и соавт. [25], Telen [97], Rosse, Ware [85], Lachmann [42]). Ген CD59 картирован на хромосоме 11.
Пароксизмальная ночная гемоглобинурия (ПНГ), характеризующаяся вну-трисосудистым гемолизом, обусловлена Х-сцепленным геном PIG-А. Мутации в этом локусе нарушают синтез GPI-ассоциированных протеинов, что приводит к дефициту CD59 и DAF на поверхности мембраны клеток (Rosse, Ware [85], Takeda и соавт. [96], Bessler и соавт. [6]).
У больных ПНГ концентрация CD59 и DAF на эритроцитах снижена (Nicholson- Weller и соавт. [67]), вследствие чего они не могут противостоять лизису под действием собственного комплемента непосредственно в кровяном русле. ^!$f$epecHO отметить, что эритроциты Inab, несмотря на дефицит фактора ^^щцодвержены внутрисосудистому гемолизу. Ни у одного из 6 индивидов с фенотипом никаких проявлений внутрисосуцистого гемолиза не отмече-Ш(ШЩ и соавт. [106], Daniels и соавт. [18], Telen и соавт. [98], Merry и соавт. [62]). В отличие от эритроцитов больных ПНГ, эритроциты Inab не лизировались подкисленной аллогенной сывороткой после обработки ядом кобры. Однако они в большей степени, чем нормальные эритроциты, были подвержены гемолизу Холодовыми антителами в растворе сахарозы (Telen и соавт. [98], Merry и соавт. [62]).
Прямая проба (эритроциты Inab + антиглобулиновая сыворотка с антителами к С3-компоненту комплемента) дала отрицательный результат. Эритроциты Inab, таким образом, не содержали на своей поверхности С3-компонента комплемента, что свидетельствоввало также об отсутствии на таких эритроцитах ингибитора СЗ-конвертазы (Telen и соавт. [98], Merry и соавт. [62]).
Когда CD59 блокировали МКА анти-СЭ59, эритроциты Inab лизировались подкисленной аллогенной сывороткой (Daniels и соавт. [18], Holguin и соавт. [31]). В тестах на реактивный лизис эритроцитов, обработанных МКА к CD55 и CD59, эффект наблюдали при использовании анти-С059антител (Yuan и соавт. [112]).
Полученные результаты свидетельствуют о том, что гликопротеины DAF и CD59 выполняют функцию защиты клеток от собственного комплемента, при этом вклад CD59 выше, чем DAF.
У больного, гомозиготного по делеции одного из нуклеотидов в гене CD59, концентрация гликопротеина CD59 была низкая, DAF - нормальная, при этом наблюдали синдром, напоминавший ПНГ (Yamashina и соавт. [110], Motoyama и соавт. [63}).
При определении чувствительности эритроцитов к комплементзависимому лизису получены следующие результаты (в порядке возрастания): дефицитные по DAF эритроциты Inab имели 4,6 ед., СВ59-дефицитные эритроциты -11,7 ед., дефицитные одновременно по DAF и CD59 - 47,6 ед. (Shichishima и соавт. [88]).
Наряду с защитой клеточных элементов крови от комплементопосредован-ного лизиса CD59 выполняет и другую биологическую функцию: препятствует проникновению в эритроциты малярийного плазмодия Plasmodiumfalciparumи тем самым обеспечивает невосприимчивость к малярии (Wiesner и соавт. [108]).
Фактор DAF принимает участие в межклеточных взаимодействиях, являясь лигандом CD97, который представлен в мембране клеток семью доменами (Hamann и соавт. [28]).
Подобно антигену Р, DAF выступает в качестве рецептора для уропатоген-ных штаммов Escherichiacoli, обусловливает предрасположенность к инфицированию этими бактериями эпителиальных клеток мочевыводящих путей (Moulds и соавт. [65]). Лизаты Escherichiacoliвызывали агглютинацию всех образцов эритроцитов, несущих антигены Cromer, эритроциты Dr(a-) и Inab они не агглютинировали (Nowicki и соавт. [69]). Бактериальные антитела, связывающиеся с антигеном Dra, получили название Dr-адгезины. Очищенные Dr-ЭЙраины, так же как и лизаты Escherichiacoli, связывались с яйцеклетками ки-"^йскогр^хомячка, которые были подвергнуты трансфекции нормальной кДНК г^& Шчедгезины не реагировали с интактными яйцеклетками и яйцеклетками, подвернутыми трансфекции кДНК DAF, кодирующей Ser 165 Leu [характеристика фенотипа Dr(a-)] (Nowicki и соавт. [68]).
Nowicki и соавт. [70], Lublin [50] применили Dr-адгезины, выделенные из ре-комбинантных штаммов бактерий, в качестве тест-реагента в иммунофлюорес-центном методе исследования и показали, что лиганд DAF представлен на поверхности эпителия всех типов. В наибольших концентрациях он присутствовал в эпителии почечных канальцев и клубочков.
DAF является лигандом для эховирусов, вируса Коксаки и многих других (Evans и соавт. [24]). Некоторые разновидности эховируса агглютинируют эритроциты (Goldneld и соавт. [26]). Эксперименты по связыванию эховируса с трансфектированными яйцеклетками китайского хомячка показали, что присоединение его к клетке происходит в том случае, если на ее поверхности присутствуют домены DAF: ККП-2, ККП-3 и ККП-4 (Clarkcon и соавт. [10]). МКА к ККП-3 блокировали связывание эховирусов с рецепторами клеток (Clarkcon и соавт. [10], Bergelson и соавт. [5]).
На мембране эритроцитов, помимо DAF, присутствуют другие протеины, связанные с клеткой посредством GPI-якоря. Некоторые из них несут групповые антигены систем Cartwright, Dombrock, JMH, а также антиген Emm. Лиганд LFA-3 (CD58) присутствует на мембране эритроцитов, не будучи ассоциирова-ным с групповыми антигенами. Большинство молекул LFA-3 связано с мембраной эритроцита через GPI-якорь, некоторая их часть расположена в трансмембранной и внутриклеточной зоне клетки. Лиганд LFA-3 выполняет функцию молекул межклеточной адгезии и участвует в активации Т-клеток через связывание с лигандом CD2 (Springer и соавт. [92], Anstee и соавт. [2]).
Еще один белок, участвующий в регуляции активности комплемента, получил обозначение С8-связывающий протеин (Schonemark и соавт. [87]). Он отсутствует на эритроцитах больных ПНГ и, очевидно, связан с мембраной эритроцитов посредством того же GPI-якоря (Hansch и соавт. [29]).
Прионовые протеины РгРс также являются GPI-ассоциированными, они присутствуют на клетках различных тканей организма. Изоформа указанных протеинов, обозначенная как PrPSc, способна вызывать губчатую энцефалопатию - болезнь Крейтцфельдта-Якоба (Prusiner [77]). Лиганд РгРс присутствует в небольших количествах на эритроцитах здоровых людей, на эритроцитах больных некоторыми формами ПНГ он отсутствует.