Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Антигены системы Kell (Келл) (табл. 5.1) разделяют на 4 группы.
1-я группа - 11 антигенов, объединенных в 5 подгрупп: Кик; Кра, Крь и Крс; Jsa и Jsb; Kll (Cote) и К17 (Wka); К14 (San) и К24 (Cls). Аллельная взаимосвязь генов внутри подгрупп четко установлена.
2-я группа - 7 часто встречающихся антигенов: К12 (Вое), К13, L18, К19 (Sub), К22, TOU и RAZ, не имеющих антитетичных партнеров.
3-я группа - 3 редко встречающихся антигена: Ula, К23 и VLAN, молекулярная основа которых расшифрована и представляет собой простые аминокислотные замены.
4-я группа - 3 часто встречающихся антигена: Ku, k-like и Km. Молекулярная основа этих антигенов не ясна. Для того чтобы установить аминокислотную последовательность, обусловливающую их специфичность, необходимо сравнить два Kell-полипептида: содержащий и не содержащий указанные антигены. Однако лица, лишенные этих антигенов, практически не встречаются.
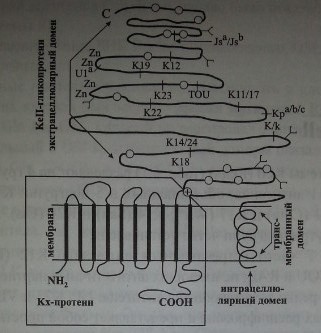
Kell-фенотип зависит от двух различных генных локусов. Синтез антигенного вещества Kell осуществляет локус KEL, который расположен на хромосоме 7. Экспрессию антигенов Kell контролирует другой локус -ХК, находящийся на Х-хромосоме. Ген ХК продуцирует Кх-протеин, который является подложкой и одновременно составной частью Kell-гликопротеина (рис. 5.1).
Локус KEL в отличие от локусов D и СЕ системы резус более компактен. Кроссинговер в нем не наблюдается, генные конверсии редки. Один гаплотип KEL продуцирует несколько часто встречающихся (общих для всех людей) Kell-антигенов, но не более одного редко встречающегося.
Антигены Kell расположены на Kell-гликопротеине (трансмембранном гликопротеине CD238), имеющем мол. массу 93 кДа. Основная часть Kell-антигенов размещается в экстрацеллюлярной части Kell-гликопротеина (см. рис. 5.1), что, по-видимому, и делает его столь иммуногенным.
Гликопротеины Kell относятся к цинксодержащим металлопротеинам. Они обладают свойствами эндопептидаз и имеют некоторое сходство с так называемым общим антигеном острого лимфобластного лейкоза.
Молекулярный субстрат большинства Kell-антигенов известен. Их серологический полиморфизм обусловлен простыми аминокислотными заменами в Kell-гликопротеине
Система Kell тесно связана с двумя другими независимыми системами - Кх и Gerbich. От последних зависит степень выраженности антигенов Kell на поверхности клетки.
Описаны редкие фенотипы, в которых большинство Kell-антигенов слабо выражены или отсутствуют (фенотипы McLeod, Kmod, транзиторный К+ или К-, Ко). Исключение представляет антиген Ки, который присутствует на всех эритроцитах, в том числе на Kell-дефицитных и Ко.
Отсутствие Kell-антигенов и ослабленная их экспрессия могут быть обусловлены несколькими причинами: 1 - гомозиготностью по молчащему гену КЕЬ-локуса; 2 - эпистатическим подавлением KEL-локуса - эпистазией генов Gerbich; 3 - блокадой антигенных участков Kell-гликопротеина аутоантитела-ми (транзиторный К-) или бактериальной модификацией (транзиторный К+); 4 - нарушением синтеза Кх-протеина и другими, не вполне ясными причинами. Дефицитные Kell-фенотипы передаются по наследству (Kmod, McLeod), но, по-видимому, могут формироваться и как следствие соматических мутаций.
Наибольшей иммуногенностью обладает фактор К (синонимы: Kell, KEL1, К1). Его определение регламентировано нормативными документами [54, 55] и является функциональной обязанностью иммуносерологов службы крови.
Антигены Kell представляют также интерес для антропологов [13] и судебных медиков [3].
Антигены системы KEL
|
Обозначение |
Частота среди европеоидов, % |
Молекулярная основа |
Год открытия [источник] |
||
|
авторское |
традиционное |
ISBT |
|||
|
Kelleher (Kell) |
К |
KEL1 |
9 |
Met 193 Thr |
1946[133] |
|
Cellano |
k |
KEL2 |
99,8 |
Thr 193 Met |
1949 [249] |
|
Penney |
Kpa |
KEL3 |
2,3 |
Trp281Arg/Gln |
1957[87] |
|
Rautenberg |
Kpb |
KEL4 |
>99,9 |
Arg281Trp/Gln |
1958 [88] |
|
Peltz (K) |
Ku |
KEL5 |
>99,9 |
He установлена |
1961 [134] |
|
Sutter |
Jsa |
KEL6 |
l;y негров 19,5 |
Pro 597 Leu |
1959[176] |
|
Mattews |
Jsb |
KEL7 |
>99,9 |
Leu 597 Pro |
1963 [183] |
|
|
Kw |
KEL8* |
5,0 |
|
1965 [106] |
|
Claas |
KL |
KEL9* |
99,0 |
|
1968 [379] |
|
Karhula |
Ula |
KEL10 |
<0,1; у финнов 2,6 |
Val 494 Glu |
1968 [169] |
|
Cote |
|
KEL11 |
>99,9 |
Val302Ala |
1976 [185] |
|
Bockman |
Boc |
KEL12** |
>99,9 |
His 548 Arg |
1973 [272] |
|
Sgro |
|
KEL13** |
>99,9 |
He установлена |
1 1974[262] |
|
Santini |
San |
KEL14 |
>99,9 |
Arg 180 Pro/His/Cys |
1973 [195] |
|
|
К |
KEL15* |
>99,9 |
He установлена |
1971[273] |
|
|
k-like |
KEL16 |
99,8 |
He установлена |
1975 [267] |
|
Weeks |
Wka |
KEL17 |
0,3 |
Ala 302 Val |
1974[356] |
|
Marshall |
|
KEL18** |
>99,9 |
Arg 130 Trh/Gln |
1975 [98] |
|
Sublett |
|
KEL19** |
>99,9 |
Arg 492 Gin |
1979 [234] |
|
|
Km |
KEL20 |
>99,9 |
He установлена |
1968 [377] |
|
Levay |
Kpc |
KEL21 |
<0,1 |
Gln281Arg/Trp |
1979 [403] |
|
Ikar |
|
KEL22** |
>99,9 |
Ala 322 Val |
1982 [96] |
|
|
|
KEL23** |
<0,1 |
Arg 382 Gin |
1987 [270] |
|
|
Cls |
KEL24 |
2,0 |
Pro 180 Arg |
1985 [160] |
|
|
VLAN |
KEL25 |
<0,1 |
Arg 248 Gin |
1996 [215] |
|
|
TOU |
KEL26 |
>99,9 |
Arg 406 Gin |
1995 [213] |
|
|
RAZ |
KEL27 |
>99,9 |
Glu 299 Lys |
1994 [148] |
|
|
VONG |
KEL28 |
|
|
2003 [*] |
|
|
KALT |
KEL29 |
|
|
2006 [*] |
|
Обозначение |
Частота среди европеоидов, % |
Молекулярная основа |
Год открытия [источник] |
||
|
авторское |
традиционное |
ISBT |
|||
|
|
KTIM |
KEL 30 |
|
|
2006 [*] |
|
|
KYO |
KEL31 |
|
|
2006 [*] |
|
|
KUCI |
KEL32 |
>99,9 |
|
2007 [*] |
|
|
KANT |
KEL33 |
>99,9 |
|
2007 [*] |
|
|
KASH |
KEL34 |
>99,9 |
|
2007 [*] |
|
KEL- дефицитные фенотипы |
IT о (null) |
|
|
|
1957 [125] |
|
McLeod |
|
Очень редко |
|
1961 [86] |
|
|
Leach |
|
|
|
1985 [204] |
|
|
Mullins |
|
|
|
1988 [308] |
|
|
Allen |
|
|
|
1993 [147] |
|
|
mod |
|
|
|
1995 [322] |
|
|
Транзиторный 1 K+/K" |
|
Редко |
К- стали К+ К+ стали К- |
[278] [344,380,397] |
|
*Kell-антигены, исключенные из системы Kell,
** Антигены napa-KEL
До 1961 г. было принято буквенное обозначение антигенов Kell: К, к, Кра, Kpb, JsaH т. д. В 1961 г. Allen и Rosenfield [89] предложили буквенно-цифровое обозначение: К1 (К), К2 (к), КЗ (Кра), К4 (Крь) и т. д., которое было положено в основу международной классификации.
Щ В соответствии с рекомендациями номенклатурного комитета Международного общества трансфузиологов - International Society of Blood Transfision (ISBT) с 1985 г. для обозначения указанной системы принят символ KEL.
По классификации ISBT каждой системе антигенов эритроцитов присвоен трехзначный код, каждому антигену - трехзначный номер, например: системе АВО - 001, антигену А - 001001, В - 001002, MNSs - 002, Rh-Hr - 004, Lutheran - 005 и далее в хронологическом порядке их открытия. Системе антигенов KEL присвоен код 006. Антиген К обозначается как 006001, антиген к -006002, антигены Пенни и Раутенберг соответственно 006003 и 006004 и т. д. В повседневной практической работе чаще используют буквенное (К, к, Кра, Крь) или буквенно-цифровое (Kl, К2, КЗ, К4) обозначение (см. табл. 5.1).
Некоторые антигены после уточнения переведены в другие антигенные системы. Так, антигены Kw, KL, Кх, причисленные сначала к системе KEL, из нее цдаедены, поскольку относятся к другим антигенным системам.
о правилам ISBT при перемещении антигена из одной системы в другую или исключении из номенклатуры его порядковый номер остается свободным и не используется для обозначения каких-либо других антигенов. В связи с этим в номенклатуре системы KEL имеются пропуски - номера 008, 009, 015, первоначально присвоенные антигенам Kw, KL и Кх соответственно.
Аргументы в пользу шестизначного обозначения ISBT, пригодного для компьютерной обработки, неоспоримы, однако традиционное обозначение более удобно и информативно для большинства иммуносерологов. Антитетическая связь между антигенами более наглядна при обозначении Кик, Кра и Kpb, Jsa и Jsb, чем К1 и К2, КЗ и К4, Кб и К7.
Кик
В 1945 г., вскоре после открытия резус-фактора, англичане Coombs, Mourant и Race [132] разработали антиглобулиновую пробу, получившую название пробы Кумбса. Фактор Kell (К) был одним из первых антигенов, открытых с помощью этого метода.
Анализируя причину желтухи у новорожденного одной из родильниц (миссис Kelleher), Coombs, Mourant и Race [133] обнаружили необычные антитела, которые нельзя было отнести к системе резус. Сыворотка крови г-жи Kelleher реагировала с эритроцитами мужа и ребенка, а также эритроцитами примерно 7 % произвольно взятых лиц независимо от их групповой- и резус-принадлежности. Новый фактор эритроцитов получил название Kell (К) - по фамилии носительницы антител.
Позднее антитела такой же специфичности выявили Wiener, Sonn-Gordon [396] в сыворотке крови больных, перенесших гемотрансфузионные осложнения.
В настоящее время обнаружение анти-К-антител не является редкостью. Антиген К - сильный иммуноген, и даже одна трансфузия эритроцитов, одна беременность или один аборт могут вызвать аллоиммунизацию [7, 21, 79]. По иммуногенности фактор К стоит на втором месте после D. Частота анти-Kell-антител среди аллоиммунизированных составляет более 5 %, что еще раз подчеркивает значение фактора К в трансфузиологии и необходимость типирова-ния доноров и реципиентов по этому антигену [20,21, 23,24].
Спустя 3 года после открытия Kell-фактора Levin и соавт. [249] обнаружили антитела, агглютинирующие эритроциты 99,8 % лиц, и установили антитетичную связь определяемого с их помощью антигена с антигеном Kell. Второй антиген был назван Cellano (к) (в русской транскрипции Челлано) также по фамилии женщины, в крови которой были выявлены антитела. Аллельность генов К и к подтверждена популяционными и посемейными исследованиями [250, 251, 318, 339]: Кик являются продуктом кодоминантных аллелей. Лица, не содержащие антигена К, всегда содержат к и, наоборот, лица, не имеющие к, содержат К. Оба антигена могут присутствовать на эритроцитах вместе 1 фенотип Кк. Отсутствие обоих антигенов (фенотип Ко) встречается редко и, как правило, сочетается с патологией (см. Ко). Как указано выше, антиген К имеет обозначение ISBT KEL1, антиген к обозначают как KEL2.
Кра и Крь
Третий антиген системы Kell, Пенни (Penney), получивший обозначение Кра, описали в 1957 г. Allen и Lewis [87]. Те же авторы совместно с Fudenberg [88] обнаружили аллельный фактор Раутенберг (Rautenberg), обозначенный соответственно Крь.
Открытие антигенов Кра и Крь изменило представление о том, что Kell является простой диаллельной системой, включающей только 2 антигена, Кик, а представляет собой полиаллельную систему. Антигену Кра присвоено обозначение ISBT KEL3, антигену Kpb-KEL4. rf
Гены Кра и Крb имеют своеобразное сцепление с генами k и К. Они передаются по наследству в виде одного из трех комплексов: kKpa, kKpbили ККрь, но не ККра [141, 154, 252, 318, 402]. Комплекс ККра формируется при наследовании гена К от одного родителя, а гена Кра - от другого. Иными словами, фенотип К+Кр(а+) соответствует положению генов К транс Кра. Одновременная передача потомству К и Кра от одного родителя (К цыс Кра) до настоящего времени не выявлена, несмотря на большое количество обследованных семей. Таким образом, антиген К наследуется всегда с антигеном Крь (К цыс Кръ\ а антиген Кра - всегда с антигеном к {Кра цыс к).
Ген Кр "подавляет активность других генов KEL, расположенных в позиции цис (см. Кра-эффект).
Частота антигена Кра составляет 2,3 %, антигена Крь - 99,9 % [55, 87, 141,318] (см. табл. 5.1, 5.7, 5.8).
Антиген Крь, по-видимому, более иммуногенен, чем Кра. Об этом свидетельствует следующий расчет: на 0,1 % реципиентов Кр(Ь-) приходится 99,9 % доноров Кр(Ь+), а на 2,3 % реципиентов Кр(а-) - 97,7 % доноров Кр(а+). Вероятность аллоиммунизации реципиента (или беременной) антигеном Крав 23 раза выше, чем антигеном Крь. В то же время антитела анти-Кра встречаются не намного чаще, чем анти-Крь.
Крс
Антиген Крс впервые был описан в 1945-1946 гг. Callender, Race и Paykoc [117, 118] в одной английской семье. В то время этот антиген именовали Levay в соответствии с сывороткой анти-Levay, с помощью которой он был обнаружен. Только 34 года спустя, в 1979 г., Yamaguchi с соавт. [403] и Gavin с соавт. [173] установили, что антиген Levay и антиген Крс представляют собой идентичную специфичность. Авторы нашли донора, японку, эритроциты которой Кр(а-Ь-) реагировали с сывороткой, содержащей aHTH-Levay-антитела, т. е. были Кр(а-Ь-с+). При исследовании семьи пробанда ими было установлено, что антиген Levay (Крс) относится к системе Kell и является продуктом гена Кре9 третьего аллеля сублокуса Кр.
Антиген Крс относят к редким - его частота составляет 0,23 % [225] (см. табл. 5.1). единичные гомозиготы Крс/Крс, описанные Daniels [57] среди японцев, ыли выявлены в результате идентификации анти-Крь-антител, содержащихся в их сыворотках.
Kikuchi и соавт. [225] нашли 2 членов одной японской семьи, которые имели фенотип Кр(а-Ь-с+) и являлись гомозиготными по гену Крс и гену К.
Антиген Крс (Levay) был обнаружен, как указывалось выше, среди англичан [117,118] и у 1 испано-американца Кр(а+Ь-с+), имевшего анти-Крь-антитела.
Lee и соавт. [241] установили, что специфичность антигенов Кра, Крь и Кр° обусловлена простыми нуклеотидными заменами в кодоне 281 экзона 8 (см. табл. 5.1). Антиген Кра инициирован триплетом TGG, кодирующим триптофан. Триплет CGG, кодирует аргинин, что соответствует антигену Крь. Триплет CAG, кодирующий глютамин, обусловливает специфичность Крс.
В экспериментах с сайтнаправленным мутагенезом Yazdanbakhsh и соавт. [404] подтвердили, что отличие Кра и Крь обусловлено именно указанной заменой-Тгр 281 Arg.
Мутации КраяКрс являются весьма информативными и могут быть использованы при генотипировании с помощью ПЦР [150,241].
JsanJsb
Антиген Sutter (Саттер) - Jsa, описали в 1958 г. Giblett [175] и годом позже Giblett и Chase [176] у американских негров, проживающих в Сиэтле (США). Антитела airra-Jsa авторы обнаружили у белого американца (мистера Sutter), получившего переливание эритроцитов, как теперь очевидно, от донора негра.
Антиген Jsa практически не встречается у европейцев - все они, за крайне редким исключением, ^-отрицательные (Mourant и соавт. [290]). Антиген Jsaбыл обнаружен лишь у одного белого европейца [318] и в одной арабской семье, живущей в Израиле (Levene и соавт. [246]). У японцев антиген Jsa не найден (Ito и соавт. [209]). Носителями антигена Jsa являются исключительно негры, среди которых около 16 % имеют группу Js(a+) [176,212, 352].
Через 5 лет после открытия антигена Jsa Walker и соавт. [386,387] обнаружили антитетичный антиген Jsb, который оказался в противоположность антигену Jsa часто встречающимся и присутствовал на эритроцитах большинства доноров, как негров, так и белых. Антитела aHra-Jsb были найдены авторами в сыворотке негритянской женщины, по-видимому, гомозиготной по Jsa {Jsa/Jsa\ поскольку она была Js(a+); 4 ее детей, 2 сестры и 10 их детей также были Js(a+). При исследовании сыворотки женщины с эритроцитами 1269 доноров негров Walker и соавт. [387] нашли 13 образцов, давших отрицательный результат. Исследование этих 13 образцов сывороткой анти-Js8 показало, что 12 из них содержат антиген Jsa. Иными словами, почти все лица Js(b-) оказались Js(a+), что указывало на аллельные отношения генов Jsa и Js*,#
Из 10 848 американских негров, тестированных Beattie и соавт. [100] с помощью сыворотки анти-^рголько 34 (0,31 %) были Js(b-). Лиц с фенотипом Js(a+b~) среди европеоидов и монголоидов не обнаружено.
Первое время после открытия антигена Jsa, а затем Jsb считали, что они представляют собой новую систему, независимую от ранее открытых. Установлено, что антигены Jsa и Jsb не связаны с системой ABO, Rh-Hr, Р, Lutheran и др. Недоказанной оставалась лишь возможная связь Jsa и Jsb с системой Kell. Трудность заключалась в том, что антиген Jsa в сочетании с антигеном К встречается крайне редко (Jsa практически отсутствует у белых, К редко выявляли у негров,) и проследить характер их наследования на примере одной семьи длительное время не представлялось возможным.
Первые данные о том, что Jsa и Jsb могут относиться к системе Kell, получили Stroup и соавт. [357]. Авторы показали, что клетки Ко, лишенные антигенов К и к, не содержат также Jsan Jsb, т. е. являются Js(a-b-). Далее было установлено, что фенотип McLeod и другие Kell-дефицитные фенотипы наряду с подавленной продукцией антигенов Kell характеризуются слабой экспрессией антигенов JsaH Jsb, что также послужило основанием считать гены JsanJsb частью локуса KEL.
Обследование около 4000 доноров негров позволило выявить 6 человек с редким фенотипом K+Js(a+), а последующие семейные исследования подтвердили, что антигены Jsa и Jsb контролируются локусом KEL (Morton и соавт. [288]).
Принадлежность к той или иной группе по антигенам Js обусловлена 2 ну-клеотидными заменами в экзоне 17 локуса KEL, кодирующими соответствующую аминокислотную последовательность.
По данным Lee и соавт. [240], антиген Jsa ассоциирован с замещением С 1910, кодирующим Pro в позиции 597 и замещением G 2019, кодирующим Leu в позиции 633; антиген Jsb ассоциирован с замещением Т 1910, кодирующим Leu в позиции 633.
Yazdanbakhsh и соавт. [404], используя сайтнаправленный мутагенез, подтвердили, что -^/.^-полиморфизм обусловлен заменой С 1910 Т.
Антиген Jsa получил индекс ISBT KEL6, антиген Jsb - KEL7.
К11 и К17 (Cote и Wka) Cote(Kll)
Guevin и соавт. [186] в 1971 г. и затем в 1976 г. [185] исследовали сыворотку крови француженки из Канады миссис Cote. Сыворотка реагировала с эритроцитами всех фенотипов, за исключением собственных эритроцитов женщины и 2 из 8 ее сибсов. Тот факт, что антитела Cote-сыворотки, как обозначили ее авторы, не взаимодействовали с эритроцитами Ко, указывал на принадлежность выявляемого с их помощью антигена к системе Kell. Эритроциты фенотипа McLeod, на которых очень слабо экспрессированы антигены системы Kell, визуально не реагировали с сывороткой Cote, однако были способны адсорбировать эти антитела. Антиген, определяемый сывороткой Cote, получил обозначение и был причислен к категории napa-Kell-антигенов. Лица, не имеющие антигена К11 (фенотип К:-11), встречаются редко. В период открытия и изучения этого антигена, до начала 1980-х годов, было описано всего лишь несколько случаев [185, 195,223,318,335]
Wka(K17)
Антиген Wka получил свое название по фамилии донора (г-на Weeks), кровь которого была перелита больному и послужила причиной появления антител, обозначенных анти-\№. Антиген Wka встречается редко. По данным Strange и соавт. [356], из 11 076 доноров Оксфорда и Бристоля только 32 человека имели этот антиген. Авторы обратили внимание на определенную связь антигена Wkaс системой Kell, в частности они отметили, что антиген Wka чаще встречается в комбинации с антигеном к, чем К. Так, в упомянутой рандомизированной выборке из 11 076 доноров частота Wk(a+) составила 0,3 %. В то же время среди 6956 специально отобранных лиц с фенотипом К+к+ частота лиц Wk(a+) составила 0,1 % (7 человек), что, несомненно, свидетельствует о частичном сцеплении генов Wkan к. Соотношения генов К, Wkan к напоминают соотношение генов К, 1Лаик.В последнем случае ген Ula подобно гену Wka чаще наследуется в комбинации с геном к, чем с К. По-видимому, существует не исследованное еще явление более частого сочетания широко распространенных генов по сравнению с сочетанием редких генов. Эти различия могут проявляться при сравнении относительных показателей частоты сочетания генов, например при сравнении частоты лиц K+Wk(a+) и K-Wk(a+) с частотой распределения антигенов К, Wka и к в популяции. Уместно отметить, что среди примерно 1000 доноров с эритроцитами Кр(а+) не было обнаружено ни одного человека Wk(a+), что является дополнительным свидетельством связи антигена Wka с системой Kell.
Окончательное заключение о том, что антиген Wka принадлежит системе Kell, Strange и соавт. [356] сделали благодаря обследованию членов семей 5 из 7 упомянутых выше лиц K+Wk(a+). Оказалось, что Wka всегда передавался по наследству с к и авторы не наблюдали иных рекомбинаций. Таким образом, список редких Kell-антигенов был пополнен еще одним антигеном (Wka), получившим номер К17.
Аллельная связь Wk1 и Cote
Некоторое время антиген Cote, обнаруженный Guevin и соавт. [185], и антиген Wka, описанный Strange и соавт. [356], считались независимыми друг от друга. Антигену Cote, как упоминалось выше, был присвоен номер К11, антигену Wka- К17, в порядке их регистрации. После того как были найдены лица с фенотипом Wk(a-)Cote+ и, наоборот, Wk(a+)Cote-, стало ясно, что указанные антигены являются антитетичными и контролируются четвертой парой аллельных генов системы Kell 1 Wka и Wkb [335, 356] (если ген Cote именовать как Wkb). Антиген Wkb(Kll) встречается почти у 100 % людей, антиген Wka (K17) - примерно у 0,3 %, поэтому фенотип Wk(a+b-) представляет собой чрезвычайную редкость.
Kl 1 и К17 различаются одной нуклеотидной заменой (Т —»С) в экзоне 8 гена KEL. Т 1025 кодирует Val в позиции 302 - К11; С 1025 - Arg в позиции 302 -К17 (Lee и соавт. [241]). Эта мутация создает дополнительный Afecl-участок рестрикции в аллеле К17.
*К14иК24
В 1973 г, Heisto и соавт. [195] и затем в 1976 г. Wallace и соавт. [388] описали часто встречающийся антиген, который получил обозначение К14, поскольку, как показали авторы, имел отношение к системе Kell. Антитела анти-К14 были обнаружены в сыворотке крови жительницы местечка Каюн (штат Луизиана, США), имевшей 7 беременностей, трансфузий не было. Четвертая и пятая беременности закончились искусственным прерыванием, шестая и седьмая - рождением живых доношенных детей. Оба новорожденных имели положительную прямую пробу Кумбса, вызванную К14-антителами. У последнего новорожденного наблюдали анемию и гипербилирубинемию, однако обменного переливания крови не потребовалось. Родители женщины имели фенотип К:-14 и, как указали авторы, не являлись кровными родственниками.
Второй образец анти-К14-антител обнаружили Frank и соавт. [166]. Первоначально эти антитела были названы анти-Dp, но вскоре Sabo и соавт. [336] показали, что анти-Dp и анти-К14 представляют собой одну и ту же специфичность. Женщина, у которой нашли анти-Dp (=К14)-антитела, была жительницей местечка Байу (того же штата). Она также имела беременности (гемотрансфузий не было), однако в отличие от первого пробанда ее родители были двоюродными братом и сестрой. Поскольку женщинам с анти-К14-антителами не производили трансфузий, авторы не могли сделать какого-либо заключения относительно значения этих антител в клинике.
Антиген К24 (Cls), антитетичный антигену К14, обнаружили в 1985 г. Eicher и соавт. [160]. Антитела к этому редкому антигену найдены у белой женщины, жительницы Нового Орлеана (все тот же штат Луизиана). При исследовании ее сыворотки с 60 образцами стандартных эритроцитов, содержащих различные редко встречающиеся антигены Kell, авторы нашли единственный образец, с которым она дала положительную реакцию. Этот образец был К14-. Два других образца эритроцитов К14-, взятые для дополнительного исследования, также агглютинировались этой сывороткой. Таким образом, эксперименты убедительно показали, что эритроциты, не содержащие антигена К14, содержат антиген К24, иными словами, К14 и К24 представляют собой пару антитетичных антигенов.
Далее Eicher и соавт. [160] нашли, что антигену К24 свойствен эффект дозы, в частности титр анти-К24-антител с эритроцитами К14-К24+ (К24/К24) существенно превышал результаты титрования этих антител с эритроцитами
Молекулярно-биологические исследования Lee и соавт. [234] подтвердили, что К14 и К24 являются аллелями (см. Молекулярная основа антигенов Kell). Получены мышиные моноклональные IgG анти-К14-антитела [144,297].
К15
На эритроцитах К о Обнаружен Другой антиген, Кх (см. система Кх), который присутствует и на нормальных эритроцитах, но скрыт под более разветвленной структурой Келл-гликопротеина. Отсутствие антигенов Kell и одновременное присутствие антигена Кх послужили основанием причислить Кх к системе Келл, и он получил обозначение К15. Однако постепенно выяснилось, что Келли-антигены и Кх-антиген, хотя структурно и связаны, но относятся к разным антигенным системам. Антиген Кх находится на иных мембранных компонентах эритроцитов, чем гликопротеин, который несет на себе антигены системы Келл. Продукция Кх кодируется локусом ХК, расположенным на Х-хромосоме, в то время как локус KEL находится на хромосоме 7. В связи с этим обозначение К15 было упразднено, антиген Кх получил статус системы, КОТОРОЙ присвоен
номер ISBT 019 [141].
В 1976 г. Марш [цит. по 204] описал K-подобный антиген, получивший номер К16, который выявляли на эритроцитах 99,8% людей. Ранее Марш и Аллен отметили, что K-подобный антиген присутствует на эритроцитах к + и отсутствует на эритроцитах к-. Различие между антигенами к и К16 заключалось лишь в том, что эритроциты фенотипа Маклеод имели слабовыраженный к-антиген, K + W , но при этом были К16-. Осталось невыясненным: была ли разница количественной или качественной. Других сообщений об исследовании антигена К16 не было, и он продолжает оставаться в номенклатуре ISBT.
К18
Антиген К18 - единственный из всех антигенов, наследственную передачу которого не удалось проследить, поскольку все тестированные люди являлись носителем этого антигена, т. е. были К18 +. Исключение составили 2 человека (женщина и мужчина), эритроциты которых не содержали антигена К18, а в сыворотке их крови имелись анти-К18-антитела [98, 307]. Среди 54 450 доноров не найдено ни одного К18- (Barrasso и соавт. [97]).
Первый образец сыворотки анти-К18 нашли Barrasso и соавт. [98] в 1975 г. у женщины, имевшей 8 беременностей и 1 трансфузию крови. Сыворотка содержала смесь антител анти-К1 и антител IgG, получивших наименование анти-К18. Последние реагировали со всеми исследованными эритроцитами (2000 образцов К-), включая редкие фенотипы: К12-, К13- и др, но не реагировали с эритроцитами К. о и эритроцитами самой женщины. Авторы отметили, что антиген К18 сильнее экспрессирован на эритроцитах Кр (Ь +), чем Кр (Ь-), а также сильнее выражен на эритроцитах К13 +, чем К13-. Экспрессия антигена К18 на эритроцитах фенотипа Маклеод была самой слабой.
В 1983 г., через 8 лет после своей находки, Barrasso и соавт. [97] опубликовали дополнительные данные о К18-антителах и их вероятном клиническом значении. Антитела анти-К18 представляли собой комбинацию иммуноглобулинов в основном субкласса IgG4 и небольшого количества IgGl и, как предполагалось, не должны были вызывать сильного разрушения эритроцитов в естественных условиях. Однако пробная инъекция эритроцитов К1-К18 +, меченных Сг 51 , показала, что более 60% перелитых клеток разрушались в кровотоке пациентки в течение первых 24 ч после введения. Проба с фагоцитозом в моноцитарном монослое также свидетельствовала о несовместимости эритроцитов К18 + и возможности их быстрого выведения из циркуляции. Полученные результаты побудили лечащих врачей отказаться от трансфузии эритроцитов и изменить тактику лечения.
Второй образец К18-антител обнаружили Pehta и соавт. [307] в 1990 г. у мужчины 78 лет, получившего трансфузию. В его сыворотке, так же как у описанной выше женщины, присутствовали антитела анти-К1 и анти-К18. Авторы указали на интересную особенность: эритроциты пациента не реагировали с сыворотками aHTH-Yt и aHTH-Yt б , т. е. были Yt (погло-). По этому поводу Issitt, Anstee [204] дали комментарий, что это второй из известных случаев Картрайт отрицательного фенотипа. Первый был обусловлен транзи-торным подавлением экспрессии антигенов системы Картрайт. Пробанд Yt (погло-), описанный Pehta и соавт. [307], представлял собой, по-видимому, такой же феномен.
В методе проточной цитометрии эритроциты К18 + сына пациента реагировали слабее, чем эритроциты К18 + других лиц, что, как считают авторы, подтверждает принадлежность этого Напа-Келл-антигена к системе Келл. Отсутствие антигена К18 у отца отразилось в силу эффекта дозы на слабой выраженности антигена К18 у сына.
Ли и соавт. [231] показали, что, несмотря на серологическую идентичность обоих пробандов, фенотип К18- сочетался с различными нуклеогидными заменами в одном и том же кодоне экзона 4: в первом случае - С 508 Т, приводящая к замещению Arg 130 Thr; во втором - G 509 А, приводящая к замещению Arg 130 Джин.
К19
Первые анти-К19-антитела обнаружили Сабо и соавт. [337] в 1997 г. в сыворотке белой женщины сорока лет, имевшей 7 беременностей, одна из которых закончилась рождением живого ребенка, 6 - самопроизвольными выкидышами при сроках от 2 до 5 мес. Сыворотка женщины содержала, помимо К19-антител, слабые К1-антитела и реагировала со всеми эритроцитами, имевшими обычный фенотип по антигенам системы Келл, а также с эритроцитами, не содержавшими ряда общих антигенов Kell и напа-Келли. Сыворотка не реагировала с эритроцитами гомозигот К , собственными эритроцитами и эритроцитами трех ее сибсов.
Экспрессия к, Kp б , Js б и других часто встречающихся антигенов системы Келл и напа-Келл на эритроцитах К19- была нормальной в отличие от фенотипа К13-, для которого характерна сниженная экспрессия указанных антигенов.
Антиген К19, как и антиген К18, был сильнее экспрессирован на эритроцитах Кр (Ь +), чем Кр (Ь-), а также сильнее выражен на эритроцитах К13 +, чем К13-. На эритроцитах фенотипа Маклеод экспрессия антигена К19 была наименьшей.
Среди 7294 обследованных доноров Сабо и соавт, [337] не нашли ни одного К19-.
Второй случай К19-антител в том же 1979 г. описали Марш и соавт. [260] у 47-летнего мужчины (негра), которому произвели несколько трансфузий крови в связи с кровотечением. Авторы наблюдали отсроченную трансфузионную реакцию за счет анти-К 19-антител, которая проявилась в том, что все перелитые эритроциты К19 + (4 дозы) через 10 дней после переливания исчезли из кровяного русла реципиента. Убыль эритроцитов К19 + в кровотоке реципиента обусловливалась также самим кровотечением. Попытка авторов найти совместимого донора не привела к успеху: из 3463 обследованных не удалось найти человека К19-.
В итоге из 10 757 человек, в основном представителей белой расы, не оказалось ни одного К19-.
Ли [231] при исследовании молекулярной основы фенотипа К19- нашел, что оба пробанда К19- имели транзицию G 1595 А в экзоне 13, кодирующую Arg 492 Джин.
К22
Антиген К22, часто встречающийся (общий), обнаружен в 1982 г. Бар Шани и соавт. [96]. Лица, не содержащие этого антигена (К22-), найдены только среди евреев персидского происхождения. Первую сыворотку анти-К22 Бар Шани и соавт. получили от женщины израильтянки, когда она сдавала кровь в качестве донора. Женщина никогда не имела трансфузий, ни у одного из ее 4 овей, имевших фенотип К22 +, признаков ГБН при рождении не зарегистрировано. Антитела реагировали со всеми образцами эритроцитов общих и редких Келл-фенотипов, в том числе с одним образцом эритроцитов Маклеод. Со вторым образцом эритроцитов Маклеод сыворотка визуально не реагировала, но, как потом выяснилось, анти-К22-антитела адсорбировались на этих эритроцитах. Антитела не реагировали с эритроцитами гомозигот К , собственными клетками женщины и эритроцитами одной из трех ее сестер. При обследовании более 500 израильских доноров (в основном представителей смешанных рас) лиц К22-, кроме носительницы К22-антител и ее сестры, обнаружено не было.
Второй образец К22-антител обнаружили Мэнни и соавт. в 1985 г. [256]. Как и в первом случае, антитела образовались у женщины, еврейки из Ирана, живущей в Израиле. Анти-К22-антитела были выявлены во время ее 4-й беременности. У ребенка после рождения отмечали небольшую желтуху, прямая проба Кумбса была положительная.
Уместно подчеркнуть, что обследованная была D- К-. После 1-й беременности она получила трансфузию крови, четверо ее детей имели группу крови D +, один из них был К +, тем не менее образовавшиеся антитела имели только анти-К22-специфичность. Многие сыворотки, содержащие аллоиммунные антитела к часто встречающимся антигенам Келли и напа-Келл, также содержат анти-К и другие антитела. Описанный Мэнни и соавт. случай является исключением.
Четвертая и две последующие беременности этой женщины были описаны в более поздней публикации Левин и соавт. [247]. Авторы нашли, что 4-я и 5-я беременность сопровождалась анти-К22-антителами IgGl. У обоих детей при рождении прямая проба Кумбса положительная. Купирование легкой степени ГБН в обоих случаях ограничилось фототерапией. При рождении 6-го ребенка также наблюдали положительную прямую пробу Кумбса с эритроцитами пуповинной крови. Антитела имели изотип IgGl и IgG3. Ребенок был тяжело болен, и для его лечения произведено обменное переливание отмытых эритроцитов матери.
Исследование семьи 2-го пробанда (родителей и 5 детей, включая обследуемую) позволило Мэнни и соавт. придти к заключению, что антиген К22 связан с системой Келли. От родителей, имеющих фенотип К + к + К22 +, ген К22 передавался вместе с К 9 а К22- (молчащий ген) - вместе с к. Иными словами, пробанд и 2 ее сибса были К-к + К22- а другие 2 сибса - К + к + К22 +. Как указывают авторы, родители обследованной были кровными родственниками. Тестирование 217 не связанных родством людей из этнической группы евреев (выходцев из Ирана) не выявило лиц К22-.
Антиген К22 нормально экспрессирован на эритроцитах Кр (а + Ь-) и К13- в отличие от других антигенов (к, Kp б , Js б , Ku, К12, К18 и К19), которые на эритроцитах Кр (а + Ь ~) и особенно К13- выражены слабо.
Антиген К22 находится на гликопротеине с мол. массой 93 кДа. Три не связанных родством лица К22- имели нуклеотидную замену С 1085 Т, кодируюiHjfK> Ala322Val (Lee [231]).
1987 г. Марш и соавт. [270] нашли редко встречающийся антиген, полу-ивший обозначение К23. Сыворотка, выявляющая этот антиген, принадлежала женщине, итальянке по происхождению, имевшей 4 беременности. У ее 3-го ребенка при рождении прямая проба Кумбса резко положительная, однако симптомы ГБН отсутствовали. Сыворотка крови женщины и антитела, элюирован-ные с эритроцитов ребенка, реагировали с эритроцитами двух ее детей, эритроцитами мужа и свекрови. В то же время сыворотка не реагировала со стандартными эритроцитами, содержавшими в различных комбинациях часто и редко встречающиеся антигены Келл, а также не реагировала ни с одним из 2116 образцов эритроцитов обычных доноров.
Эритроциты мужа утрачивали серологическую активность после обработки АЕТ или Zzap. Гликопротеин, выделенный из них посредством иммунопреци-питации антителами обследуемой, имел мол. массу 93 кДа, и, как потом было установлено, реагировал с кроличьими антителами к гликопротеину Келли. Антиген К23 не имеет антитетичного партнера.
Два члена семьи, гетерозиготные по антигену К23 (К23 + / К23-), имели замещение А 1265 G, кодирующее Gin 382 Arg и создающее участок рестрикции #cwI (Lee [231]).
VLAN (К25)
Первый и единственный образец aHTH-VLAN-антител с изотипом IgGl + IgG2 обнаружили Jongerius и соавт. [215] при проведении пробы на совместимость. Сыворотка крови больного 60 лет (выходца из Голландии), содержащая эти антитела, реагировала в непрямой антиглобулиновой пробе только с 4 образцами эритроцитов: эритроцитами донора (датчанина по происхождению), эритроцитами двух его сестер и племянницы. Других лиц VLAN + авторы не нашли, обследовав 1068 доноров.
Попытка обнаружения антигена, антитетичного антигену VLAN, к успеху не привела: aHTH-VLAN-антитела не реагировали ни с одним из образцов стандартных эритроцитов, лишенных того или другого часто и редко встречающегося антигена.
Обработка эритроцитов АЕТ вызывала инактивацию антигена VLAN.
Для того чтобы установить локализацию антигена VLAN, авторы использовали метод конкурентного связывания антител (MAIEA): сравнивали блокирующий эффект VLAN-антител по отношению к 6 моноклональным антителам, направленным против различных эпитопов гликопротеина Келли. Эксперименты показали, что антиген VLAN располагается на гликопротеине Келл с мол. массой 93 кДа примерно в том же участке, где Расположены антигены Кр а , Кр ь и Кр с . Высказано предположение что ген, кодирующий продукцию VLAN, является 4-м аллелем субпокуса Кр а Кр ь Кр с .
Полученные Jongerius и соавт. данные позволили причислить VLAN к редким антигенам системы Kell. Ему был присвоен номер К25.
Ли и соавт. [235] нашли, что антиген VLAN обусловлен мутацией G 863 А, приводящей к аминокислотной замене Arg 248 Джин.
ТУ (K26)
Антиген ТУ, имеющий частоту встречаемости более 99,99%, обнаружен и изучен Джонс и соавт. [213].
Первый образец ТУ-антител найден в сыворотке крови мужчины 47 лет (коренного американца), обследованного в связи с операцией на бедре. Пациент до обследования трансфузий крови не получал.
Сыворотка анти-ТУ реагировала с эритроцитами всех общих фенотипов системы Келл, слабо реагировала с эритроцитами фенотипа Маклеод, Келл 1Р Kp (+ b-) и К13-, имеющими подавленную экспрессию антигенов Kell, но не реагировала с эритроцитами гомозигот К и нормальными эритроцитами , обработанными дитиотрейтолом, разрушающим антигены Келл.
С помощью метода MAIEA (метод конкурентного связывания антител) авторы установили, что антиген ТУ локализован на гликопротеине Келли.
Второй образец ТУ-антител (обозначенный сначала анти-УПА) были найден в сыворотке крови женщины (испанки по происхождению), госпитализированной на предмет удаления придатков. Сыворотка УПА не реагировала с эритроцитами ТУ, а сыворотка ТУ не реагировала с эритроцитами УПА.
Пациентка, как и в случае упомянутом выше, не получала трансфузий, но имела 2 беременности. Ее сыворотка реагировала с эритроцитами сына и 3 сибсов.
Несмотря на то что наследование антигена ТУ (УПА) не было прослежено в семьях в виде сцепленного комплекса с антигенами Келл, принадлежность его к этой системе была очевидна, и ему был присвоен номер К26.
Эксперименты с моноцитарным монослоем позволили Джонс и соавт. [213] заключить, что анти-ТОи-антитела не имеют клинического значения.
У 3 ТУ-отрицательных лиц из 2 семей наблюдали одинаковую транзицию G 1337 Авэкзоне 11, кодирующую Arg 406 Gin
RAZ (К27)
В 1994 г. Дэниелс и соавт. [148] обнаружили еще 1 общий антиген эритроцитов -RAZ, который получил номер К27. AHTH-RAZ-антитела присутствовали в сыворотке женщины кенийско-индийского происхождения, родители которой были двоюродным братом и сестрой. Тридцатью годами ранее женщина перенесла операцию на сердце, и в связи с этим ей могли перелить кровь. Срок выживания эритроцитов RAZ +, меченных Сг 51 , в кровяном русле пациентки был существенно сокращен: через 3 часа после инъекции меченых клеток половина их разрушилась, а через сутки после инъекции они в кровотоке отсутствовали. Для оказания трансфузионной помощи у больной было взято и при операции перелито 5 доз аутокрови.
Других Раз-отрицательных лиц, кроме указанной женщины - ^ носительницы RAZ-антител, не обнаружено. Таким образом, все люди являются RAZ-положительными.
Несмотря на то что антиген RAZ присутствовал на эритроцитах всех исследованных, ряд признаков позволил авторам причислить его к системе Келла.
- Антиген RAZ отсутствовал на эритроцитах К, а также на эритроцитах, обработанных АЕТ, т. е. нормальных эритроцитах, Которые с помощью АЕТ искусственно превращены в К о .
- На эритроцитах лиц с фенотипами Маклеод и Келл мод , для которых характерна низкая экспрессия антигенов Kell, антиген RAZ выражен так же слабо.
- Обработка эритроцитов моноклональными антителами против эпитопов Келл блокировала связывание RAZ-антител, равно как обработка эритроцитов RAZ-антителами блокировала связывание моноклональных эпитопспецифиче-ских Келл-антител. Указанное обстоятельство свидетельствовало о том, что антиген RAZ располагается на том же гликопротеине, что и Келли-антигены.
Ли и соавт. [235] показали, что описанная Дэниелс и соавт. Раз-отрицательная женщина была гомозиготна по замещению G 865 А, которое кодировало замену Glu 249 Lys.
Редкими Келл-антигенами у европеоидов являются Js , ул , Кр с (или Levay), К23, VLAN, частота которых составляет менее 0,1%.
Частые антигены, среди которых большинство Напа-Келл, присутствуют практически у всех людей за чрезвычайно редким исключением. К частым относятся антигены Bockman, Sgro, Маршалл, Sublett, км, Икар, ТУ (см. Табл. 5.1).
Обе упомянутые категории антигенов (редкие и частые) Отсутствуют на эритроцитах К о , слабо экспрессированы или совсем не экспрессированы на эритроцитах с фенотипом Маклеода. Как показано с помощью иммунохимических методов, все они, за исключением К24, расположены на Келл-гликопротеине [210, 213, 215, 269, 307, 310], и их молекулярное строение изучено, кроме К5 (Ку), К13 (Sgro), К16 (К-как), К30 (км).
Пара-КБЬ-антигены
В группу Напа-Кель выделены антигены, связь которых с системой KEL недостаточно подтверждена популяционными и посемейными исследованиями, но результаты ДНК-типирования носителей антигенов и антител дают основание полагать, что таковая может иметь место. KEL и напа-Кель располагаются на одном протеине [241]. Трудность причисления Напа-Кел-антигенов к системе KEL обусловлена высокой частотой их встречаемости - почти 100%. Для того чтобы найти людей, не содержащих Напа-Кел-антигенов, и доказать существование антитетичных им антигенов, требуется обследовать огромное число людей. Однако эти антигены могут и не иметь антитетичного партнера, а антитела к ним продуцируют единичные лица, имеющие редкую, возможно неповторимую, точечную мутацию в локусе KEL.
К Напа-Кел-антигенам относятся Bockman, Sgro, Маршалл, Sublett, Икар, K23. Им присвоены соответствующие порядковые номера и индексы ISBT (см. Табл. 5.1).
Некоторые антигены, относимые ранее к напа-Кель, например Кот и Сантини, переведены в разряд образующих систему Келл: Кот (К11), как указывалось выше, является аллелем четвертой пары антитетичных антигенов- К11 иК17; Сантини (К14) - аллелем пятой пары антитетичных антигенов - К14 и К24.
Ku (К5)
Антиген Ku присутствует на эритроцитах всех людей, за исключением лиц Келл Нуу (см. К о ). Соответственно антитела анти-ку могут вырабатывать только лица с фенотипом К о , эритроциты которых лишены всех известных антигенов КеИ, в том числе антигена Ку.
История открытия антигена Ku мало чем отличается от истории обнаружения других антигенов эритроцитов, но вместе с тем имеет свои оттенки. В 1957 щ Чаун и соавт. [125] описали женщину (миссис Peltz), эритроциты которой не содержали 4 известных к тому времени антигенов Kell: К, к, Кр а и Кр ь . Это было первое описание необычного фенотипа KK-Kp (погло-), получившего название К о . В сыворотке крови миссис Peltz авторы обнаружили антитела, которые затем более подробно были изучены Коркоран и соавт. [134]. Сыворотка анти-Пельтц, как ее обозначили сначала, содержала смесь антител против нескольких антигенов Kell. Они реагировали с эритроцитами К + и к +. С помощью методов дифференциальной адсорбции и элюции антител эритроцитами К-к +, К + к- и Кр (а + Ь-) было показано, что в сыворотке анти-Пельтц присутствовало антитело, которое, будучи изолированным от других антител, реагировало со всеми эритроцитами , кроме фенотипа Келл 1Г Это антитело получило обозначение анти-ку. Авторами был сделан вывод, что Ку-антитела направлены к антигену, присутствующему на всех эритроцитах, несущих антигены Келл, независимо от их сочетания.
Ku-антитела реагируют с эритроцитами лиц, имеющих фенотип Маклеода (см. Маклеод), при котором антигены Келл выражены крайне слабо. Эту особенность Ku-антител используют для того, Contributor: отличить фенотип К о , полностью лишенный антигенов Kell, от фенотипа Маклеод, содержащего исчезающие количества антигенов Kell. По-видимому, для распознавания антигена Ku анти-Ки-антителами достаточно следов гликопротеина Келли на поверхности эритроцитов.
Молекулярная структура антигена Ku не установлена. Основная трудность ее расшифровки, по-видимому, заключается в том, что иммунодоминантная аминокислотная последовательность антигена Ku чрезвычайно проста и по многу раз повторяется в структуре Келл-антигенов. Можно провести определенную аналогию между специфичностью Ku-антигена и видовой специфичностью. Видовая (общая) специфичность присуща всем антигенам независимо от их качественных различий. Вместе с тем видовой антиген как химическая структура не обозначен. Точно так же специфичность Ku присуща каждому из 24 известных антигенов системы Келл. Большинство мышиных моноклональных антител к различным участкам гликопротеина Келла напоминают Ku-антитела по их реакции со всеми образцами эритроцитов, исключая К [128, 144, 202, 303, 304, 329].
Несмотря ни на то что люди с фенотипом К о Встречаются редко, описано много случаев анти-Ки-антител у лиц польского, финского, голландского, австралийского и другого происхождения. Характерно, что почти у половины из них родители были родственниками: двоюродными и троюродными братьями и сестрами [253269299, 318, 346]).
Анти-Ки-антитела вызывают гемолитические трансфузионные реакции, вплоть до анурии [299], и ГБН [125, 269].
К W (K8)
Обнаруженный Бове и соавт. [106] антиген K W получил порядковый номер Ш однако исследование этого антигена осталось незавершенным из-за утраты антител aHTH-К ш , в связи с чем он был исключен из номенклатуры ISBT.
KL (К9)
В 1968 г. голландские исследователи Ван дер Харт и соавт. [377] нашли в крови пятилетнего мальчика по фамилии Клаас (Claas) антитела, получившие название анти-KL. Последние не реагировали с его собственными эритроцитами и эритроцитами Маклеод, но вступали в реакцию с эритроцитами 6150 доноров Красного Креста Нидерландов, включая K + K- Kp (+ b-), Js (+ b-), а также 4 образцами эритроцитов К о . Ребенок имел фенотип, подобный фенотипу Маклеод: Кк ± Kp (AB ±) Js (AB ±). Пробы с адсорбцией - элюцией позволили установить, что анти-Ю ^ -антитела направлены против всего комплекса антигенов Kell. Путем адсорбции сыворотки анти-KL эритроцитами с разным фенотипом Келли удалось выделить 2 фракции антител, одна из которых активно реагировала с эритроцитами К-к +, но слабо - с эритроцитами К о , другая, наоборот, сильнее реагировала с К о -клетками и содержала анти-Кх-антитела. Тот факт, что анти-КЬ-Антитела реагировали с эритроцитами К о , лишенными всех Kell-антигенов, но не реагировали с эритроцитами Маклеод, содержащими некоторое количество антигенов Kell, указывал на определенную связь антигена KL с системой Келли.
Родители мальчика оказались троюродными братом и сестрой. Они имели обычный фенотип: K-K + Kp (A-B +) Js (A-B +), как и два других родственника пробанда.
Описано несколько случаев анти-Ю ^ -антител, все они - у больных хроническим гранулематозом [360]. У мальчика Клааса при ретроспективном рассмотрении отмечали рецидивирующие кокковые инфекции, которые, по-видимому, являлись проявлением недиагностированного гранулематоза. щ Антиген KL получил номер ISBT 006009, означающий принадлежность к системе Келл, однако позднее (в 1995 г.) исключен из номенклатуры Келл-системы.
UP (К10)
В 1967 г. Furuhejelm и соавт. [169] при проведении пробы на индивидуальную совместимость обнаружили антиген, который, как позже выяснилось, встречается почти исключительно у финнов. Антиген получил обозначение 1Л а - по фамилии больного (Karhula), носителя антител. Из 2620 доноров, жителей Хельсинки, 68 (2,6%) были, ул (+). СРЕДИ обособленно проживающих коренных финнов Частота 1Л а Была Выше - до 5%. У шведов 1 из 501 обследованного оказался носителем антигена 1Л а (0,19%). Частота 1Л а СРЕДИ японских доноров, по данным Окубо и соавт. [300], составила 0,46% (37 лиц ул (+) из 8000 обследованных). Антиген Нне был найден кишечника, странно [цит. по 318] при обследовании 140 саамов, 66 негров, 5000 англичан и 314 других белых - не скандинавов.
Исследование семей (около 350 человек, 18 из которых были ул +), показало, что антиген Уль в наследуется независимо от многих групповых антигенов за исключением системы Келл. Несмотря на относительно низкую частоту антигена
К у финнов - 4,1%, и малую частоту антигена 1Л а - 2,6%, Furuhjelm и соавт. [168] нашли 3 семьи, родители и дети в которых были K +, ул (+), и установили, что у всех 13 детей Ш а наследовался без К1 как, ул / к. Авторы пришли к заключению, что ген, ул контролируется локусом KEL (или очень близко к нему расположен), однако не является аллелем К и К; Кр а , Кр ь или Кр с .
Не накоплено еще данных, позволяющих Считать антиген 1Л а антитетичным по отношению к Js и Js б , Wk и Кц, К14 и К24, а также к часто встречающимся антигенам Келли и пара-Келл: К12, К13, К18, К19, К20 и К22, не имеющим антитетичных партнеров.
Анти-1Л а -антитела Встречаются редко. Описано 4 случая: 2 - в Финляндии (. Furuhejelm и соавт [168169]), 2 - в Японии (Окубо и соавт [300], Sakuma и соавт [338]..). В 3 случаях антитела присутствовали у пациентов, имевших трансфузии эритроцитов, причем 1 из них, японец, получил трансфузию 15 лет назад. В четвертом случае 1Л а -антитела обнаружены у японской женщины, имевшей 3 беременности (Sakuma и соавт. [338]). У женщины не было переливаний крови, но у ее ребенка зафиксирована ГБН средней тяжести, причиной которой, как полагают авторы, послужили 1Л а -антитела. При обследовании 19 финских женщин ул (A-), родивших детей 1Л (а +), анти-1Л а -антитела НЕ Были обнаружены (Furuhejelm и соавт. [169]).
Окубо и соавт. [300] НЕ выявили 1Л а -антител ПРИ обследовании 66 ООО японских доноров.
Как отметили гонки и Sanger [318], если бы удалось найти антиген ул B , то гены 1Л а и ул б составили бы четвертую пару аллелей комплекса KEL. Однако антиген ул б до сих пор не обнаружен. Гонка и Sanger [318] высказали суждение, что антиген 1Л а у финнов подобен антигену Js у негров. И тот, и другой входят в систему Келл, но присутствуют только у лиц определенной расовой принадлежности.
Антиген ул является результатом трансверсии (рассечения) экзона 13 гена KEL в участке А 1601 Т, приводящей к замещению Glu 494 Вал (Lee и соавт. [24i]).
Более ранние исследования, проведенные Miyata и соавт. (Цит. По Issitt, Anstee [204]), показали, что, как и другие антигены системы Келл, UP полностью развит при рождении.
К12
В 1973 г. Марш и соавт. [272] описали две сыворотки, Боос и Sp, которые выявляли часто встречающийся антиген, присутствующий на всех эритроцитах, кроме эритроцитов носителей антител. Антиген получил обозначение К12.
В 1982 г. Шапочка и соавт. [99] обнаружили антитела с аналогичной специфичностью анти-К12 у 2 братьев с фенотипом К12-, имевших трансфузии эритроцитов.
В 1995 г. был описан (Reid и соавт. [327]) еще 1 мужчина, эритроциты которого были К12-, а сыворотка крови содержала анти-К12-антитела.
Причислить антиген К12 к системе Келл позволили 3 обстоятельства: этот антиген отсутствовал на эритроцитах гомозигот К ° 9 имел слабую экспрессию на эритроцитах лиц с фенотипом Маклеода, разрушался (как все другие антигены Kell) при обработке эритроцитов АЕТ.
С помощью методов конкурентного связывания антител и иммунопреципи-тации (MAIEA *) установлено, что К12 расположен на гликопротеине Келли и его можно считать полноправным антигеном этой системы, а не относить, как ранее, к напа-Kell-антигенам.
Лица К12- найдены только среди белых. Сообщение Марш и соавт. [272] о том, что один из К12- был негром, позднее скорректировал Тейлор [366]: как он выяснил, этот пациент относился к белой расе.
Шапочка и соавт. [99] Рид и соавт. [327] отметили, что переливание эритроцитов К12 + больным, имеющим анти-К12-антитела, существенно не сказывалось на клиренсе эритроцитов в естественных условиях и не имело каких-либо отрицательных последствий для реципиентов. После трансфузии у больных появлялась положительная прямая проба Кумбса и по прошествии времени повышался, но не во всех случаях, титр анти-К12-антител.
Случаев ГБН, обусловленных анти-К12-антителами, не описано. Все найденные антитела были связаны с трансфузиями эритроцитов.
К13
Антитела к часто встречающемуся антигену К13 обнаружены в 1974 г. Марш и соавт. [267] в сыворотке крови белого американца итальянского происхождения, который в прошлом получал трансфузии. Антитела реагировали в пробирке с эритроцитами любого фенотипа системы Келл, включая Маклеод, но НЕ реагировали с эритроцитами К о и собственными. О клиническом значении анти-К13-антител сведения отсутствуют. Сестра пробанда была К13-, имела 7 беременностей, но анти-К 13-антител не выработала. Авторы не указали, были ли родители упомянутых К13-отрицательных сибсов кровными родственниками.
На эритроцитах пробанда и его сестры наряду с отсутствием антигена К13 авторы отметили низкую экспрессию антигенов к, Kp б , Js б , Ку и К12. В то же время эритроциты сильно реагировали с сывороткой анти-Кх, что характерно для эритроцитов А ^ -гетерозипя. Анализируя полученные данные, Марш и соавт. пришли к заключению, что отсутствие антигена К13 на Келл-гликопротеине угнетает экспрессию других антигенов Kell-Системы аналогично Кр а -эффекту (см. Кр а -эффект \ когда у ЛИЦ с Кр а на Одной хромосоме и К ° на другой снижается выраженность всех Келл -антигенов.
Эффект ослабления Kell-антигенов у пробанда и его сестры, как полагали Марш и соавт., Был связан именно с гаплотипом К13-, а не с гаплотипом К ° ь поскольку Другие ЧЛЕНЫ семьи, которые были К ° / К13, имели нормальную экспрессию антигенов к , Кр ь , И. С. б , Ку и К12 на эритроцитах. Выводы авторов нашли подтверждение в исследованиях Kaita и соавт. [220], сообщивших о том, что гетерозиготы К ° / Kp б Js б имели на эритроцитах относительно нормальную экспрессию К, Кр ь и Js б .
Далее, Марш и соавт. [261] описали больную К13 + с остро развившейся, «горячей», как указывают некоторые авторы, АГА, вызванной ауто-К13-антителами. Сначала авторы нашли, что антигены системы Келл и напа-Келл были нормально экспрессированы на эритроцитах пациентки, но в другом сообщении это заключение было ими пересмотрено (Marsh и соавт. [265]). Аутоантитела, фиксированные к поверхности эритроцитов (резко выраженная прямая антиглобулиновая проба), затрудняли фенотипирование, и, кроме того, экспрессия антигенов Kell на эритроцитах пациентки была сниженна.
Ауто-К13-антитела были элюированы с эритроцитов больной (Marsh и соавт. [261]). Они относились к IgG-классу и были вторым образцом антител со специфичностью анти-К13. Других образцов не найдено.
Молекулярная основа фенотипа К13- неизвестна, хотя с помощью методы иммунопреципитации было установлено, что сам антиген К13 располагается на гликопротеине Келли [269].
Описано несколько пробандов с парциальной формой антигена К [276,348].
Приведенные McDowell и соавт. [276] наблюдения убеждает в том, что лица К+, так же как К-, могут вырабатывать анти-К-антитела, реагирующие со всеми образцами эритроцитов К+, за исключением собственных. Другие случаи [348] свидетельствуют о том, что большинство сывороток анти-К содержат парциальные анти-К-антитела, не реагирующие с некоторыми эпитопами антигена К.
Skradski и соавт. [348] описали белого мужчину, эритроциты которого К+к+ реагировали с 8 из 72 использованных анти-К-реагентов. С помощью адсорбции - элюции авторы показали, что эритроциты обследуемого адсорбировали анти-К-антитела, с которыми давали видимую агглютинацию и которые затем обнаруживали в элюате. Анти-К-реагенты, с которыми не было видимой реакции, на эритроцитах не адсорбировались и в элюатах отсутствовали. Антигены k, Kpb, Jsb, Ku, Kll, К12, К13, К14, К18, К19 и К22 на эритроцитах обследуемого были выражены нормально, антигены Кра, Крс, Jsa, UP, Wka и К23 отсутствовали. Три сестры обследуемого имели эритроциты К+, которые также несли на себе вариантную форму К. Парциальный антиген К, обнаруженный в этой семье, был слабее, чем на контрольных эритроцитах К+ неродственных доноров.
Из 8 образцов анти-К-антител, которые реагировали с эритроцитами обследуемого, 3 были поликлональные IgG, 4 - моноклональные IgM. Авторы точно не указали, что послужило иммуногенным стимулом для образования реагирующих антител. У 6 лиц они, по-видимому, имели аллоиммунное происхождение, поскольку были выявлены с помощью непрямой пробы Кумбса. У одной женщины титр анти-К-антител значительно повысился при беременности плодом К-.
При исследовании эритроцитов более 50 ООО человек одной из 8 реагирующих сывороток не было обнаружено ни одного образца, который подобно эритроцитам пробанда и трех его сестер реагировал с упомянутой сывороткой, но при этом не реагировал с другими сыворотками анти-К.
McDowell и соавт. [276] описали женщину с фенотипом К+к+, у которой имелись антитела, охарактеризованные авторами как К-подобные. Антитела не агглютинировали ни собственные эритроциты, ни эритроциты К+к+ ее дочери, но реагировали с эритроцитами К+к+ ее сына и мужа. Элюат, снятый с эритроцитов сына после адсорбции ими сыворотки матери, содержал анти-К-антитела, которые по-прежнему не реагировали с эритроцитами самой женщины и эритроцитами дочери. Выраженность антигена К на эритроцитах матери и дочери была существенно слабее, чем сына и мужа. Каких-либо аномалий других антигенов системы Kell на эритроцитах женщины, ее мужа и детей указанные авторы не отметили.
Исходя из представленных данных, можно сделать 2 основных вывода.
Во-первых, парциальные антигены К, не выявляющиеся обычными сыворотками анти-К, крайне редки. Напротив, парциальные анти-К-антитела встречаются часто. Исходя из данных Skradski и соавт. [348], 88 % сывороток анти-К (64 из 72) не содержат фракции антител, направленных к определенным эпито-пам К-антигена. В то же время практически все поли- и моноклональные анти-К-реагенты содержат антитела к иммуногенному, трансфузионно опасному эпи-топу К, который содержится, за редчайшим исключением, во всех эритроцитах К+, и выявляют его даже при слабой экспрессии.
Во-вторых, парциальные антигены К обусловлены редким вариантным аллелем KEL, который, будучи в гомозиготной форме, кодирует продукцию некоторых, но не всех эпитопов нормального антигена К. Парциальные антигены К отличаются от нормального К не только качественно, но и количественно.
И последнее, носителей парциальных К-антигенов следует рассматривать как К-отрицательных реципиентов, но как К-положительных доноров.