Антигены системы Kell (Келл) (табл. 5.1) разделяют на 4 группы.
1-я группа - 11 антигенов, объединенных в 5 подгрупп: Кик; Кра, Крь и Крс; Jsa и Jsb; Kll (Cote) и К17 (Wka); К14 (San) и К24 (Cls). Аллельная взаимосвязь генов внутри подгрупп четко установлена.
2-я группа - 7 часто встречающихся антигенов: К12 (Вое), К13, L18, К19 (Sub), К22, TOU и RAZ, не имеющих антитетичных партнеров.
3-я группа - 3 редко встречающихся антигена: Ula, К23 и VLAN, молекулярная основа которых расшифрована и представляет собой простые аминокислотные замены.
4-я группа - 3 часто встречающихся антигена: Ku, k-like и Km. Молекулярная основа этих антигенов не ясна. Для того чтобы установить аминокислотную последовательность, обусловливающую их специфичность, необходимо сравнить два Kell-полипептида: содержащий и не содержащий указанные антигены. Однако лица, лишенные этих антигенов, практически не встречаются.
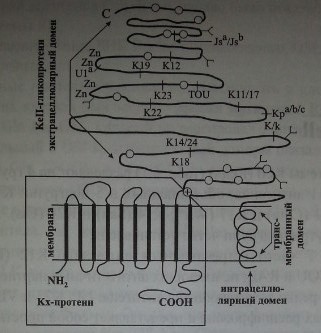
Kell-фенотип зависит от двух различных генных локусов. Синтез антигенного вещества Kell осуществляет локус KEL, который расположен на хромосоме 7. Экспрессию антигенов Kell контролирует другой локус -ХК, находящийся на Х-хромосоме. Ген ХК продуцирует Кх-протеин, который является подложкой и одновременно составной частью Kell-гликопротеина (рис. 5.1).
Локус KEL в отличие от локусов D и СЕ системы резус более компактен. Кроссинговер в нем не наблюдается, генные конверсии редки. Один гаплотип KEL продуцирует несколько часто встречающихся (общих для всех людей) Kell-антигенов, но не более одного редко встречающегося.
Антигены Kell расположены на Kell-гликопротеине (трансмембранном гликопротеине CD238), имеющем мол. массу 93 кДа. Основная часть Kell-антигенов размещается в экстрацеллюлярной части Kell-гликопротеина (см. рис. 5.1), что, по-видимому, и делает его столь иммуногенным.
Гликопротеины Kell относятся к цинксодержащим металлопротеинам. Они обладают свойствами эндопептидаз и имеют некоторое сходство с так называемым общим антигеном острого лимфобластного лейкоза.
Молекулярный субстрат большинства Kell-антигенов известен. Их серологический полиморфизм обусловлен простыми аминокислотными заменами в Kell-гликопротеине
Система Kell тесно связана с двумя другими независимыми системами - Кх и Gerbich. От последних зависит степень выраженности антигенов Kell на поверхности клетки.
Описаны редкие фенотипы, в которых большинство Kell-антигенов слабо выражены или отсутствуют (фенотипы McLeod, Kmod, транзиторный К+ или К-, Ко). Исключение представляет антиген Ки, который присутствует на всех эритроцитах, в том числе на Kell-дефицитных и Ко.
Отсутствие Kell-антигенов и ослабленная их экспрессия могут быть обусловлены несколькими причинами: 1 - гомозиготностью по молчащему гену КЕЬ-локуса; 2 - эпистатическим подавлением KEL-локуса - эпистазией генов Gerbich; 3 - блокадой антигенных участков Kell-гликопротеина аутоантитела-ми (транзиторный К-) или бактериальной модификацией (транзиторный К+); 4 - нарушением синтеза Кх-протеина и другими, не вполне ясными причинами. Дефицитные Kell-фенотипы передаются по наследству (Kmod, McLeod), но, по-видимому, могут формироваться и как следствие соматических мутаций.
Наибольшей иммуногенностью обладает фактор К (синонимы: Kell, KEL1, К1). Его определение регламентировано нормативными документами [54, 55] и является функциональной обязанностью иммуносерологов службы крови.
Антигены Kell представляют также интерес для антропологов [13] и судебных медиков [3].
Антигены системы KEL
|
Обозначение |
Частота среди европеоидов, % |
Молекулярная основа |
Год открытия [источник] |
||
|
авторское |
традиционное |
ISBT |
|||
|
Kelleher (Kell) |
К |
KEL1 |
9 |
Met 193 Thr |
1946[133] |
|
Cellano |
k |
KEL2 |
99,8 |
Thr 193 Met |
1949 [249] |
|
Penney |
Kpa |
KEL3 |
2,3 |
Trp281Arg/Gln |
1957[87] |
|
Rautenberg |
Kpb |
KEL4 |
>99,9 |
Arg281Trp/Gln |
1958 [88] |
|
Peltz (K) |
Ku |
KEL5 |
>99,9 |
He установлена |
1961 [134] |
|
Sutter |
Jsa |
KEL6 |
l;y негров 19,5 |
Pro 597 Leu |
1959[176] |
|
Mattews |
Jsb |
KEL7 |
>99,9 |
Leu 597 Pro |
1963 [183] |
|
|
Kw |
KEL8* |
5,0 |
|
1965 [106] |
|
Claas |
KL |
KEL9* |
99,0 |
|
1968 [379] |
|
Karhula |
Ula |
KEL10 |
<0,1; у финнов 2,6 |
Val 494 Glu |
1968 [169] |
|
Cote |
|
KEL11 |
>99,9 |
Val302Ala |
1976 [185] |
|
Bockman |
Boc |
KEL12** |
>99,9 |
His 548 Arg |
1973 [272] |
|
Sgro |
|
KEL13** |
>99,9 |
He установлена |
1 1974[262] |
|
Santini |
San |
KEL14 |
>99,9 |
Arg 180 Pro/His/Cys |
1973 [195] |
|
|
К |
KEL15* |
>99,9 |
He установлена |
1971[273] |
|
|
k-like |
KEL16 |
99,8 |
He установлена |
1975 [267] |
|
Weeks |
Wka |
KEL17 |
0,3 |
Ala 302 Val |
1974[356] |
|
Marshall |
|
KEL18** |
>99,9 |
Arg 130 Trh/Gln |
1975 [98] |
|
Sublett |
|
KEL19** |
>99,9 |
Arg 492 Gin |
1979 [234] |
|
|
Km |
KEL20 |
>99,9 |
He установлена |
1968 [377] |
|
Levay |
Kpc |
KEL21 |
<0,1 |
Gln281Arg/Trp |
1979 [403] |
|
Ikar |
|
KEL22** |
>99,9 |
Ala 322 Val |
1982 [96] |
|
|
|
KEL23** |
<0,1 |
Arg 382 Gin |
1987 [270] |
|
|
Cls |
KEL24 |
2,0 |
Pro 180 Arg |
1985 [160] |
|
|
VLAN |
KEL25 |
<0,1 |
Arg 248 Gin |
1996 [215] |
|
|
TOU |
KEL26 |
>99,9 |
Arg 406 Gin |
1995 [213] |
|
|
RAZ |
KEL27 |
>99,9 |
Glu 299 Lys |
1994 [148] |
|
|
VONG |
KEL28 |
|
|
2003 [*] |
|
|
KALT |
KEL29 |
|
|
2006 [*] |
|
Обозначение |
Частота среди европеоидов, % |
Молекулярная основа |
Год открытия [источник] |
||
|
авторское |
традиционное |
ISBT |
|||
|
|
KTIM |
KEL 30 |
|
|
2006 [*] |
|
|
KYO |
KEL31 |
|
|
2006 [*] |
|
|
KUCI |
KEL32 |
>99,9 |
|
2007 [*] |
|
|
KANT |
KEL33 |
>99,9 |
|
2007 [*] |
|
|
KASH |
KEL34 |
>99,9 |
|
2007 [*] |
|
KEL- дефицитные фенотипы |
IT о (null) |
|
|
|
1957 [125] |
|
McLeod |
|
Очень редко |
|
1961 [86] |
|
|
Leach |
|
|
|
1985 [204] |
|
|
Mullins |
|
|
|
1988 [308] |
|
|
Allen |
|
|
|
1993 [147] |
|
|
mod |
|
|
|
1995 [322] |
|
|
Транзиторный 1 K+/K" |
|
Редко |
К- стали К+ К+ стали К- |
[278] [344,380,397] |
|
*Kell-антигены, исключенные из системы Kell,
** Антигены napa-KEL







