Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Системы Lutheran и Lewis
Вскоре после открытия антигена Lea Grubb [91, 92] и Brendemoen [42] обнаружили, что слюна лиц, чьи эритроциты типировали как Le(a+), выраженно ин-гибировала сыворотки анти-Le3. Grubb [93] высказал предположение, что группа крови Le(a+) зависит от присутствия антигена Lea в слюне. Из наблюдений следовало, что Lewis - это система антигенов слюны (и плазмы), а не эритроцитов.
Уместно подчеркнуть, что фенотип Lewis устанавливают и записывают в документы на основании того, какие антигены найдены на эритроцитах, но не в секретах обследуемого лица. Такой порядок принят в учреждениях службы крови. Исключение составляют судебно-медицинские учреждения, где групповые свойства крови часто определяют не по эритроцитам, а на основании исследования следов крови, выделений организма, перхоти, волос и других вещественных доказательств
В 1950 г. Grubb писал [93] об антигенах Lewis как о водорастворимых муко-идах, подчеркивая, что антиген Lea может быть удален с эритроцитов Le(a+) отмыванием.
Как установили Andersen [14], Morgan [175], Watkins [234], Ceppellini [52] и многие другие исследователи [120,137,195], антигены Lewis в отличие от остальных групповых антигенов эритроцитов не являются антигенами эритроцитов, а адсорбируются на них из плазмы. В этом главная особенность системы Lewis.
Sneath и Sneath [211] нашли, что эритроциты Le(a-b-) могут менять фенотип на Le(a+) и Le(b+) после инкубации их в соответствующей плазме (табл. 9.2),
a Watkins [234] установил, что эритроциты, получившие Lea или Leb из плазмы, могут утрачивать эти антигены, если их поместить в плазму лица Le(a-b-).
Таблица 9.2
Замена антигенов Lewis на эритроцитах после инкубации в плазме доноров, имеющих другой фенотип Lewis*
Эти находки были дополнены Makela и соавт. [155], которые обнаружили, что слюна приводит к эффекту трансформации фенотипа Lewis, как и плазма.
Утрата антигенов Lewis может происходить не только in vitro, но и in vivo. Mollison и соавт. [173] отметили, что эритроциты Le(b+), перелитые реципиенту Le(a-b-), относительно быстро исчезают из кровяного русла, и их не находят у реципиента уже через 1-2 недели после трансфузии. Однако исчезновение эритроцитов Le(b+) из кровотока не является следствием их разрушения. Используя различия по антигенным маркерам (например, донор М - реципиент N и др.) или радиоактивную метку Сг51, можно убедиться, что перелитые эритроциты циркулируют в кровяном русле реципиента продолжительное время. Отсутствие эритроцитов Le(b+) свидетельствует лишь о том, что антиген Leb перешел в плазму с поверхности перелитых клеток, и они приобрели фенотип Le(a-b-).
В настоящее время считается установленным, что субстанции Lewis фиксируются к мембране эритроцитов из плазмы в виде гликосфинголипидов (Marcus, Cass [157]). В слюне они присутствуют в виде гликопротеинов (Schenkel-Brunner [203]).
Levine и Celano [145] показали, что предварительная обработка эритроцитов дубильной кислотой (таннином) усиливает адсорбцию антигенов Lewis из слюны, однако эта реакция неспецифична, поскольку таннизированные эритроциты легко адсорбируют на своей поверхности другие мукоиды.
Напротив, протеолитические ферменты усиливают специфическое связывание антигенов Lewis с одноименными антителами, что по сей день использут для идентификации Lewis-антигенов и Lewis-антител.
Makela и соавт. [155] изучили трансформацию эритроцитов Le(a-b-) в Le(a+) и Le(b+) при инкубации в плазме, содержащей субстанции Lea или Leb, и нашли, что ферменты плазмы не принимают участия в фиксации антигенов Lewis к эри-троцитарной мембране - этот процесс представляет собой пассивную адсорбцию.
Публикации, появившиеся вслед за открытием Lea, характеризуют систему Lewis как сложную, не укладывающуюся в привычные представления о групповой дифференцировке крови человека. Многие годы не находили объяснения некоторые парадоксы, связанные с этой системой.
Andresen [15] первым обратил внимание на то, что родители Le(a-) имели детей как Le(a-), так и Le(a+), и в связи с этим полагал, что передача Lea по наследству носит рецессивный характер. Внешне это выглядело именно так (табл. 9.3), поскольку браки Le(a+) х Le(a+), хотя и редко, но давали потомство Le(a+) [55, 140,202], а браки Le(b+) х Le(b+) давали потомство Le(b+) и Le(b-) [54,202].
Таблица 9.3
Особенности наследования фенотипа Le(a+)
|
Популяция |
Количество детей Le(a+) и Le(a-) у родителей |
Источник |
|||||
|
Le(a+) х Le(a+) |
Le(a+) x Le(a-) |
Le(a-) x Le(a-) |
|||||
|
Le(a+) |
Le(a-) |
Le(a+) |
Le(a-) |
Le(a+) |
Le(a-) |
||
|
Датчане |
79 |
1 |
128 |
307 |
105 |
810 |
[18,81, 121, 149, 170] |
|
Англичане |
45 |
142 |
269 |
77 |
624 |
[194] |
|
|
Норвежцы |
12 |
50 |
81 |
32 |
282 |
[169] |
|
|
США (белые) |
20 |
56 |
85 |
35 |
250 |
[87] |
|
|
Итого: |
156 |
1 |
376 |
742 |
249 |
1966 |
|
У родителей Le(a+) x Le(a+) дети с фенотипом Le(a-) бывают редко. У родителей Le(a~) х Le(a-) дети с фенотипом Le(a+) составляют 11,2 %. При смешанных браках Le(a+) х Le(a-) дети с фенотипом Le(a+) составляют 33,6 %, с фенотипом Le(a-) - 66,3 %.
Ясность в сложившееся несоответствие внесли исследования Grubb [92]. Оказалось, что результат определения Lea в эритроцитах не всегда отражает истинный Lewis-фенотип обследуемого, поскольку LeaH LebHa эритроцитах могут отсутствовать, но при этом быть хорошо выраженными в слюне.
Многие авторы подтвердили выводы Grubb экспериментально, проследив характер наследования Lea и Leb в семьях и показав, что антигены Lewis не относятся к рецессивным признакам, а как все другие групповые антигены крови наследуются кодоминантно (Ceppellini, Siniscalco [55]; Ceppellini и соавт. [54], Lamm и соавт. [138], Andresen и соавт. [18], Jordal [123], Greenwalt [87]).
Длительное время оставался непонятным тот факт, что некоторые сыворотки awra-Leb проявляют высокую активность только в том случае, если эритроциты, взятые для исследования, имеют группу О или А2 [92, 166, 201]. Другие сыворотки aHTH-Leb, как установил Brendemoen [40], лучше выявляют Leb в эритроцитах Аг Упомянутые категории анти^еь-антител более подробно будут рассмотрены ниже.
В настоящее время сформировалась стройная концепция системы Lewis, сформулированная Grubb [92], Ceppellini [53], Ceppellini и соавт. [54], Race и Sanger [197] и существенно дополненная современными молекулярно-биологическим исследованиями Schenkel-Brunner [203]. Суть ее заключается в том, гены Lewis относятся к системе секреторных генов, запускающих синтез соответствующих олигосахаридов в плазме и других жидкостях организма. Адсорбция олигосаха-ридов Lewis на эритроцитах - вторичный процесс.
Согласно этой концепции, поддерживаемой многими исследователями, гены Le и Se тесно взаимодействуют, но вместе с тем друг с другом не сцеплены (табл. 9.4).
В частности, при комбинации как минимум одного гена Le и одного Se индивиды являются выделителями субстанций АВН и Lewis и имеют фенотип Le(a-b+c-d-).
Таблица 9.4
Антигены Lewis в слюне и на эритроцитах у лиц с различными комбинациями генов Lewis и Секреции
|
Генотип |
Наличие в слюне субстанций |
Фенотип эритроцитов |
||||||
|
Lewis |
Se |
АВ |
Н |
Lea |
Leb |
Led |
Le° |
|
|
Le/Le или Le/le |
Se/Se или Se/se |
+ |
+ |
+ |
+ |
— |
' — |
Le(a-b+c-d-) |
|
Le/Le или Le/le |
se/se |
— |
— |
1 |
— |
— |
— |
Le(a+b-c-d-) |
|
le/le |
Se/Se или Se/se |
+ |
|
— |
Le"bH |
+ цепи типа 1Н |
— |
Le(a-b-c-d+) |
|
lese/lese |
sese/sese |
— |
— |
— |
— |
— |
+ цепи типа 1 |
Le(a-b-c+d-) |
В отсутствие гена Se (комбинация Le/se) АВН-субстанций не выделяются, но сохраняется секреция вещества Lea. Фенотип таких индивидов Le(a+b-c-d~).
При наличии гена Se и отсутствии Le (комбинация le/Se) индивиды имеют фенотип Le(a-b-c-d+), выделяют АВН-субстанций и некоторое количество субстанции LebH, структурно близкой к веществам Н и Led.
Антиген Lec обнаруживают на эритроцитах, если индивид не имеет генов Se и /^(комбинация le/se). В этом случае антигены АВН и Lewis не вырабатываются и прекурсорная субстанция, представляющая собой олигосахаридные цепи 1 типа, присутствует в секретах в чистом (не измененном) виде.
Анализируя табл. 9.4 можно сделать вывод, что Lea и Leb являются продуктом генов Le,se и Le,Se9 a Lec и Led - продуктом генов le.se и lefSe. Graham и соавт. [86] убедительно показали, что это не так. Их рассуждение сводилось к следующему: если продукция Lea и Lec обусловлена геном Le и le в отсутствие гена Se9 a Leb и Led - геном Le и le в присутствии Se9 то лица, гетерозиготные по Le и le несекреторы, должны иметь эритроциты Le(a+b-c+d-), а лица, гетерозиготные по Le и le секреторы, должны иметь эритроциты Le(a-b+c~d+). Однако при исследовании эритроцитов 98 взрослых лиц авторы нашли только по одному из 4 антигенов на каждом образце эритроцитов: Lea, или Leb, или Lec, или Led. Результаты эксперимента свидетельствовали о том, что Lec и Led действительно вырабатываются в отсутствие гена Le, но без какого-либо участия гена le.
Предполагается, что при отсутствии гена Le активность гена Se в секреторных клетках возрастает, в результате чего синтезируется больше олигосахарид-ных цепей 1Н-типа, т. е. антигена Led, а при отсутствии генов Le и Se (у лиц lese/lese) прекурсорные олигосахаридные цепи 1 типа остаются без изменения. Именно эти структуры (цепи 1 типа) распознаются анти-Ьес-антителами.
Таким образом, при очевидной фенотипической связи антигенов Lea, Leb и Led, Lec их генетическая связь подтверждения пока не находит.
Некоторые авторы полагают, что обозначение антигенных структур, выявляемых антителами анти-Ьеёи анти-Ьес, символом Le(d+) и Ье(с+)не соответствует существующим правилам, поскольку ген Lewis не имеет отношения к синтезу этих антигенов [115].
Высказывались предложения взамен обозначения Led использовать термин "Н тип Г
Антигены системы Lewis (Левис) не являются эритроцитарными, а адсорбируются на эритроцитах из плазмы крови. Они тесно связаны с секрецией групповых антигенов в жидкостях организма и опосредованно влияют на экспрессию групповых антигенов АВО. Именно эта особенность системы Lewis привлекает внимание трансфузиологов, судебных медиков, антропологов, медицинских генетиков и других специалистов.
История открытия
Приоритет открытия групп крови системы Lewis принадлежит Mourant [176]. В 1946 г. он нашел антитела у женщины по фамилии Lewis, названные aHTH-Lea. Антиген Lea, выявляемый с их помощью, встречается примерно у 22 % европейцев и подобно другим групповым антигенам крови передается по наследству.
Двумя годами позже Andresen [17] нашел антитела, которые агглютинировали эритроциты Le(a-), но не реагировали с эритроцитами Le(a+) и обозначил их anra-Leb, полагая, что они выявляют антиген Leb, антитетичный Lea.
Как отмечают Race и Sanger [197], а также Issitt и Anstee [115], антиген Lea был обнаружен в 1939 г. японцами Ейяма и Фурухата (Ueyama [229, 230], Furuhata, Ueyama [80]). Авторы установили, что сыворотки кур дают положительную реакцию преципитации со слюной несекреторов АВН-субстанций, т. е. лиц Le(a+), и обозначили антиген слюны, вызвавший реакцию, буквой Т. Как теперь известно, сыворотки кур содержат естественные антитела против вещества Lewis, а слюна людей несекреторов АВН богата веществом Lea.
В настоящее время установлено, что Lea и Leb не являются антитетичными антигенами, а гены, инициирующие их продукцию, не являются аллельны-ми [115, 197, 203]. Антиген Lea вырабатывается у людей, которые унаследовали от родителей комбинацию двух генов: Le и se (Lewis и несекреции). Такие люди имеют фенотип Le(a+b-) и не секретируют АВН-субстанций.
Люди, унаследовавшие гены Le и Se (Lewis и секреции), вырабатывают антиген Leb и являются АВН-секреторами.
Таким образом, антигены Lea и Leb не имеют соответствующих генов Lea и Leb, как антигены А, В или Rh-Hr, а контролируются одним геном Le.
Ген Le в присутствии гена se кодирует ^е^-генспецифическую фукозилтрансфе-разу, осуществляющую синтез вещества Lea, а в присутствии гена Se кодирует Ze&-генспецифическую фукозилтрансферазу, осуществляющую синтез вещества Leb.
На формирование антигенов Lea и Leb, а также антигенов, причисленных к системе Lewis в качестве коллекции - Led, Lec, AjLeb и других, большое влияние оказывают гены АВО и Н.
Гены Lele (Lewis), Sese (секреции), АВО (групп крови) и Hh (прекурсорных структур) тесно взаимодействуют друг с другом в процессе синтеза антигенов указанных систем, в результате чего антигены Lewis, АВО и Н, присутствующие на клеточных элементах крови (эритроцитах, лейкоцитах, тромбоцитах), а также в жидкостях организма человека, представляют собой структурно родственную группу.
Аллелем гена Le считается le - молчащий ген. Лица le/le не вырабатывают антигенов Lea и Leb и имеют фенотип Le(a-b-).
Третий антиген - Led, имеющий отношение к системе Lewis, обнаружен М.И. Потаповым [8, 10]. Антитела aHTH-Led были получены им иммунизацией коз слюной лиц OLe(a-b+) выделителей. Козьи сыворотки после адсорбции эритроцитами OLe(a+b~) содержали сильные антитела aHra-Leb, агглютинирующие эритроциты Le(a-b+), и одновременно антитела, реагирующие с эритроцитами Le(a-b-), однако не со всеми. Реакцию наблюдали только с эритроцитами лиц Le(a-b-) невыделителей. С эритроцитами Le(a-b-) выделителей антитела не реагировали. На основании полученных данных М. И. Потапов не только открыл новый антиген, названный им Led, но и пришел к вполне обоснованному заключению о существовании четвертого антигена системы Lewis - Lec, который следует искать на эритроцитах Le(a-b-) выделителей группоспецифических субстанций.
Вскоре после этого антитела atirra-Lec именно с такой серологической характеристикой были обнаружены Gunson и Latham [95] в сыворотке женщины, имевшей в анамнезе 1 трансфузию и 4 беременности, а годом позже такие же анти-Еес-антитела получил М.И. Потапов [7, 9], иммунизируя коз слюной лиц Le(a-b-) невыделителей.
Поскольку антигены Led и Lec присутствуют на эритроцитах, лишенных Lea и Leb, т. е. фенотипически с ними связаны, их относят к коллекции Lewis-отрицательных [Le(a-b-)] эритроцитов.
Andresen и Jordal [19,122,123] описали антитела airra-Lex. Эти антитела реагируют как с эритроцитами Le(a+), так и Le(b+) и представляют собой комбинацию антител airra-Lea+Leb, которую, однако, не удается разделить дифференциальной адсорбцией эритроцитами Le(a+b~) и Le(a-b+). Считается (Jordal [122]), что антитела anra-Lex (anra-Lea+Leb) выявляют антиген Lex, присутствующий на эритроцитах новоровденных, а последние, как известно, лишены антигенов Lea и Leb [15,39, 122,124]. Действительно, эритроциты новорожденных агглютинируются всеми сыворотками anra-Lex, но в то же время практически не реагируют с моноспецифическими сыворотками анти-Le3 и aHTH-Leb, за исключением очень активных сывороток анти-Le3, используемых в непрямой антиглобулиновой пробе [122,218].
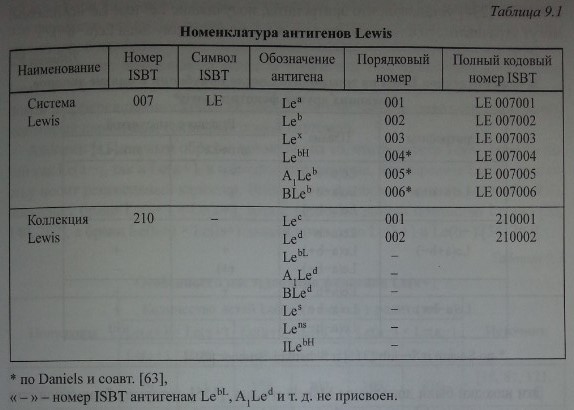
К настоящему времени известно 14 антигенов Lewis (табл. 9.1), 6 из которых (Lea, Leb, Lex, LebH, AjLeb и BLeb) составляют собственно систему Lewis, 8 (Led, Lec, LebL, AjLe*1, BLed, Les, Lens и ILebH) условно отнесены к ней как коллекция.
Номенклатура антигенов Lewis
Полиморфизм антигенов Lu обусловлен молекулярными заменами (табл. 8.7).
Таблица 8.7
Молекулярная основа антигенов Lutheran
|
Антигенные различия |
Замена аминокислот |
Экзон |
Замена кодонов |
|
Lua/Lub |
His 77 Arg |
3 |
A230G |
|
Lu4+/Lu4- |
Arg 175 Gin |
5 |
G524A |
|
Lu5+/Lu5- |
; Arg 109 His |
' 3 |
1 G326A |
|
Lu6/Lu9 |
Ser 275 Phe |
I 7 I |
C824T |
|
Lu8/Lul4 |
Met 204 Lys |
6 |
T611A |
|
Lul2+/Lul2- |
Arg 34 и делеция Leu 35 |
2 |
99 делеция GCGCTT |
|
Lul3+/Lul3- |
Ser 447 Leu; Gin 581 Leu |
11,13 |
С 1340 T, A 1742 T |
|
Lul6+/Lul6- |
Arg 227 Cys |
6 |
C679T |
|
Lul7+/Lul7- |
Glu 114 Lys |
3 |
G340A |
|
Aua/Aub |
Ala 539 Thr |
12 |
G1615A |
|
Lu20+/Lu20- |
Thr 302 Met |
7 |
C905T |
|
Lu21+/Lu21- |
Asp 94 Glu |
з i |
С 282 G |
Действие ферментов
Антигены Lutheran разрушаются трипсином и а-химотрипсином. Папаин оказывает на них слабое редуцирующее действие. Моноклональные антитела aHTH-Lub не агглютинируют эритроциты, обработанные эндогликозидазой F, отщепляющей N-связанные олигосахариды, однако адсорбируются на модифицированных этим ферментом клетках и освобождаются при элюции (Parsons и соавт. [106]). Сульфгидрильные редуценты разрушают антигены Lutheran, что указывает на наличие в их структуре дисульфидных связей (Daniels [36], Levene и соавт. [81], Parsons и соавт. [106]).
Распределение в тканях, значение в биологии человека
Гликопротеины Lutheran широко представлены в тканях организма человека. Они обнаруживаются в печени с первых месяцев внутриутробного развития. Их находят в плаценте, стенках артерий различных органов, включая язык, миндалины, трахею, пищевод, желудок, желчный пузырь, слепую и толстую кишки, кожу (Parsons и соавт. [105]). Транскрипты гена LU выявлены во всех изучавшихся тканях. Транскрипт размером 2,5 кб, кодирующий гликопротеиновый изомер с мол. масс. 85 кДа, не был выявлен только в клетках карциномы тол-стой кишки человека (Rahuel и соавт. [115]).
Гликопротеины Lutheran относят к семейству рецепторов адгезии и передачи межклеточных сигналов (Barclay и соавт. [7], Williams, Barclay [147]). Организация SF-доменов гликопротеина Lutheran (V-V-C2-C2-C2) идентична таковой маркера прогрессии меланомы [MUC18 (CD 146)]. Цитоплазматический домен изоформы 85 кДа содержит 8НЗ-связывающий мотив и 5 потенциальных участков фосфори-лирования, которые, по-видимому, выполняют функцию передачи сигналов в межклеточном взаимодействии (Parsons и соавт. [103,105], El Nemer и соавт. [48]).
Экстрацеллюлярные гликопротеины представлены ламинином, присутствующим во всех базальных мембранах. Он состоит из а-, 0- и у-цепей, контролируемых различными генами (Ayad и соавт. [5]). Предполагается существование 12 изоформ ламинина, образуемых 5 типами а-цепей, 3 типами (3-цепей и 3 типами у-цепей. Гликопротеины Lutheran связывали ламинин в иммуноблоттин-ге и иммунопреципитации моноклональными антителами (Udani и соавт. [144]). Эритроциты лиц Lunull рецессивного типа, которые не содержат гликопротеинов Lutheran, ламинин не связывали.
Изоформы гликопротеина 78 и 85 кДа одинаково связывают ламинин (Е1 Nemer и соавт. [50], Zen и соавт. [155]). Трансфекция человеческих и мьппиных эритролейкемических клеточных линий кДНК LUприводила к связыванию клетками растворимых и иммобилизированных форм ламинина (El Nemer и соавт. [50], Parsons и соавт. [103], Udani и соавт. [144]). Гликопротеин Lutheran специфически и с высокой аффинностью связывался с изоформами ламинина, содержавшими а5-цепи (Parsons и соавт. [103]). В экспериментах со связыванием ламинина различными изоформами гликопротеина Lu, в которых отсутствовали определенные домены, получены противоречивые данные. В одних случаях в связьшании ламинина участвовали терминальные N-домены (El Nemer и соавт. [49], Parsons и соавт. [103]), в других случаях -IgSF-домен 5 (Zen и соавт. [155]). Возможно гликопротеин Lutheran имеет 2 участка для связывания ламинина.
Отмечено, что на эритроцитах больных серповидно-клеточной анемией концентрация гликопротеина Lu на 67 % выше, чем у здоровых, и эритроциты больных связывают большее количество ламинина (El Nemer и соавт. [50], [144, 155]). Адгезивные свойства таких эритроцитов повышаются. Прилипая к эндотелию кровеносных сосудов, они вызывают окклюзии, характерные для патогенеза серповидно-клеточной анемии.
Моделирование эритропоэза in vitro показало, что гликопротеины Lu появляются на эритроидных клетках позже протеина полосы 3 и Rh-протеина, приблизительно на стадии ортохроматических эритробластов (Bony и соавт. [10], Daniels, Green [37], Henke и соавт. [68], Southcott и соавт. [131]). Появление гликопротеинов Lu коррелирует со способностью связывать ламинин (El Nemer и соавт. [50]).
Parsons и соавт. [105,107] полагают, что вещество Lu способствует миграции эритроидных предшественников из печени плода в костный мозг.
У мышей обнаружен ген, кодирующий протеин, гомологичный на 72 % лами-нинсвязывающему белку человека (Parsons и соавт. [103], Rahuel и соавт. [114]).
Помимо антигенов Lua, Lub и Lu3 в систему Lutheran входят 16 других антигенов: 12 часто встречающихся, 2 редко встречающихся и 2 с частотой 50-80 % (см. табл. 8.1). Шесть из них являются продуктами аллельных генов и образуют антитетичные пары: Lu6 и Lu9, Lu8 и Lul4, Aua и Aub. Антигены Lu4, Lu5, Lu7, Lul2, Lul3, Lu20 и Lu21 отсутствуют на эритроцитах Lunull.
Антигены Lutheran локализуются в основном на гликопротеине Lu, многие слабо экспрессированы на эритроцитах новорожденных, не имеют рекомбинаций и кроссинговера (Daniels и соавт. [33, 38], Levene и соавт. [80], Parsons и соавт. [104], Reid и соавт. [116]).
Локализация детерминант Lull, Lul6 и Lul7 на гликопротеине Lu не доказана, поэтому по отношению к ним используют обозначение «пара-Lutheran».
Антигены Lull, Lul6 и Lul7 отсутствуют на эритроцитах Lunull и In(Lu) рецессивного типа. Антиген Lul7 присутствует на эритроцитах Lu „ Х-ассоциированного типа.
Большинство антител Lutheran не вызывает гемолитических осложнений и ГБН.
Lu4
Bove и соавт. [12] нашли единственный образец антител airra-Lu4. Двое сибсов белой женщины группы Lu:-4, у которой были выявлены антитела, также имели фенотип Lu:-4. Все лица, кровь которых исследована с использованием указанной сыворотки (2700 человек, преимущественно доноров), имели фенотип Lu4+.
Антиген Lu4 размещается на втором IgSF-домене гликопротеина Lu (см. рис. 8.1).
Lu5
О выявлении антител к антигенам Lu5, Lu6 и Lu7 сообщил Marsh [87] на одном из рабочих совещаний Американской ассоциации банков крови.
Bowen и соавт. [13], Crawford [26], Marsh [87], Smart и соавт. [130] идентифицировали более 10 образцов антител анти-Ьи5. Эти антитела присутствовали как у европеоидов, так и у негроидов. При обследовании 423 неродственных лиц, преимущественно доноров европейцев, не было найдено ни одного с фенотипом Lu:-5 (Marsh [87]). Подобно антигенам Lua и Lub, антигенные участки Lu5 располагаются в N-терминальном домене IgSF гликопротеина Lu (Parsons и соавт. [104]) (см. рис. 8.1).
Lu6 и Lu9
Антигены Lu6 и Lu9 имеют высокую и низкую частоту соответственно, проявляют себя в серологических реакциях как продукты аллельных генов.
Антитела анти-Ьиб обнаружил Marsh [87]. Позднее появились другие сообщения о выявлении антител указанной специфичности (Dybkjaer и соавт. [47], Ellis и соавт. [52], Gibson и соавт. [56], Herron и соавт. [69], Issitt и соавт. [73], Wrobel и соавт. [151]).
Антиген Lu6 отсутствует на эритроцитах Lu u всех трех указанных выше типов (Marsh [87], Norman и соавт. [101]).
При исследовании выживаемости несовместимых эритроцитов, введенных сен-сибижзированным реципиентам, установлено, что антитела aHra-Lu6 клинического значения не имеют (Ellis и соавт. [52], Gibson и соавт. [56]). Аналогичные исследования, проведенные у пожилой женщины, имевшей антитела анти-Ьиб IgGl-субкласса, напротив, свидетельствовали об их способность вызвать разрушение эритроцитов in vivo. Этой больной были успешно перелиты эритроциты Lunull.
По наблюдениям Herron и соавт. [69], эритроциты ребенка, родившегося у женщины, которая имела высокоактивные антитела anra-Lu6, давали отрицательную прямую пробу Кумбса; в сыворотке крови ребенка указанные антитела отсутствовали. Очевидно, антитела anra-Lu6 оказались не способны преодолеть плацентарный барьер.
Molthan и соавт. [96] выявили антитела anra-Lu9 у родильницы одновременно с антителами airra-Lua. Антитела обнаружили с помощью прямой пробы Кумбса с эритроцитами всех трех ее новорожденных, однако каких-либо клинических проявлений ГБН не наблюдали. Отец детей имел фенотип Lu: 1,2,9. Исследование семьи показало, что антиген Lu9 контролируется локусом LU, хотя последний не являлся аллелем Lua и Lub. Среди 521 обследованного этой сывороткой 1,7 % имели антиген Lu9.
Еще один образец антител aHTH-Lu9 был найден у женщины, получившей множественные гемотрансфузии (Champagne и соавт. [21]).
Эритроциты выявленного Marsh [87] индивида Lu:-6, его сибсов, а также эритроциты другого из найденных лиц Lu:-6 реагировали с антителами анти-Ьи9. Это послужило доказательством того, что антигены Lu6 и Lu9 антитетичны и являются продуктами аллельных генов Lu6uLu9.
Эритроциты Lunull всех трех типов были Lu:-6,-9. Описана семья, в которой один индивид Lu:-6 (вероятно Lu6/Lu6) имел слабый антиген Lu9, а эритроциты других его родственников (L^/Lu9) интенсивно реагировали с антителами анти-Ьи9. Антиген Lub у всех членов данной семьи был выражен нормально. Угнетение экспрессии антигена Lu9 в данной семье осталось без объяснения (Daniels [34]).
Полагают, что эпитопы Lu9 находятся на четвертом IgSF-домене гликопротеина Lutheran (Parsons и соавт. [104]).1).
Lu7
Антитела анти-Ьи7 субкласса IgG3 были найдены Marsh [87] у женщины Lu:-l,2,-7. Прямая проба Кумбса с эритроцитами родившегося у нее ребенка была отрицательная. Среди 285 обследованных доноров европейцев не оказалось ни одного Lu:-7 (Marsh [87]). Так же как и Lu9, антигенные эпитопы Lu7 находятся на четвертом IgSF-домене гликопротеина Lutheran (Parsons и соавт. [104]) (см. рис. 8.1).
Lu8 и Lul4
Антитела airra-Lu8 обнаружены МасШгоу и соавт. [83] в 1972 г. Позднее были описаны другие образцы антител этой специфичности (Kobuszewski и соавт. [78], Shirey и соавт. [126], Watt и соавт. [146]). Один из них показал положительные реакции в пробе с монослоем моноцитов и, очевидно, явился причиной умеренно выраженной посттрансфузионной реакции (Kobuszewski и соавт. [78]).
Антигенные эпитопы Lu8 находятся на втором IgSF-домене гликопротеина Lutheran (Parsons и соавт. [104]) (см. рис. 8.1).
В 1977 г. Judd и соавт. [74] описали антитела у женщины, получившей гемотрансфузии и сеансы гемодиализа. Антитела реагировали с эритроцитами 14 из 580 доноров (2,4 %). Их обозначили aHTH-Lul4. Они реагировали с эритроцитами трех неродственных лиц Lu:-8, что дало основание считать антигены Lu8 и Lul4 антитетичными. Антиген Lul4 чаще присутствовал у лиц Lu(a-b+), чем у лиц Lu(a+b+), что дало основание предполагать аллельные взаимоотношения контролирующих генов. Моноклональные антитела aHra-Lub реагировали более интенсивно с эритроцитами Lu:14 по сравнению с эритроцитами Lu:-14 (Zelinski и соавт. [153]).
Cantrell и соавт. [19], Marsh и соавт. [90], Crawford [26] выявили много других образцов анти-Lu 14-антител. В одном случае антитела анти-Lu 14 класса IgG имели естественное происхождение.
Частота антигена Lul4 среди 610 датских и 600 английских доноров составила 1,5 и 1,8 % соответственно.
Lul2
Первый образец антител анти-Ьи12 был выявлен Sinclair и соавт. [128] у женщины польско-украинского происхождения. Ее эритроциты были Lu(a-b+w), антиген Lub был слабо выражен. Эритроциты ее отца содержали слабый антиген Lul2, ее сестра имела фенотип Lu(a-b+w) со слабо выраженным Lub. Другие антигены Lutheran на эритроцитах женщины были выражены слабо. При обследование семьи выявлена рекомбинация генов, контролирующих антиген Lul2 и выделительство групповых субстанций АВН. Вероятность того, что синтез антигена Lul2 находится под контролем гена LU, составила 9:1.
Эритроциты всех 1050 канадских доноров, исследованные с помощью сыворотки анти-Ьи12, дали положительную реакцию. В одном случае реакция была слабо выражена: донор имел фенотип Lu(a-b+w).
Второй образец антител анти-Lu 12 был найден у женщины белой расы с фенотипом Lu:-12. Двое ее сибсов также имели группу Lu:-12 (Shirey и соавт. [127]). В экспериментах по выживаемости эритроцитов in vivo указанные антитела вызывали ускоренное разрушение эритроцитов Lul2.
Локализация антигенных эпитопов Lul2 на гликопротеине Lutheran точно не установлена. Результаты иммунопреципитации специфическими антителами позволили предположить, что участок Lul2, вероятно, расположен вблизи Lub, на первом IgSF-домене гликопротеина Lutheran (Parsons и соавт. [104]) (см. рис. 8.1).
Lul3
Сообщение о выявлении первого образца антител анти-Lu 13 (антител Hughes) не было опубликовано. Второй образец антител этой специфичности был выявлен у финской женщины, однако исследовать ее эритроциты с антителами Hughes не удалось (Sistonen и соавт. [129]). В этой финской семье, помимо пропозиты, трое сибсов имели фенотип Lu:-13 (Marsh и соавт. [88]).
Установлено (Parsons и соавт. [104]), что эпитопы Lul3 находятся на пятом IgSF-домене гликопротеина Lutheran (см. рис. 8.1).
АиаиАиь^
Антигены Auberger (Оберже*) - Aua (LU18) и Aub (LU19) - представляют четвертую пару антитетичных антигенов системы Lutheran. В течение многих лет антиген Аиа рассматривали как фактор, представляющий самостоятельную групповую систему независимую от локуса LU. Основанием для этого служило описание семьи, в которой была обнаружена рекомбинация генов Аиаи Lua (Salmon и соавт. [120]). При повторном обследовании указанной семьи сыворотками анти-Аиа и анти-Аиь выявлена неточность первоначального заключения. Напротив, полученные данные указывали на связь антигенов Auberger и Lutheran (Daniels и соавт. [39]). Синтез указанных антигенов
I В английской фонетике правильным считается произношение Обэджи, но не Аубергер (Issitt, Anstee [72]), в русской фонетике В Оберже (П.Н. Косяков [2], М.А. Умнова [1]).
контролировал один и тот же ген (Zelinski и соавт. [153]). Эритроциты лиц Lunull имеют фенотип Au(a-b-) (Crawford и соавт. [28], Frandson и соавт. [54], Norman и соавт. [101]).
Первый образец антител анти-Аиа был идентифицирован в 1961 г. Salmon и соавт. [121]. Миссис Auberger получала многократные гемотрансфузии, в сыворотке ее крови содержались также антитела анти-Е, анти-К, aHra-Fyb и HLA.
Drachmann и соавт. [42], Race и Sanger [113] сообщили о выявлении двух образцов анти-Аиа-антител, при этом обе сыворотки содержали другие антиэри-троцитарные антитела.
Антитела анти-Аиь, открывающие антиген Aub, антитетичный Аиа, были описаны в 1989 г. Frandson и соавт. [54], сыворотка содержала также анти-1д1а-антитела. Вскоре были найдены 3 другие сыворотки анти-Аиь, во всех сыворотках также содержались антитела анти-Lu3 (Moulds и соавт. [98]).
Антиген Аиа имеет частоту 80-90 %, Aub - 50 % среди европеоидов, 68 % среди негроидов (Frandson и соавт. [54]). Частота генов и фенотипов Auberger приведена в табл. 8.6.
Таблица 8.6
Частота генов и фенотипов Оберже
|
Жители |
Число исследованных с фенотипом |
Частота генов |
||||
|
Аи(а+) |
Аи(а-) |
Au(b+) |
Au(b-) |
Аиа |
Аиь |
|
|
Парижа |
315 |
74 |
|
|
0,5638 |
0,4362 |
|
Лондона |
|
24 |
ta*112 |
tifc108 |
0,6065 |
0,3935 |
|
Копенгагена |
362 |
38 |
|
|
0,6918 |
0,3082 |
|
Негры США |
|
|
59 |
28 |
0,5673 |
0,4327 |
Методами иммунопреципитации и иммуноблоттинга показана локализация антигенных эпитопов Аиа и Aub на гликопротеине Lutheran, Aub локализованы на самом близком к поверхности мембраны IgSF-домене (Parsons и соавт. [104]). Секвенирование экзонов 11 и 12 гена LU выявило в последнем точко-вую мутацию А 1637 G, приводящую к замене аминокислот в положении 539. Антигенные различия Aua/Aub обусловлены присутствием в позиции 539 треонина (Аиа) или аланина (Aub) (Parsons и соавт. [104]).
Lu20
Антитела aHTH-Lu20 были найдены Levene и соавт. [80] в сыворотке больного талассемией, получавшего многократные гемотрансфузии. Помимо указанных антител сыворотка больного содержала антитела анти-С, анти-К и анти-Fyb. Наследование гена LU20 в семьях не было прослежено.
arsons и соавт. [104]) установили, что антигенные эпитопы Lu20 располага-тся на третьем IgSF-домене гликопротеина Lutheran (см. рис. 8.1).
Lu21
Первые данные о выявлении антител против еще одного часто встречающегося антигена системы Lutheran (Lu21), появились в 2002 г.; результаты исследования опубликованы в 2004 г. (Katamatic Crew и соавт. [76]). Подобно другим антигенам системы Lutheran Lu21 был слабо выражен на эритроцитах новорожденных и отсутствовал на эритроцитах Lu всех трех типов.
Секвенирование локуса LU сенсибилизированной женщины Lu:-21, цинственной носительницы aHTH-Lu21 -антител, выявило гомозиготность о точковой мутации С 282 в экзоне 3, ведущей к аминокислотной замене sp 4 Glu. Антитела aHTH-Lu21 не вызвали ГБН ни у одного из четырех де-ей указанной женщины, несмотря на то, что их эритроциты содержали антиген Lu21.
I Пара-Lutheran
К указанной группе антигенов относят Lull, Lul6 и Lul7.
Антитела анти-Lull, обнаруженные Gralnic и соавт. [59] у женщины европейки, реагировали положительно с эритроцитами 500 обследованных доноров. Позднее было найдено еще 2 образца антител со специфичностью анти-Lull (Crawford [26]).
Антитела анти-Lu 16 были обнаружены Sabo и соавт. [119] вместе с анти-Lub у негритянки, имевшей фенотип Lu(a+b-). Результаты обследования ее семьи не позволили судить о характере наследования гена, контролирующего синтез Lu 16.
Единственный образец антител anra-Lul7 был выявлен Turner [143] у итальянской женщины. Антитела укорачивали продолжительность жизни эритро-
цитов Lu:17 в тестах in vivo (Heddle, Moorphy [67]). шНаряду с антителами анти-Lull, -Lul6 и -Lul7 были описаны антитела, которые идентифицировали часто встречающиеся антигены, напоминавшие по воим серологическим параметрам пара-Lutheran. Однако окончательного за-ючения по этим находкам не сделано.
Описан редко встречающийся антиген «Singleton». Полагали, что он нахо-|игся в антитетичной связи с Lu5 и присвоили ему обозначение LulO. Однако исследования остались незавершенными, в связи с чем антиген Singleton исключен из системы Lutheran, и обозначение LulO более не используют.
В 1986 г. Norman и соавт. [101] обследовали большую австралийскую семью (рис. 8.4), пятеро членов которой имели фенотип Lunull с характеристиками как рецессивного, так и доминантного типа. Эритроциты типировались как Lu(a-b-), слабо адсорбировали анти-Ьиь-антитела, содержали антиген AnWj; экспрессия антигена i была повышена. Экспрессия антигена Р1 была слабой, хотя это могло быть обусловлено присутствием слабого гена Р1 в данной семье.
Х-сцепленное наследование Lu [101]. Темными фигурами обозначены лица Lu(a-b-), светлыми - Lu(a-b+). Все лица Lu ц - мужчины (XS2/Y), унаследовавшие ген XS2 от своих матерей, являющихся гетерозиготами XS2/XS1.
Особенностью обнаруженного варианта Lunu являлось наследование инициирующего гена. Возникновение фенотипа Lu в указанной семье не могло быть обусловлено геном In(Lu), поскольку родители троих лиц Lu имели группу Lu(a-b+). Возможную гомозиготность по рецессивному гену Lu также исключили, поскольку в этом случае ген Lu должен был иметься одновременно у 5 различных неродственных лиц, что представляется маловероятным. Характер наследования гена указы-
вал на его рецессивный тип, ассоциированный с Х-хромосомой. Все лица Lunull были мужчинами, среди представителей следующего поколения не было лиц указанного фенотипа (см. рис. 8.4). Регуляторный локус был маркирован как XS, обычный часто
встречающийся аллель - XS1, а редкий ингибиторный, вызывающий супрессию генов LU, -XS2. В данной семье мужчины с фенотипом Lunull были гемизиготными по ингибиторному аллелю (XS2/Y), женщины - гетерозиготными (XS1/XS2).
Williamson и соавт. [148] привели случай аутоиммунной тромбоцитопении у мужчины, временно утратившего антигены Kell и имевшего антитела анти-Ku (KEL5). Его эритроциты нормально экспрессировали антигены Lua, Lub и антиген LWa системы LW. Через год экспрессия антигенов Kell нормализовалась, анти-Ku-антитела исчезли, однако имела место утрата антигенов Lutheran, а сыворотка крови содержала антитела анти-ЬиЗ. Экспрессия антигена LWa резко снизилась.
Poole и соавт. [111] наблюдали еще одого больного группы Lu(a-b+) с аутоиммунной тромбоцитопенической пурпурой. В течение заболевания его фенотип сменился на Lu(a-b-), экспрессия антигенов AnWj и LW оставалась нормальной. Сыворотка крови содержала анти-Ьи-подобные антитела.



![Х-сцепленное наследование Lu [101]. Темными фигурами обозначены лица Lu(a-b-), светлыми - Lu(a-b+). Все лица Lu ц - мужчины (XS2/Y), унаследовавшие ген XS2 от своих матерей, являющихся гетерозиготами XS2/XS1.](/images/stories/stat/aa9.jpg)

