Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система MNS
Подсистема Мильтенбергер представляет собой серию редких антигенов и фенотипов, ассоциированных с антигенами системы MNS и друг с другом. Антитела, реагирующие с антигенами подсистемы, иногда дают перекрестные реакции (Chandanyingyong и соавт. [36-38], Giles и соавт. [84]).
Систематизация антигенов Мильтенбергер начата в 1966 г. с выделения первых четырех классов антигенов, вошедших в указанную подсистему (Cleghorn [44]). В последующие десятилетия идентифицировано еще 7 классов подсистемы (Akane и соавт. [10], Anstee и соавт. [16], Blackall и соавт. [25], Blanchard и соавт. [27], Broadberry и соавт. [32, 33], Chandanayingyong и соавт. [36-38], Crossland и соавт. [51], Dahr [53], Giles и соавт. [84], Johe и соавт. [121], Langley и соавт. [141], Skov и соавт. [229], Vengelen-Tyler и соавт. [254],
Webb и соавт. [258]).
Редкие антигены, входящие в подсистему, присутствовали преимущественно у монголоидов (Akane и соавт. [10], Baldwin и соавт. [19], Judd и соавт. [125], Konugres и соавт. [131], Kornstad и соавт. [132], Lewis и соавт. [146], Lin и соавт. [147], Lin-Chu и соавт. [148], Metaxas-Buhler и соавт. [163], Nguen ТЫ Huingh и соавт. [174]).
Выделение классов в подсистеме Мильтенбергер основывалось на различиях, улавливаемых серологическими методами, другие методы исследования в те годы не применяли. В настоящее время ряд специалистов считают способ обозначения антигенов Мильтенбергер устаревшим и не находят целесообразным выделение в ней новых классов (Dahr [53], Reid и соавт. [209], Tippett и соавт. [247]). Предложен другой способ обозначения гликофоринов: после аббревиатуры GP пишут сокращенное имя первого пробанда (табл. 6.6). Например, старое обозначение Mi.HI пишут как GP.Mur, обозначение GP(B-A-B)Mur соответствует варианту гликофорина, обозначение GYP(B-A-B)Mur - варианту гена, контролирующего фенотипические проявления (Reid и соавт. [209]).
Специфичность и экспрессия антигенов М и N обусловлена последовательностью аминокислот в пептидных цепях гликофорина А, а также характером гликозилирования 5 терминальных аминокислотных остатков.
Mg (Gilfeather)
Впервые редкий антиген Mg и антитела к нему описали Allen и соавт. в 1958 г. [11]. Эритроциты больного по фамилии Gilfeather агглютинировались сывороткой крови одного из доноров. Позднее лица, имеющие антиген Mg, были найдены среди представителей итальянской диаспоры в Швейцарии (обследовано 6530 доноров) и Бельгии (6300 обследованных) (Metaxas и соавт. [160, 161]). Интересно, что 3 из 4 итальянцев Mg+ были выходцами с острова Сицилия (Brocteur [34]). Двоих человек Mg+ выявили среди 9000 жителей Индии (Joshi и соавт. [123], двоих среди американцев (Winter и соавт. [264]). Несмотря на исключительную редкость гена Mg, найден 1 человек, гомозиготный по этому гену - Mg/Mg (Issitt и Anstee [113]).
Специфичность антигена Mg обусловлена валином в позиции 6 и метиони-ном в позиции 8 гликофорина А. Экспрессию антигена обеспечивает гибридный гликофорин GPAN(l-4)-GPB(5)-GPA(6-13). Характер мутации в контролирующем гене GYP(AN-B-A) окончательно не расшифрован {Furthmayr и соавт. [74], Green и соавт. [86], Reid, Lomas-Francis [202]).
Антитела анти-М и анти-N как ксеногенные (кроличьи), так и аллогенные (полученные от человека) с антигеном Mg не реагируют.
Эритроциты Mg+ несут еще 1 редко встречающийся антиген - DANE (MNS32). В противоположность исключительной редкости антигена М8 естественные антитела к нему встречаются очень часто: примерно в 1 случае на 70 образцов сывороток крови здоровых лиц. Большинство антител представляет собой IgM и непосредственно агглютинирует эритроциты в солевой среде. Анти-М8-антитела, относящиеся к IgG, проявляли активность при 37 °С в непрямом антиглобулиновом тесте. Трансфузионных реакций и ГБН, обусловленных анти-М8-антителами, не описано. Антитела анти-М8 были получены также иммунизацией кроликов (Ikin [108]).
Как и в случаях с Еп и Мк9 присутствие редкого гена Mg может привести к ошибкам при экспертизе спорного отцовства. У родителей Mg/M * N/N возможно рождение детей с генотипом щ Эритроциты таких лиц имеют группу
M-N+. Поскольку генотипы лиц с группами M+N- и M-N+ судебные медики обычно интерпретируют как М/Ми N/N, отцовство может быть ошибочно исключено (Прокоп, Геллер [7]).
Мс (Common)
Несмотря на то что антиген Мс внесен в номенклатуру ISBT под индексом MNS8, специфические антитела, распознающие его, не выделены. Этот антиген идентифицируют как промежуточный между М и N, поскольку он реагирует с определенными образцами антител анти-М и анти-N.
М° как редкий аллель MuN впервые обнаружен в 1953 г. у членов английской семьи. Эритроциты Мс+ агглютинировались большинством сывороток анти-М, в то время как с сыворотками анти-N реагировали редко (Figur и соавт. [70]). В результате посемейных исследований идентифицированы гаплотипы Mcs и MCS (Daniels [56]).
Характер реагирования эритроцитов Мс+ в серологических тестах удалось объяснить в 1981 г. McDougall и соавт. [156] и Furrthmayr и соавт. [74]. Исследователями была расшифрована последовательность аминокислот в терминальной части гликофорина А лиц Мс+. Оказалось, что в положении 1 присутствует серии (формирующий М-антиген), в то время как позицию 5 занимает глютаминовая кислота (формирующая N-антиген). Антиген Мс присущ особому гликофорину - GPAM(l-4)-GPB(5)-GPA(6-13), его синтез контролирует гибридный ген GYP(A-B-A).
Лица с фенотипом Мс выявлены только среди европеоидов. Поскольку специфические анти-Мс-антитела отсутствуют, соответственно нет данных о частоте этого антигена у европеоидов и представителей других рас.
Не (Henshaw)
Антиген получил свое обозначение по имени мужчины, у которого он был впервые обнаружен, - Henshaw. Антитела анти-Не были найдены как дополнительный компонент в иммунной кроличьей сыворотке анти-М. Позднее были получены моноспецифические сыворотки анти-Не иммунизацией кроликов эритроцитами Henshaw (Ikin и соавт. [109], MacDonald и соавт. [153]).
Marsh и соавт. [155] описали анти-Не-антитела аллогенного происхождения. Получено также несколько образцов моноклональных анти-Не-антител (Reid и соавт. [201], Rouger и соавт. [213]).
Антиген Не выявляли с частотой 2,0-3,08 % почти исключительно в негроидных популяциях (Nijenhuis и соавт. [175]). Ген Не в разных семьях был ассоциирован с разными гаплотипами: MS, Ms, Ns, однако в пределах одной семьи сцепление гена Не наблюдали с одним и тем же гаплотипом. Антиген Не антитетичен по отношению к антигену W (MNS30), имеющемуся почти у всех лиц S+ns+(Greenwalt [87]).
Антиген Не присутствует у 23-25 % лиц (исключительно негроидной расы), имеющих редкий фенотип S-s-Uvar+ (Francis и соавт. [71]). Эритроциты таких лиц содержат пониженное количество гликофорина В. Данных о клинической значимости антител анти-Не нет.
Вещество Не формируется под действием варианта гена GYPB, в котором короткий сегмент, включающий часть экзона 2 заменен гомологичным участком гена GYPA (Huang и соавт. [99]) (см. Гибридные гликофорины).
Ме
В 1961 г. Wiener и Rosenfield [260], изучая сыворотку, полученную от иммунизированного кролика, обнаружили, что, помимо М-положительных эритроцитов, она агглютинировала некоторые образцы N+. Последующие исследования показали, что эритроциты М-, реагирующие с антителами сыворотки содержали антиген Не. Антитела анти-М и анти-Не не удавалось разделить перекрестной адсорбцией. Позднее Levene и соавт. [143] нашли анти-М- и анти-Ме-антитела, которые могли быть разделены адсорбцией эритроцитами М+Не- и М-Не+.
Биохимические исследования позволили объяснить результаты серологических тестов. Антиген Не является продуктом аллелей S и s. Антиген М на гликофорине А детерминирован глицином в позиции 5. Вариант Ss-сиалогликопротеина, несущий антиген Не, детерминирован триптофаном в позиции 1. Моноклональные антитела анти-М, реагирующие с эритроцитами М-Не+, распознают глицин в положении 1. Некоторые образцы этих антител способны выявить глициновый остаток на гликофорине В в позиции 5 (Dahr и соавт. [52, 54, 55]). Фенотипически это выражается наличием антигена Не.
ENEV
Антитела, открывающие часто встречающийся антиген ENEV, описаны Lomas-Francis и соавт. [150] в 2005 г. Они найдены у больного с редким фенотипом MNS.-45. Молекулярно-генетическими исследованиями установлено, что обладатель антител был гомозиготным по точковой мутации, которая привела к замене валина на глицин в положении 81 внутри цепи гликофорина А. Данных о клиническом значении антител анти-ENEV нет.
MNTD
Антитела к редкому антигену MNTD выявлены в 2006 г. Uchikawa и соавт. [250] у здоровых лиц - японских доноров. Среди указанного контингента эти антитела встречались с частотой 0,02 % и, по-видимому, имели естественное происхождение. Молекулярно-генетическими исследованиями было показано, что лица MNTD+ являются гетерозиготами по точковой мутации внутри гена GYPA. Последняя приводит к замене треонина на аргинин в положении 36 внутри цепи гликофорина А.
Антиген U описали в 1953 г. Wiener и соавт. [262], обнаружившие соответствующие анти-и-антитела. Обозначение U (universal) было дано этому антигену из-за его универсальной встречаемости среди представителей разных рас. У 1 % негроидов этот антиген отсутствовал (Hoekstra и соавт. [95], Lowe и соавт. [152], Wiener и соавт. [262]).
В 1954 г. Wiener и соавт. [262] нашли 2-й образец антител анти-U. Серологические реакции показывали, что антиген, открываемый указанными антителами, ассоциирован с системой MNS. Все U-отрицательные лица не имели также антигенов S и s. Стало очевидным, что фактор U - еще один серологический продукт локуса Ss (Wiener и соавт. [262]).
Антитела анти-U имеют, как правило, иммунное происхождение и считаются клинически значимыми, поскольку были причиной как трансфузионных реакций, так и ГБН, в ряде случаев с летальным исходом (Giblett и соавт. [81], РШау [184], Rothman и соавт. [211, 212], Smith и соавт. [231], Taliano [242], Wiener и соавт. [262]).
В отличие от антител к антигенам М, N, S и s анти-и-антитела сохраняют свою активность и специфичность в тестах с энзимированными эритроцитами. Эффекта дозы у антигена U не отмечено (Issitt и соавт. [117]).
Лица, не имеющие антигена U (все фенотипы S-s-), встречаются почти исключительно в негроидных популяциях (Allen и соавт. [12], Francis и соавт. [71], Hoekstra и соавт. [95], Reid и соавт. [208], Sanger и соавт. [222], Wiener и соавт. [261]). Фенотип S-S-TJ- среди европеоидов регистрируют крайне редко (Moores и соавт. [168], Sondag-Thull и соавт. [232]). Примерно 42 % негроидов S-s- содержат слабый антиген U (Uvar), обнаруживаемый адсорбцией - элюцией (Allen и соавт. [12], Francis и соавт. [71], Reid и соавт. [208], Stony и соавт. [239]).
Проблема поиска совместимой крови для реципиентов с антителами анти-U актуальна для стран, где диаспора негроидов значительна по численности. Так, в США наиболее частыми запросами в регистр редких доноров Американского Красного Креста являются заявки на U-отрицательную кровь. Например, с сентября 1995 г. по август 1996 г. запросов на U-отрицательную кровь было почти в 4 раза больше, чем заявок на эритроциты редких фенотипов Vel- и Yt(a-) - 49 и 13 соответственно. При лечении ГБН, обусловленной антителами анти-U, из-за редкой встречаемости U-отрицательных доноров в США прибегают к обменному переливанию U-положительной крови. Для получения удовлетворительного клинического эффекта достаточно 2-4 доз донорской крови (Reid и соавт. [208]).
При сравнительном изучении образцов анти-и-антител выявлена их гетерогенность. Для обозначения вариантов антигена U и анти-и-антител предложены обозначения UA, UB, UXUZ (Issitt, Anstee [113], Mentor и соавт. [158], Read и соавт. [193], Stony и соавт. [238]). Результаты дальнейших исследований показали, что перечисленные антигены и соответственно антитела отличаются друг от друга по количественным, но не качественными параметрам (Issitt [112]).
Помимо аллоиммунных, описаны также аутоантитела анти-U (Bell и соавт. [24], Chiofolo и соавт. [42], Kessey и соавт. [129], Marsh и соавт. [155], Nugent и соавт. [177], Roush и соавт. [214], Sacher и соавт. [216]). Эритроциты S-s-Ц- лишены гликофорина В, клетки S-s-Uvar+ содержат его в следовых количествах (Blanchard [26]).
Фенотип S-*-s-U- является следствием делеций экзонов 2-6 GYPB и 1 GYPE (Huang и соавт. [101], Reid, Lomas-Francis [202]). Возникновение фенотипа S-s~Uvar+ связывают с эффектом GyP^-подобного гена, экзон 2 которого содержит кодон для антигена Не (MNS6) (Huang и соавт. [99]). Этот фенотип обозначают как GRHe(P2) (см. Гибридные гликофорины).
Гликофориндефицитные фенотипы
Низкое содержание гликофоринов А и В на эритроцитах обусловлено частичной или полной делецией генов GYPA и GYPB.
GPA-дефицитные фенотипы Еп(а-)
В 1969 г. Darnborough и соавт. [63] обнаружили в сыворотке крови беременной женщины, англичанки по происхождению, антитела к антигену очень высокой частоты. Исследователи обратили внимание на необычное реагирование эритроцитов женщины и некоторых членов ее семьи. В серологических тестах эритроциты проявляли повышенную агглютинабельность и напоминали клетки, предварительно обработанные протеолитическими ферментами. Авторы предположили, что эти эритроциты, подобно энзимированным, лишены определенного поверхностно расположенного оболочечного вещества, названного ими клеточным конвертом (cell envelope). Новый антиген и выявляющие его антитела обозначены Епа и анти-Епа соответственно.
Лица редкого фенотипа Еп(а-) с наличием антител анти-Епа вскоре были найдены другими исследователями (Furuhjelm и соавт. [75], Gahmberg и соавт. [76], Inglis и соавт. [Ill], Issitt и соавт. [116], Moulds и соавт. [171], Tanner и соавт. [244]), в том числе среди японцев (Okubo и соавт. [179]), пакистанцев (Rapmi и соавт. [192]), финнов (Walker и соавт. [255]) и во французско-канадской семье (Taliano и соавт. [243]).
В основе возникновения редкого фенотипа Еп(а-) могут лежать разные причины. Одна из них - гомозиготность по редкому гену Еп, отличающемуся соче-танной делецией экзонов 2-7 гена GYPA и экзона 1 гена GYPB. В результате такой делеций на эритроцитах отсутствует гликофорин A (cell envelope).
Позднее установлено (Daniels [56]), что лица Еп(а-), выявленные Darnborough и соавт. [63], имели генотип GYPfA-BJ/M1".
Для дифференциации генных нарушений, приводящих к возникновению фенотипа Еп(а-), ген Еп предложено обозначать как En(UK) и En(Fin) - ген Еп английского и ген Еп финского типов соответственно (Schenkel-Brunner [223], Walker и соавт. [256]).
На эритроцитах Еп(а-) отсутствуют антигены, ассоциированные с антигеном М, за исключением антигенов S и s, которые выражены нормально.
Эритроциты Еп(а-) не содержат антигенов Wra и Wrb системы Diego, т. е. они одновременно Еп(а-) и Wr(a-b-) (Issitt и соавт. [116]).
Эритроциты Еп(а-) имеют, как указано выше, характерную особенность. Они, подобно энзимированным эритроцитам, непосредственно агглютинируются в солевой среде сыворотками анти-D, анти-С, анти-с, анти-Е, анти-е и другими, содержащими неполные IgG-антитела. Эритроциты обычных людей (Еп+) такую способность не проявляют, их мембрана экранирована гликофоринами «становится доступной для агглютинирующего действия неполных антител только после обработки протеолитическими ферментами.
Ген Еп редкий, известно лишь несколько несвязанных родством индивидов, имеющих генотип Еп/Еп [75, 76,111,116,171,179,192,244,255]
Символ Мк предложен в 1964 г. Heiken и соавт. [92] для обозначения молчащего аллеля в локусе MN. В присутствии гена Мк синтеза антигенов М, N, S и s не происходит. Найдены лица гетеро- и гомозиготные по гену Мк (Hodson и соавт. [94], Metaxas и соавт. [159,162,163], Okubo и соавт. [178], Tokunaga и соавт. [248]).
На эритроцитах гомозигот Мк/Мк гликофорины А и В отсутствуют. В серологических реакциях эритроциты Мк ведут себя так же, как и эритроциты Еп(а-) (Metaxas и соавт. [159], Norling и соавт. [176]).
Присутствие редких генов Мк и Еп может быть причиной ошибок при экспертизе спорного родства. Как правило, супружеская пара М х N, не может иметь детей М и N, а супружеская пара S х s не может иметь детей S и s, поскольку генотип лиц, имеющих фенотип М, N, S и s, расценивается как MJM, N/N, S/S и s/s. Присутствие молчащего гена у одного из родителей может сопровождаться феноменом, именуемым судебными медиками как противоположная гомозиготность. Родители М/- х N/N могут иметь ребенка N, а родители S/- х s/s - ребенка s, что может послужить основанием для исключения родства родителя М и S.
Все лица Мк и Еп(а-) были соматически здоровы, каких-либо аномалий эритроцитов у них не выявлено (Walker и соавт. [255]).
Причиной возникновения гена Мк является сочетанная делеция экзонов 2-7 гена GYPA, экзонов 1-6 гена GYPB и экзона 1 гена GYPE (Huang и соавт. [97], Reid [199]).
Обозначение анти-Епа является собирательным и распространяется на антитела, направленные к различным участкам гликофорина А. В зависимости от устойчивости антигенного субстрата к действию трипсина и фицина антитела анти-Епа подразделяют на affra-EnaTS (трипсинчувствительные), aHra-EnaFS (фицинчувствительные) и aHTH-EnaFR (фицинрезистентные).
Аллоиммунные анти-Епа-антитела описаны как причина посттрансфузионной гемолитической реакции (Postoway и соавт. [189]). Аутоантитела анти-Епа обнаруживали у больных аутоиммунной гемолитической анемией.
Синтез гликофоринов контролируют гены GYPA, GYPB и GYPE, расположенные на хромосоме 4 (4q28.2-q31.1).
Ген GYPA имеет размер 40 тыс. пн и состоит из 7 экзонов (табл. 6.3, рис. 6.2). Экзон 1 контролирует синтез большей части лидер-пептида. Экзон 2 величиной 30 тыс. пн контролирует оставшуюся часть лидер-пептида и первые 26 аминокислот экстрацеллюлярного домена. Экзоны 3 и 4 кодируют экстрацеллюлярный домен, 5 - трансмембранный. Экзон 6 и небольшая часть экзона 7 контролируют синтез цитоплазматического домена гликофорина А, другая, большая часть экзона 7, не транслируется.
Таблица 6.3
Структура генов GYPA, GYPB и GYPE
|
GYPA |
GYPB |
GYPE |
|||
|
А1 |
5'UT,-19--8 |
Bl |
5'UT, -8 - -19 |
El |
5'UT, -19 - -8 |
|
А2 |
-7-26 |
B2 |
-7-26 |
Е2 |
-7-26 |
|
A3 |
27-58 |
тез |
Псевдоэкзон |
тез |
Псевдоэкзон |
|
А4 |
59-71 |
В4 |
27-39 |
¥Е4 |
Псевдоэкзон |
|
А5 |
72-100 |
В5 |
40-71 |
Е5 |
27-58 |
|
А6 |
101-126 |
В6 |
72, 3'UT |
Е6 |
59,3' UT |
|
А7 |
127-131,3'UT |
|
|||
Ген GYPB состоит из 6 экзонов, среди которых 1 представляет собой псевдоэкзон (см. рис. 6.2). Экзоны 1 и 2 GYPB почти идентичны экзонам 1 и 2 гена GYPA. Экзон 4 GYPB, имеющий высокую степень гомологии с экзоном 4 GYPA, кодирует антигены S и s. Экзоны 5 и 6 кодируют С-терминальную цепь, часть экзона 6 не транслируется (Storry и соавт. [237]). Псевдоэкзон 'ЩЁ не транслируется р-за мутации в участке сплайсинга, поэтому гликофорин В не содержит фрагмента пептидной цепи, имеющегося на гликофорине А в позиции 27-58. Трансляция псевдоэкзона ¥ВЗ происходит в редких случаях, когда в него в результате рекомбинации включен фрагмент GYPA с активным участком сплайсинга (Stony и соавт. [237]).
Ген GYPE включает 4 экзона и 2 псевдоэкзона, обозначаемые буквой *F (см. рис. 6.2). Он непосредственно не кодирует каких-либо серологически определяемых продуктов на мембране эритроцитов, однако, как полагают ряд авторов, участвует в рекомбинации генов, что приводит к возникновению новых антигенных свойств (Fuknda [72], Huang и соавт. [97], Khalid и соавт. [130], Palacajornsuk [182]).
Гены GYPA, GYPB и GYPE более чем на 90 % гомологичны. Различия между ними выявлены в транслируемых участках. Исследование, выполненное Kudo и соавт. [134], позволило установить, что продуктом гена GYPE является пептидная цепь из 78 аминокислот. Экстрацеллюлярный домен гликофорина Е, несущий антигены М, S или s, имеет мол. массу 17 ООО и включает 58 аминокислот с 11 О-гликанами.
Три гена расположены в последовательности 5' GYPA - GYPB - GYPB - 3' и гомологичны от фланкирующего участка 5' до повторяющейся последовательности Alu (Huang и соавт. [97]).
Полиморфизм антигенов системы MNS обусловлен как точковыми мутациями (заменой одного нуклеотида) (табл. 6.4, рис. 6.3), так и более сложными генетическими феноменами: делецией одного или более экзонов, гибридизацией различных участков генов GYPA, GYPB с фрагментами гена GYPE (табл. 6.5). В ряде случаев наблюдали кроссинговер, имеющий неполный характер.
Рекомбинации иногда затрагивают псевдоэкзоны и фрагменты нитронов GYPA, GYPB и GYPE, в результате чего вновь появившаяся генетическая структура может создавать антигенные варианты (Huang и соавт. [97]). Обнаружены варианты гибридных генов: GYP(A-B-A), GYP(B-A-B), GYP(B-А-В-А), GYP(A-E-A) и др. Их трансляция приводит к заменам аминокислот в различных позициях. Вновь образовавшиеся пептидные цепи одного и того же типа, например GYP(A-B-A), могут отличаться друг от друга. Отдельные фрагменты цепей гликофоринов с измененной последовательностью аминокислот оказываются иммуногенными. Фенотипически это проявляется в виде качественно новых, как правило, редких антигенов системы MNS, которые распознаются специфическими антителами (Huang и соавт. [97, 99, 101-107]). Новые последовательности аминокислот влияют на гликозилирова-ние гликофоринов, что приводит к появлению новых редких специфичностей и сказывается на экспрессии антигенов М, N, S и I Один из вариантов гибри-щщ0^а^етъ приведен на рис. 6.4.
Молекулярная основа полиморфизма антигенов системы MN
|
Антиген |
Замена аминокислот |
Экзоны |
Замена нуклеотидов |
|
Гликофорин А |
|||
|
ENEN/Vw/Hut |
Thr28Met/Lys |
3 |
С 140 Т Т140А |
|
Vr |
Ser 47 Tyr |
3 |
С 197 А |
|
Mta |
Thr 58 He |
3 |
С230Т |
|
Ria |
Glu 57 Lys |
3 |
G226A |
|
Nya |
Asp 27 Glu |
3 |
Т138А |
|
Or |
Arg 31 Trp |
3 |
Т148С |
|
ERIK |
Gly 59 Arg |
4 |
G232A |
|
Osa |
Pro 54 Ser |
3 |
С217Т |
|
ENEP/HAG |
Ala 65 Pro |
4 |
G250C |
|
ENAV/MARS |
Glu 63 Lys |
4 |
С 244 А |
|
Гликофорин В |
|||
|
S/s |
Met 29 Thr |
4 |
Т143С |
|
Mv |
Thr 3 Ser |
2 |
C65G |
|
sD |
Pro 39 Arg |
4 |
С 173 G |
|
Mit |
Arg 35 His |
4 |
G161A |
|
Нулевые фенотипы |
|||
|
Mk |
Делеция в GYPA (экзоны 2-7), GYPB (экзоны 1-5) и GYPE (экзон 1) |
||
|
En(a-) |
Делеция в GYPA (экзоны 2-7) и GYPB (экзон 1) |
||
|
S-s-U- |
Делеция в GYPB (экзоны 2-4) и GYPE (экзон 1) |
||
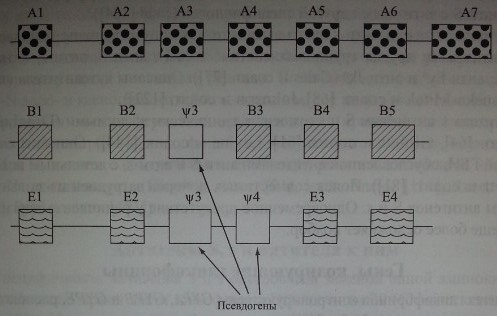
Генетическая основа нулевых фенотипов MNS. Стрелки указывают на участки генов гликофоринов, подвергшиеся делеций (по Daniels [56]). ¥ - псевдогены гликофоринов В и Е.
Рекомбинация локусов GYPA и GYPB с образованием гибридного гена GYP(B-A-B). Черными прямоугольниками обозначены экзоны гена гликофорина А, заштрихованными - гена гликофорина В. Белый прямоугольник, обрамленный пунктиром, - псевдоэкзон ¥ВЗ, частично вовлеченный в гибридный продукт ВЗ/АЗ.
Подсистема Мильтенбергер (варианты гликофоринов и ассоциированных с ними редких антигенов MNS)
|
; Типы Мильтенбергер |
Типы гликофорина |
Присутствие в гликофорине антигенов |
||||||||||
|
Mta |
f Vw |
Hut |
Mur |
MUT |
Hil |
TSEN |
MINY |
Hop |
Nob |
DANE |
||
|
MNS 8 I |
MNS 9 |
MNS , 19 |
MNS 1 10 |
MNS 35 |
MNS 20 |
MNS 33 |
MNS 34 |
MNS 26 |
MNS 27 |
MNS 32 |
||
|
| . MU |
GP.Vw |
+ |
+ |
|||||||||
|
Mi.II |
GRHut |
+ |
+ |
+ |
||||||||
|
Mi.HI |
GP.Mur |
+ |
+ |
+ |
+ |
|||||||
|
Mi.IV |
GP.Hop |
+ |
+ |
+ |
+ |
+ |
+ |
|||||
|
Mi.V |
GRHil |
1 0 |
+ |
|||||||||
|
Mi. VI |
GP.Bun |
+ |
+ |
+ |
+ |
+ |
+ |
|||||
|
Mi.VII |
GP.Nob |
+ |
||||||||||
|
Mi.VIII |
GPJoh |
I |
f |
|||||||||
|
MUX |
GRDane |
+ |
||||||||||
|
Mi.X |
GP.HF |
+ |
+ |
+ |
+ |
+ |
||||||
|
Mi.XI |
GP.JL |
+ |
+ |
|||||||||


![Генетическая основа нулевых фенотипов MNS. Стрелки указывают на участки генов гликофоринов, под¬вергшиеся делеций (по Daniels [56]). ¥ - псевдогены глико¬форинов В и Е.](/images/stories/stat/aa5.jpg)

