Синтез гликофоринов контролируют гены GYPA, GYPB и GYPE, расположенные на хромосоме 4 (4q28.2-q31.1).
Ген GYPA имеет размер 40 тыс. пн и состоит из 7 экзонов (табл. 6.3, рис. 6.2). Экзон 1 контролирует синтез большей части лидер-пептида. Экзон 2 величиной 30 тыс. пн контролирует оставшуюся часть лидер-пептида и первые 26 аминокислот экстрацеллюлярного домена. Экзоны 3 и 4 кодируют экстрацеллюлярный домен, 5 - трансмембранный. Экзон 6 и небольшая часть экзона 7 контролируют синтез цитоплазматического домена гликофорина А, другая, большая часть экзона 7, не транслируется.
Таблица 6.3
Структура генов GYPA, GYPB и GYPE
|
GYPA |
GYPB |
GYPE |
|||
|
А1 |
5'UT,-19--8 |
Bl |
5'UT, -8 - -19 |
El |
5'UT, -19 - -8 |
|
А2 |
-7-26 |
B2 |
-7-26 |
Е2 |
-7-26 |
|
A3 |
27-58 |
тез |
Псевдоэкзон |
тез |
Псевдоэкзон |
|
А4 |
59-71 |
В4 |
27-39 |
¥Е4 |
Псевдоэкзон |
|
А5 |
72-100 |
В5 |
40-71 |
Е5 |
27-58 |
|
А6 |
101-126 |
В6 |
72, 3'UT |
Е6 |
59,3' UT |
|
А7 |
127-131,3'UT |
|
|||
Ген GYPB состоит из 6 экзонов, среди которых 1 представляет собой псевдоэкзон (см. рис. 6.2). Экзоны 1 и 2 GYPB почти идентичны экзонам 1 и 2 гена GYPA. Экзон 4 GYPB, имеющий высокую степень гомологии с экзоном 4 GYPA, кодирует антигены S и s. Экзоны 5 и 6 кодируют С-терминальную цепь, часть экзона 6 не транслируется (Storry и соавт. [237]). Псевдоэкзон 'ЩЁ не транслируется р-за мутации в участке сплайсинга, поэтому гликофорин В не содержит фрагмента пептидной цепи, имеющегося на гликофорине А в позиции 27-58. Трансляция псевдоэкзона ¥ВЗ происходит в редких случаях, когда в него в результате рекомбинации включен фрагмент GYPA с активным участком сплайсинга (Stony и соавт. [237]).
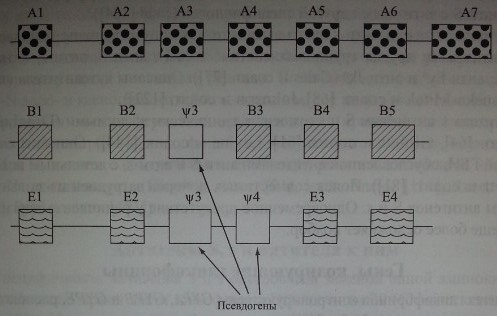
Ген GYPE включает 4 экзона и 2 псевдоэкзона, обозначаемые буквой *F (см. рис. 6.2). Он непосредственно не кодирует каких-либо серологически определяемых продуктов на мембране эритроцитов, однако, как полагают ряд авторов, участвует в рекомбинации генов, что приводит к возникновению новых антигенных свойств (Fuknda [72], Huang и соавт. [97], Khalid и соавт. [130], Palacajornsuk [182]).
Гены GYPA, GYPB и GYPE более чем на 90 % гомологичны. Различия между ними выявлены в транслируемых участках. Исследование, выполненное Kudo и соавт. [134], позволило установить, что продуктом гена GYPE является пептидная цепь из 78 аминокислот. Экстрацеллюлярный домен гликофорина Е, несущий антигены М, S или s, имеет мол. массу 17 ООО и включает 58 аминокислот с 11 О-гликанами.
Три гена расположены в последовательности 5' GYPA - GYPB - GYPB - 3' и гомологичны от фланкирующего участка 5' до повторяющейся последовательности Alu (Huang и соавт. [97]).
Полиморфизм антигенов системы MNS обусловлен как точковыми мутациями (заменой одного нуклеотида) (табл. 6.4, рис. 6.3), так и более сложными генетическими феноменами: делецией одного или более экзонов, гибридизацией различных участков генов GYPA, GYPB с фрагментами гена GYPE (табл. 6.5). В ряде случаев наблюдали кроссинговер, имеющий неполный характер.
Рекомбинации иногда затрагивают псевдоэкзоны и фрагменты нитронов GYPA, GYPB и GYPE, в результате чего вновь появившаяся генетическая структура может создавать антигенные варианты (Huang и соавт. [97]). Обнаружены варианты гибридных генов: GYP(A-B-A), GYP(B-A-B), GYP(B-А-В-А), GYP(A-E-A) и др. Их трансляция приводит к заменам аминокислот в различных позициях. Вновь образовавшиеся пептидные цепи одного и того же типа, например GYP(A-B-A), могут отличаться друг от друга. Отдельные фрагменты цепей гликофоринов с измененной последовательностью аминокислот оказываются иммуногенными. Фенотипически это проявляется в виде качественно новых, как правило, редких антигенов системы MNS, которые распознаются специфическими антителами (Huang и соавт. [97, 99, 101-107]). Новые последовательности аминокислот влияют на гликозилирова-ние гликофоринов, что приводит к появлению новых редких специфичностей и сказывается на экспрессии антигенов М, N, S и I Один из вариантов гибри-щщ0^а^етъ приведен на рис. 6.4.
Молекулярная основа полиморфизма антигенов системы MN
|
Антиген |
Замена аминокислот |
Экзоны |
Замена нуклеотидов |
|
Гликофорин А |
|||
|
ENEN/Vw/Hut |
Thr28Met/Lys |
3 |
С 140 Т Т140А |
|
Vr |
Ser 47 Tyr |
3 |
С 197 А |
|
Mta |
Thr 58 He |
3 |
С230Т |
|
Ria |
Glu 57 Lys |
3 |
G226A |
|
Nya |
Asp 27 Glu |
3 |
Т138А |
|
Or |
Arg 31 Trp |
3 |
Т148С |
|
ERIK |
Gly 59 Arg |
4 |
G232A |
|
Osa |
Pro 54 Ser |
3 |
С217Т |
|
ENEP/HAG |
Ala 65 Pro |
4 |
G250C |
|
ENAV/MARS |
Glu 63 Lys |
4 |
С 244 А |
|
Гликофорин В |
|||
|
S/s |
Met 29 Thr |
4 |
Т143С |
|
Mv |
Thr 3 Ser |
2 |
C65G |
|
sD |
Pro 39 Arg |
4 |
С 173 G |
|
Mit |
Arg 35 His |
4 |
G161A |
|
Нулевые фенотипы |
|||
|
Mk |
Делеция в GYPA (экзоны 2-7), GYPB (экзоны 1-5) и GYPE (экзон 1) |
||
|
En(a-) |
Делеция в GYPA (экзоны 2-7) и GYPB (экзон 1) |
||
|
S-s-U- |
Делеция в GYPB (экзоны 2-4) и GYPE (экзон 1) |
||
![Генетическая основа нулевых фенотипов MNS. Стрелки указывают на участки генов гликофоринов, под¬вергшиеся делеций (по Daniels [56]). ¥ - псевдогены глико¬форинов В и Е.](/images/stories/stat/aa5.jpg)
Генетическая основа нулевых фенотипов MNS. Стрелки указывают на участки генов гликофоринов, подвергшиеся делеций (по Daniels [56]). ¥ - псевдогены гликофоринов В и Е.
Рекомбинация локусов GYPA и GYPB с образованием гибридного гена GYP(B-A-B). Черными прямоугольниками обозначены экзоны гена гликофорина А, заштрихованными - гена гликофорина В. Белый прямоугольник, обрамленный пунктиром, - псевдоэкзон ¥ВЗ, частично вовлеченный в гибридный продукт ВЗ/АЗ.
Подсистема Мильтенбергер (варианты гликофоринов и ассоциированных с ними редких антигенов MNS)
|
; Типы Мильтенбергер |
Типы гликофорина |
Присутствие в гликофорине антигенов |
||||||||||
|
Mta |
f Vw |
Hut |
Mur |
MUT |
Hil |
TSEN |
MINY |
Hop |
Nob |
DANE |
||
|
MNS 8 I |
MNS 9 |
MNS , 19 |
MNS 1 10 |
MNS 35 |
MNS 20 |
MNS 33 |
MNS 34 |
MNS 26 |
MNS 27 |
MNS 32 |
||
|
| . MU |
GP.Vw |
+ |
+ |
|||||||||
|
Mi.II |
GRHut |
+ |
+ |
+ |
||||||||
|
Mi.HI |
GP.Mur |
+ |
+ |
+ |
+ |
|||||||
|
Mi.IV |
GP.Hop |
+ |
+ |
+ |
+ |
+ |
+ |
|||||
|
Mi.V |
GRHil |
1 0 |
+ |
|||||||||
|
Mi. VI |
GP.Bun |
+ |
+ |
+ |
+ |
+ |
+ |
|||||
|
Mi.VII |
GP.Nob |
+ |
||||||||||
|
Mi.VIII |
GPJoh |
I |
f |
|||||||||
|
MUX |
GRDane |
+ |
||||||||||
|
Mi.X |
GP.HF |
+ |
+ |
+ |
+ |
+ |
||||||
|
Mi.XI |
GP.JL |
+ |
+ |
|||||||||







