Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система Cromer и Knops
Антигены Knops обрели статус системы 022 ISBT в 1992 г., после того как была установлена их локализация. До этого все перечисленные антигены входили в коллекцию 205 Cost.
КпаиКпь
Первое сообщение об открытии антигена Кпа, названного Knops по фамилии носителя антител, опубликовали Helgeson и соавт. [19] в 1970 г. Антиген выявлялся с частотой около 99 %. Авторы нашли только 4 лица Кп(а-) из 2091 обследованного. Позднее фенотип Knopsnull получил обозначение Helgeson - по имени автора упомянутой работы, Margaret Helgeson, которая, как и один из 4 ее сибсов, имела фенотип Knopsnull, и ее эритроциты долгое время использовали в качестве стандартных для идентификации антигенов и антител Knops.
В 1980 г. Mallan и соавт. [32] нашли сыворотку, реагировавшую с эритроцитами Кп(а-), и показали, что выявляемый с ее помощью антиген антитетичен Кпа. Соответственно антиген получил обозначение Кпь.
Антитела анти-Кпь не реагировали с эритроцитами Кп(а-) негроидов. Полагают, что гены Кп европеоидов и негроидов качественно отличаются (Molthan [36], Moulds и соавт. [42]).
О выявлении других образцов анти-Кпь-антител не сообщалось.
Таблица MM
Распределение антигенов Knops у европеоидов и негроидов
|
Антиген |
Популяция |
Количество обследованных |
Количество имеющих антиген |
Частота антигена, % |
Источник |
|
Кпа |
Американцы Белые американцы Афроамериканцы |
2071 2482 894 |
2067 2431 883 |
99,8 97,9 98,8 |
[21] [23] [23] |
|
Кпь |
Австралийцы Американцы |
166 63 |
7 3 |
4,2 4,8 |
[24] [24] |
|
МсСа |
Белые американцы Афроамериканцы Афроамериканцы |
3860 645 894 |
3802 624 837 |
98,5 96,7 93,6 |
[20,23] [20] [23] |
|
МсСь |
Афроамериканцы |
371 |
168 |
45,3 |
[26] |
|
Sla |
Белые американцы Афроамериканцы Белые американцы Афроамериканцы |
111 109 722 371 |
ПО 66 705 191 |
99,1 60.5 97,6 51,5 |
[22] [22] [25] [25] |
|
Yka |
Белые американцы Афроамериканцы |
2889 1117 |
2598 1098 |
89,3 98,3 |
[23] [23] |
МсСа и МсСь
Антиген МсСа (McCoy) обнаружили в 1978 г. Molthan и Moulds [38]. Он оказался ассоциированным с Кп\ Оба антигена встречались вместе с частотой более 90 %. В то же время более половины лиц МсС(а-) были Кп(а-).
Среди европеоидов МсСа-отрицательные лица встречаются редко - 1-2 %, среди негроидов более часто - 3-10 % (Molthan, Moulds и соавт. [35,38,42]).
Антитела, выявляющие антиген МсСь, антитетичный МсСа, найдены Molthan [36] в 1983 г. Сыворотка анти-МсСь реагировала с эритроцитами негров Кп(а+) МсС(а-), с эритроцитами европейцев Кп(а+)МсС(а~) она не реагировала.
Подобно тому как антигены Кпа и Кпь проявляли антитетичные отношения у европеоидов, антигены МсСа и МсСь проявляют антитетичные отношения у негроидов (Moulds и соавт. [50], Molthan [36]). Среди доноров негров 45,3 % имели фенотип МсС(Ь+) (табл. 22.2). Среди европеоидов лица МсС(Ь+) не обнаружены. Посемейные исследования показали кодоминантное наследование антигенов МсСа и McCb (Molthan, Moulds [38], Moulds и соавт. [42]). Частота генов МсСаи МсСьсреди жителей Западной Африки составила 0,72 и 0,28 соответственно.
Антигенные различия МсСа/МсСь обусловлены мутацией А 4795 G в экзо-не 29 гена CR1, последняя вызывает замещение Lys 1590 Glu в участке ССР-25 LHR-D полипептида CR1 (рис. 22.1) (Moulds и соавт. [50]).
Рекомбинантный растворимый полипептид CR1, имеющий лизин в позиции 1590, я§шбировал анти-МсСа-антитела. Анти-МсСь-антитела он не ингибировал.
Sla и Vil
Антиген Sla (Swain-Langley) описали Lacey и соавт. [28]. Molthan [34] обозначила этот антиген, обнаруженный ею позднее независимо от упомянутых авторов, как МсСс.
Антиген Sla встречается среди европеоидов значительно чаще (98 %), чем среди негроидов (53,5 %).
Все негры МсС(а-) и 45 % негров Кп(а+)МсС(а+) были Sl(a-). Среди негров Западной Африки фенотип Sl(a-) встречался с частотой 70 %, среди европейцев лица Sl(a-) составляют всего 1 % (Moulds и соавт. [42]).
Позднее были найдены анти-УП-антитела, открывавшие антиген Vil, антитетичный Sla. Антитела анти-Vil присутствовали у реципиента европейца, которому многократно переливали эритроциты, в том числе, очевидно, от доноров негров. Сыворотка пациента реагировала со всеми 12 образцами эритроцитов Sl(a-) и эритроцитами 80 % доноров негров.
У европеоидов антиген Vil отсутствует (Lacey и соавт. [28]).
Антигенные различия SIVVil обусловлены мутаций А 4828 G в экзоне 29 гена CR1. Она приводит к замене Arg 1601 Gly в участке ССР-25 LHR-D полипептида CR1.
Растворимый рекомбинантный полипептид CR1, имеющий аргинин в позиции 1607, специфически ингибировал активность анти-81а-антител. По отношению к анти-УП-антителам он был инертен. В то же время рекомбинантный полипептид CR1, имеющий глютамин в позиции 1590, ингибировал анти-Vil-антитела. Анти-81а-антитела при этом не ингибировались.
Moulds и соавт. [50] объясняют этот эффект заменой положительно заряженного лизина на отрицательно заряженную глютаминовую кислоту в позиции 1590. Это приводит к изменению пространственной ориентации близко расположенного эпитопа Sla (позиция 1601) и делает его недоступным для антител. Рекомбинантный растворимый полипептид CR1, имеющий глицин в позиции 1601 ингибировал активность анти-УП-антител, не влияя на активность антител анти-Sl3
S13
В последние два десятилетия найдено много образцов анти-Кп-подобных антител, в том числе указывающих на гетерогенность антигенов Sla и Vil.
Обнаруженный с помощью одной из сывороток антиген S13 включен в систему Knops под обозначением KN8. Антитела анти-SB выявлены у европейки, которая пока остается единственным известным индивидом, имеющим фенотип Sl(a+)Vil-S13 -. Других носителей анти-813-антител не обнаружено.
Moulds и соавт. [49] пришли к заключению, что серологические различия антигенов Sla,Vil и S13 обусловлены следующими молекулярными замещениями:
позиция Arg 1601 —► антиген S11 (Sla) позиция Gly 1601 —> антиген S12 (Vil) позиции Arg 1601 и Ser 1610 —► антиген S13 позиция Ser 1610 —> антиген S14 позиция Тге 1610 —> антиген S15 Последние две позиции, как полагают указанные авторы, соответствуют гипотетическим антигенам, существование которых представляется вполне реальным.
Yka
Антитела анти-Ука (York) сначала были приняты за анти-Cs3, поскольку реагировали с эритроцитами Cs(a+), но не реагировали с двумя образцами эритроцитов Cs(a-). Однако миссис York, у которой впервые были выявлены антитела, была Cs(a+) и, соответственно, не могла вырабатывать анти-Cs "-антитела. В связи с этим фактор Yka (York) был квалифицирован как новый антиген, фенотипически ассоциированный с антигеном Csa коллекции Cost (Molthan, Giles [37]).
Посемейные исследования показали кодоминантное наследование антигена Yka. Его частота составила 92 % среди европеоидов, 98 % среди негроидов (Molthan, Giles [37], Molthan [35]).
Частота фенотипа Cs(a-)Yk(a-) среди европеоидов - 1,9% (Molthan, Giles [37],). Если бы между антигенами Csa и Yka не существовало неравновесного сцепления, то указанный фенотип должен был встречаться с частотой 0,32 %, т. е. почти в 6 раз реже. Среди негроидов лица Cs(a-)Yk(a-) встречались с частотой 0,6 % - в 25 раз чаще по сравнению с расчетной величиной (0,024 %), что также свидетельствовало о сцеплении антигенов YkaH Csa.
Molthan и Moulds [38], сообщив об открытии антигена МсСа, указали, что 37 % белых американцев имеют фенотип McC(a-)Yk(a-), a 29 % - фенотип McC(a-)Yk(a-)Cs(a-). Среди негров фенотип McC(a-)Yk(a-) составлял 2,2 %, фенотип McC(a-)Yk(a-)Cs(a-) - 17 %. Эти показатели существенно отличались от расчетных, соответствующих положению, что гены МсСа, YkanCsaнезависимы друг от друга. Фактическое число доноров с фенотипом МсС(а-) в сочетании с Yk(a-), Kn(a-) и Cs(a-) оказалось в 100 раз больше ожидаемого.
КСАМ
^Кшсано несколько образцов специфических анти-КСАМ-антител, которые первоначально были ошибочно идентифицированы как анти-МсСа (KN3). Более поздние исследования показали, что указанные антитела открывают антиген, отличающийся от МсСа. Последнему было присвоено название КСАМ, и в 2006 г. он был включен в систему Knops под обозначением KN9 (Daniels и соавт. [8]).
Антиген КСАМ встречается с частотой около 98 % среди европеоидов и только у 20 % негроидов.
Молекулярно-генетическими исследованиями показано, что основой возникновения фенотипов МсСа+и МсСа- является замена валина на изолейцин в положении 1615. Аминокислотная замена является результатом мутации в экзоне 29 гена CR1
Аминокислотная последовательность рецептора CR1*1 комплемента.
В систему Knops (Hone) входит 9 антигенов, 6 из них образуют 3 антитетичные пары: Кпа и Кпь, МсСа и McCb, S1* и Vil; 3 антигена не имеют пар: Yka, S13 и КСАМ (табл. 22.1). Известен нулевой фенотип - Hegelson, лишенный антигенов Knops.
Антигены Knops расположены на рецепторе CR1 комплемента (complement receptor type 1). У лиц, имеющих нулевой фенотип, эритроциты содержат небольшое количество вещества CR1.
Ген, контролирующий антигены Knops (CR1, или CD35), входит в состав кластера дифференцировки CD35, регулирующего активность комплемента. Он картирован на длинном плече хромосомы 1 в позиции lq32.
Один из антигенов Knops (Yka) имеет неравновесное сцепление с антигеном Csa, относящимся к коллекции Cost. В связи с этим антигены Cost (Csa и Csb) рассматриваются вместе с антигенами Knops.
Антигены Knops и Cost
|
Обозначение |
Примечание |
||
|
авторское |
традиционное |
ISBT |
|
|
Knops |
Kna |
KN1 |
Антитетичен Knb (KN2) |
|
Hall |
Knb |
KN2 |
Антитетичен Kna (KN1) |
|
McCoy |
McCa |
KN3 |
Антитетичен McCb (KN6) |
|
Swain-Langley |
Sla |
KN4 |
Антитетичен Vil (KN7) |
|
Vil |
Slb? |
|
Антитетичен Sla ? |
|
York |
Yka |
KN5 |
|
|
|
McCb |
KN6 |
Антитетичен МсСа (KN3) |
|
|
Vil |
KN7 |
Антитетичен Sla(ICN4) |
|
|
S13 |
KN8 |
|
|
|
KCAM |
KN9 |
|
|
Cost (Copeland, Stirling) |
Csa |
COST1 |
Антитетичен Csb(COST2) |
|
|
Csb |
COST2 |
Антитетичен Csa(COSTl) |
Локализация
В 1991 г. две группы исследователей (Moulds и соавт. [45] и Rao и соавт. |Й]) независимо друг от друга установили, что антигены Knops расположе-pgr на рецепторе CR1 комплемента. Радиоактивно меченные протеины эри-^роцитарной мембраны выделили посредством иммунопреципитации антителами к антигенам Kna, McC\ Sla и Yk\ В иммуноэлектрофорезе антигенный субстрат образовывал полосы преципитации, идентичные полосам, образуемым протеином CR1.
Расположение антигенных эпитопов Kna, McCa, Sla и Yka на CR1 было подтверждено в экспериментах с нейтрализацией антител рекомбинантным CR1 с различной аминокислотной последовательностью иммунодоминантных участков (Moulds, Rowe [47], Petty и соавт. [52]).
Аналогичные тесты с антителами анти-Св" дали отрицательные результаты. Тем самым было установлено, что антигены COST на рецепторе CR1 отсутствуют. Таким образом, несмотря на фенотипические ассоциации факторов COST и Knops, они не являются составляющими одной антигенной системы .
Фактор DAF предохраняет эритроциты, лимфоциты, тромбоциты и соматические клетки от повреждения собственным комплементом. Он блокирует связывание компонентов С4Ь2а и СЗЬВЬ, ускоряет диссоциацию СЗ-конвертазы при активации комплемента по классическому и альтернативному пути (Coyneet и соавт. [12]).
Фактор DAF, содержащийся в эпителиальных клетках трофобласта, защищает плод от проникновения в его организм комплемента из крови матери (Holmes и соавт. [32]).
Белок CD59 - мембранный ингибитор реактивного лизиса (MIRL), также относится к гликопротеинам, регулирующим функцию комплемента. Он принадлежит семейству Ly-б, ингибирует связывание компонентов С8 и С9 и тем самым предотвращает образование комплекса, разрывающего оболочку клетки. CD59 присутствует на мембране эритроцитов, но не несет групповых антигенов.
CD59 гликозилирован в позиции Asn 18, его мол. масса около 18 кДа. Так же как и DAF, CD59 соединен с мембраной эритроцита GPI-якорем - глико-зилфосфатидилинозитолом (Fletcher и соавт. [25], Telen [97], Rosse, Ware [85], Lachmann [42]). Ген CD59 картирован на хромосоме 11.
Пароксизмальная ночная гемоглобинурия (ПНГ), характеризующаяся вну-трисосудистым гемолизом, обусловлена Х-сцепленным геном PIG-А. Мутации в этом локусе нарушают синтез GPI-ассоциированных протеинов, что приводит к дефициту CD59 и DAF на поверхности мембраны клеток (Rosse, Ware [85], Takeda и соавт. [96], Bessler и соавт. [6]).
У больных ПНГ концентрация CD59 и DAF на эритроцитах снижена (Nicholson- Weller и соавт. [67]), вследствие чего они не могут противостоять лизису под действием собственного комплемента непосредственно в кровяном русле. ^!$f$epecHO отметить, что эритроциты Inab, несмотря на дефицит фактора ^^щцодвержены внутрисосудистому гемолизу. Ни у одного из 6 индивидов с фенотипом никаких проявлений внутрисосуцистого гемолиза не отмече-Ш(ШЩ и соавт. [106], Daniels и соавт. [18], Telen и соавт. [98], Merry и соавт. [62]). В отличие от эритроцитов больных ПНГ, эритроциты Inab не лизировались подкисленной аллогенной сывороткой после обработки ядом кобры. Однако они в большей степени, чем нормальные эритроциты, были подвержены гемолизу Холодовыми антителами в растворе сахарозы (Telen и соавт. [98], Merry и соавт. [62]).
Прямая проба (эритроциты Inab + антиглобулиновая сыворотка с антителами к С3-компоненту комплемента) дала отрицательный результат. Эритроциты Inab, таким образом, не содержали на своей поверхности С3-компонента комплемента, что свидетельствоввало также об отсутствии на таких эритроцитах ингибитора СЗ-конвертазы (Telen и соавт. [98], Merry и соавт. [62]).
Когда CD59 блокировали МКА анти-СЭ59, эритроциты Inab лизировались подкисленной аллогенной сывороткой (Daniels и соавт. [18], Holguin и соавт. [31]). В тестах на реактивный лизис эритроцитов, обработанных МКА к CD55 и CD59, эффект наблюдали при использовании анти-С059антител (Yuan и соавт. [112]).
Полученные результаты свидетельствуют о том, что гликопротеины DAF и CD59 выполняют функцию защиты клеток от собственного комплемента, при этом вклад CD59 выше, чем DAF.
У больного, гомозиготного по делеции одного из нуклеотидов в гене CD59, концентрация гликопротеина CD59 была низкая, DAF - нормальная, при этом наблюдали синдром, напоминавший ПНГ (Yamashina и соавт. [110], Motoyama и соавт. [63}).
При определении чувствительности эритроцитов к комплементзависимому лизису получены следующие результаты (в порядке возрастания): дефицитные по DAF эритроциты Inab имели 4,6 ед., СВ59-дефицитные эритроциты -11,7 ед., дефицитные одновременно по DAF и CD59 - 47,6 ед. (Shichishima и соавт. [88]).
Наряду с защитой клеточных элементов крови от комплементопосредован-ного лизиса CD59 выполняет и другую биологическую функцию: препятствует проникновению в эритроциты малярийного плазмодия Plasmodiumfalciparumи тем самым обеспечивает невосприимчивость к малярии (Wiesner и соавт. [108]).
Фактор DAF принимает участие в межклеточных взаимодействиях, являясь лигандом CD97, который представлен в мембране клеток семью доменами (Hamann и соавт. [28]).
Подобно антигену Р, DAF выступает в качестве рецептора для уропатоген-ных штаммов Escherichiacoli, обусловливает предрасположенность к инфицированию этими бактериями эпителиальных клеток мочевыводящих путей (Moulds и соавт. [65]). Лизаты Escherichiacoliвызывали агглютинацию всех образцов эритроцитов, несущих антигены Cromer, эритроциты Dr(a-) и Inab они не агглютинировали (Nowicki и соавт. [69]). Бактериальные антитела, связывающиеся с антигеном Dra, получили название Dr-адгезины. Очищенные Dr-ЭЙраины, так же как и лизаты Escherichiacoli, связывались с яйцеклетками ки-"^йскогр^хомячка, которые были подвергнуты трансфекции нормальной кДНК г^& Шчедгезины не реагировали с интактными яйцеклетками и яйцеклетками, подвернутыми трансфекции кДНК DAF, кодирующей Ser 165 Leu [характеристика фенотипа Dr(a-)] (Nowicki и соавт. [68]).
Nowicki и соавт. [70], Lublin [50] применили Dr-адгезины, выделенные из ре-комбинантных штаммов бактерий, в качестве тест-реагента в иммунофлюорес-центном методе исследования и показали, что лиганд DAF представлен на поверхности эпителия всех типов. В наибольших концентрациях он присутствовал в эпителии почечных канальцев и клубочков.
DAF является лигандом для эховирусов, вируса Коксаки и многих других (Evans и соавт. [24]). Некоторые разновидности эховируса агглютинируют эритроциты (Goldneld и соавт. [26]). Эксперименты по связыванию эховируса с трансфектированными яйцеклетками китайского хомячка показали, что присоединение его к клетке происходит в том случае, если на ее поверхности присутствуют домены DAF: ККП-2, ККП-3 и ККП-4 (Clarkcon и соавт. [10]). МКА к ККП-3 блокировали связывание эховирусов с рецепторами клеток (Clarkcon и соавт. [10], Bergelson и соавт. [5]).
На мембране эритроцитов, помимо DAF, присутствуют другие протеины, связанные с клеткой посредством GPI-якоря. Некоторые из них несут групповые антигены систем Cartwright, Dombrock, JMH, а также антиген Emm. Лиганд LFA-3 (CD58) присутствует на мембране эритроцитов, не будучи ассоциирова-ным с групповыми антигенами. Большинство молекул LFA-3 связано с мембраной эритроцита через GPI-якорь, некоторая их часть расположена в трансмембранной и внутриклеточной зоне клетки. Лиганд LFA-3 выполняет функцию молекул межклеточной адгезии и участвует в активации Т-клеток через связывание с лигандом CD2 (Springer и соавт. [92], Anstee и соавт. [2]).
Еще один белок, участвующий в регуляции активности комплемента, получил обозначение С8-связывающий протеин (Schonemark и соавт. [87]). Он отсутствует на эритроцитах больных ПНГ и, очевидно, связан с мембраной эритроцитов посредством того же GPI-якоря (Hansch и соавт. [29]).
Прионовые протеины РгРс также являются GPI-ассоциированными, они присутствуют на клетках различных тканей организма. Изоформа указанных протеинов, обозначенная как PrPSc, способна вызывать губчатую энцефалопатию - болезнь Крейтцфельдта-Якоба (Prusiner [77]). Лиганд РгРс присутствует в небольших количествах на эритроцитах здоровых людей, на эритроцитах больных некоторыми формами ПНГ он отсутствует.
Антитела системы Cromer представлены преимущественно классом IgG (Daniels [15]), встречаются анти-Сга-антитела IgM (Dickson и соавт. [23]). Большинство антител IgG относится к субклассу IgGl, однако описаны антитела, относящиеся к субклассам IgG2, IgG3 и IgG4 (Dickson и соавт. [23], Issitt, Anstee [36], Nakache и соавт. [66], Reid и соавт. [79, 80, 83], Sistonen и соавт. [89], McSwain, Robins [59], Anderson и соавт. [1], Byrne и соавт. [7]).
Антитела системы Cromer не имеют существенного значения в трансфузио-логии. Опубликованы сообщения о благополучных исходах трансфузий эритроцитов, несовместимых по антигенам этой системы, реципиентам, которые имели антитела анти-Сга (Smith и соавт. [90], Whitsett, Oxendine [107], Chapman и соавт. [9]) и анти-Тса (Hoffer и соавт. [30]).
Вместе с тем описаны постгрансфузионные реакции, причиной которых были антитела анти-Сга (Byrne и соавт. [7]) и анти-Тса (Kowalski и соавт. [39]). В последнем случае реципиенту перелили шесть доз эритроцитов Тс(а+), из которых первые три гемолизировались invivoв день проведения трансфузии.
Попытки оценить клиническое значение антител Cromer с помощью экспериментальных тестов invivoи invitroне дали однозначных результатов.
Smith и соавт. [90], Leatherbarrow и соавт. [45] и другие авторы [4, 9, 23, 66, 79, 84, 86, 107,] сделали вывод об отсутствии клинического значения антигенов и антител этой системы.
В других случаях были получены данные, свидетельствующие о способности антител Cromer уменьшать продолжительность циркуляции перелитых эритроцитов [1, 7,27, 38, 39, 43, 59, 79, 83,105].
При введении эритроцитов IFC+ реципиенту, имевшему анти-ШС-антитела, отмечалось следующее. В одном случае через сутки после инъекции в кровотоке сохранилось 38 % эритроцитов (Walthers и соавт. [105]), в другом случае наблюдали исчезновение IFC-несовместимых эритроцитов через 15 мин после введения (Daniels [15]).
Антитела анти-Тса IgGl, IgG2 и IgG4 проявляли себя как клинически значимые при испытании в монослое моноцитов. Через 2 года антитела того же лица содержали только IgG2 и IgG4 и не проявляли себя invitroкак клинически значимые (Anderson и соавт. [1]).
Трансплантация почки от донора Dr(a+) реципиенту Dr(a-), имевшему анти-Ога-антитела IgG2 и IgG4, была успешной: приживление трансплантата и его функционирование было нормальным, повышения титра анти-Ога-антител отмечено (Nakache и соавт. [66]).
Антитела системы Cromer не вызывали ГБН. Антигены Cromer присутствуют на трофобласте, который вследствие этого способен адсорбировать материнские антитела анти-Cromer (Holmes и соавт. [32]).
У 2 женщин с наступлением беременности титр антител анти-Сга снизился 11 :128 и 1 : 512 до 1 : 2 (Sacks, Garratty [86]). У других женщин высокоактивные антитела анти-Сга, анти-Dr3 и aHTH-WESb перестали выявляться со II и III триместра беременности; кратковременное их появление отмечалось после родов (Reid и соавт. [79], Poole и соавт. [75]). Описанный феномен можно объяснить тем, что плацента адсорбирует материнские антитела, тем самым защищая от них плод. В одном случае описана персистенция высокоактивных антител anti-Dra на протяжении двух беременностей, однако дети родились без признаков ГБН (Rahimi-Levene [78]).
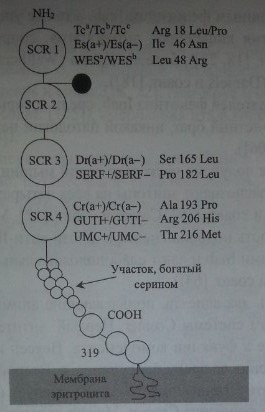
Фактор DAF, выделенный из эритроцитов, имеет мол. массу 70 кД, богат сиаловыми кислотами, имеет 15 участков О-гликозилирования и один участок N-гликозилирования (Lublin и соавт. [53]).
Caras и соавт. [8], Medof и соавт. [60]) показали, что кДНК гена DAF, выделенная из эпителиальной клеточной линии HeLa и линии HL-60 промиело-цитарного лейкоза, кодирует синтез полипептида, состоящего из 327 аминокислот. Полипептид DAF имеет четыре гомологичные области, включающие примерно по 60 аминокислот, которые получили название «короткие конценсусные повторы» (ККП). Далее следует О-гликозилированный участок из 70 аминокислот, богатый серином и треонином, и гидрофобный фрагмент, включающий 24 аминокислоты (рис. 21.1). Расшифрована аминокислотная последовательность DAF-гликопротеина (рис. 21.2).
Меньшая по величине кДНК гена DAFимела вставочную последовательность Aluиз 118 нуклеотидов (табл. 21.3), образовавшуюся в результате альтернативного сплайсинга (Caras и соавт. [8]).
Генный локус системы Cromer - DAF (CD55) - картирован на длинном плече хромосомы 1 в позиции lq32 (Post и соавт. [76]). Ген DAF имеет величину около 40 кб и представлен 11 экзонами (см. табл. 21.3).
Строение гликопротеина Cromer.
Организация гена DAF
|
Экзон |
Размер интрона, кб |
Положение аминокислот |
Кодируемый регион DAF |
Кодируемые антигены |
|
|
№ |
размер, ПН |
||||
|
1 |
|
0,5 |
-34--1 |
Участок 5' не транслируется, сигнальный пептид |
|
|
2 |
186 |
2,3 |
-1-62 |
ККП-1 |
Esa,WESa/WESb, CROV |
|
3 |
192 |
0,9 |
62 -126 |
ККП-2 |
|
|
4 |
100 |
1,0 |
126-159 |
ККП-3Д А |
Tca/Tcb/Tcc, CRAM |
|
5 |
86 |
4,3 |
159-188 |
ккп-зв |
Dra, SERF |
|
6 |
189 |
5,4 |
188-251 |
ККП-4 |
Cra, UMC, GUTI |
|
7 |
126 |
0,6 |
251-293 |
Область Ser/Thr. А |
|
|
8 |
81 |
1,9 |
293-320 |
Область Ser/ThrD |
|
|
9 |
21 |
1,2 |
320-327 |
Область Ser/Thrc |
|
|
10 |
118 |
19,8 |
(327-366) |
Alu (альтернативный сплайсинг) |
|
|
И |
956 |
|
327-347 |
Гидрофобный участок, 3 не транслируется |
|
Аминокислотная последовательность DAF