Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система Gerbich
Биологическая роль, физиологические функции
Гликофорины С и D прикреплены к цитоскелету и являются лигандом между протеинами мембраны и цитоплазмы. По данным разных исследователей, от 20 до 61 % лиц с нулевым фенотипом Gerbich (Ge:-2,-3,-4) имели эритроциты эллипсоидной формы (Reid и соавт. [94, 98], Anstee и соавт. [4, 5], Daniels и соавт. [30]). Мембрана эритроцитов Ge:-2,-3,-4 в связи с отсутствием гликофоринов С и D имеет пониженную упругость (Nash и соавт. [77]), вследствие чего возникает эллипсоцитоз. Описаны два брата Ge:-2,-3,-4, у котоых была хроническая гемолитическая анемия (Rountree и соавт. [107]).
Эритроциты Ge:-2,-3,4 и Ge:-2,3,4 не отличаются от обычных по форме и упругости мембраны (Anstee и соавт. [5], Reid и соавт. [93]), несмотря на отсутствие полноценных молекул гликофоринов С и D.
Физиологические функции недостающих лигандов у лиц с фенотипом Yus и Gerbich, вероятно, компенсируются гликофорин-С-подобными молекулами.
Онтогенез, распределение в тканях
Антигены Ge2 и Ge4 полностью развиты на эритроцитах к моменту рождения (Rosenfield и соавт. [106]). Они выявлены у 17-28-недельных плодов (Race, Sanger [90]).
В процессе гемопоэза гликофорины С и D появляются на эритроидных клетках на ранних стадиях дифференцировки, хотя вначале их гликозилирование
может быть неполным (Villeval и соавт. [128]). Гликофорин С, выявляемый моноклональными антителами BRIC4 по точке гликозилирования, был экспресси-рован на 84 % клеток пуповинной крови, несущих CD34 (Daniels, Green [27]). Гликофорины С и D представлены как на эритроидных, так и на неэритроидных клетках (Le Van Kim и соавт. [53]). Гликофорин С присутствует на Т-лимфоцитах, в меньшей мере - на В-клетках и тромбоцитах, на гранулоцитах отсутствует (Le Van Kim и соавт.[53], Villeval и соавт [128]).
Транскрипты гена GYPC обнаружены в эритробластах человека, эритролейкемических клеточных линиях, головном мозге, почках и печени плода (Colin и соавт. [19], High, Tanner [38]). В печени взрослых они обраруживаются только с помощью МКА BGRL-100 к С-терминальному участку гликофорина .
Эластичность и форма эрцтроцитов обеспечиваются субмембранным матрик-сом, состоящим из трех белков: спектрина, актина и протеина 4.1R (Bennett [8], Mohandas, Chasis [71], Palek, Lambert [84]). Гликофорины С и D, протеин 4.1R, трансмембранный протеин полосы 3 (транспортер анионов), анкирин и протеин 4.2 образуют сферу, связывающую цитоскелет с мембраной клетки (Alloisio и соавт. [2], Hemming и соавт. [36,37], Marfatia и соавт. [62-64], Mueller, Morrison [73], Nunomura и соавт. [79], Owens и соавт. [83], Reid и соавт. [103]).
Гликофорины С и D связаны с протеином 4.1R через спектрин-актиновую сеть. Трипептид аргинин - гистидин - лизин в позиции 86-88 гликофорина связан с внутренней последовательностью одного из доменов протеина 4.1R величиной 30 к Да, его кодирует экзон 8 гена 4.1R. Трипептид тирозин - фе-нилаланин - изолейцин гликофорина С связан с PDZ-доменом протеина р55, домен D5 белка р55 - с аминокислотной последовательностью, кодируемой экзоном 10 гена 4.1R (Hemming и соавт. [36, 37], Marfatia и соавт. [62-64], Nunomura и соавт. [79]).
Протеин 4.1 связывает кальций-модулин, поэтому повышенная концентрация ионов Са2+ ослабляет связь гликофорина С с протеином р55 (Nunomura и соавт. [79]). Протеин 4.1, таким образом, играет важную роль в формировании общей пространственной структуры: гликофорин С - протеин 4.1R - белок р55.
На одном эритроците присутствует около 200 тыс. молекул протеина 4.1R, примерно столько же, сколько имеется гликофоринов обоих типов (Smythe и соавт. [115]). У больных с наследственным эллиптоцитозом содержание протеина 4.1 R уменьшено, количество гликофоринов С и D редуцировано на 70-90 %, отмечается дефицит белка р55 (Alloisio и соавт. [1, 2], Serjeantson и соавт. [ПО], Sondag и соавт. [116]). На дефицитных по гликофоринам С и D эритроцитах [фенотип Leach (Ge:-2,-3,-4)] протеин 4.1R редуцирован на 25 %, содержание белка р55 снижено на 98 % (Alloisio и соавт. [2], Hemming и соавт. [36]).
Гликофорины С и D, подобно гликофоринам А и В, содержат сиаловые кислоты и определяют гликокаликс - взаимодействие клеток с внешней средой. Хотя основной функцией гликокаликса является защита клетки от проникновения болезнетворных микроорганизмов, гликофорины С и D, наоборот, являются рецепторами для вирусов гриппа (Ohyama и соавт. [80]) и возбудителей малярии (Mayer и соавт. [65], Pasvol и соавт. [85]).
Дефицит или отсутствие в эритроцитах гликофоринов С и D делает эритроциты менее распознаваемыми для плазмодия малярии. Так, уровень инвазии эритроцитов Ge:-2,-3,-4 малярийным плазмодием Plasmodium falciparum составлял 57 % от уровня инвазии эритроцитов Ge:2,3,4 (Pasvol и соавт. [85]). Уровень инвазии эритроцитов Ge:-2,-3,4 был обычным (Mayer и соавт. [65]). Лиганд BAEBL, расположенный на малярийном плазмодии, не распознавал эритроциты, обработанные сиалидазой или трипсином. Его связывание с эритроцитами Ge:-2,3,4 и Ge:-2,-3,4 было снижено (Mayer и соавт. [65]). Лиганд BAEBL обладает тропизмом к ЕВА-175, последний является рецептором для Plasmodium falciparum на гликофорине А. Вместе с тем связывание рецептора BAEBL с эритроцитами Еп(а-), также дефицитными по содержанию гликофо-рина А, было нормальным.
Не исключено, что Gerbich-отрицательный фенотип дает селективные преимущества его носителям, обеспечивая защиту от малярийной инвазии. Очевидно, этим можно объяснить высокую частоту людей Ge:-2,-3,4 в Папуа -Новой Гвинее, эндемичной по малярии.
Чаще антитела к антигенов системы Gerbich выявляли у лиц, имевших беременности и гемотрансфузии (Race, Sanger [90]), описаны также антитела естественного происхождения (Booth, McLouglin [11], Loirat и соавт. [58], McLouglin, Rogers [66], Okubo и соавт. [81]) и аутоиммунного (Gottsche и соавт. [35], Poole и соавт. [89], Reynolds и соавт. [105], Sererat и соавт. [109], Shulman и соавт. [111 ])Л
Чаще встречаются анти-Ое2-антитела. Они образуются у лиц Ge.-2,3,4, Ge:-2,-3,4nGe:-2,-3,-4.
Из 17 образцов антител, выявленных у лиц Ge:-2,-3,4, 13 имели специфичность aHTH-Ge2,4 - aHTH-Ge3 (Daniels [25]).
Из 6 обладателей фенотипа Leach (Ge:-2,-3,-4) анти-Ое2-антитела имели 4 человека, анти-веЗ - 1, aHTH-Ge4 - 1 (Anstee и соавт. [5], Daniels и соавт. [30], McShane, Chung [67], Reid и соавт. [98], Rountree и соавт. [107]).
Среди 664 обследованных меланезийцев Ge-38(13%) имели анти-Ge-антитела, причем число мужчин и женщин среди них было примерно одинаковым (Booth, McLouglin [11]). Некоторые образцы антител были IgM, большинство относилось к IgG, главным образом к IgGl (Vengelen-Tyler, Morel [127]).
В некоторых публикациях aHTH-Ge-антитела идентифицировали как анти-Gel,2 и как анти-Ge: 1,2,3, однако адсорбция эритроцитами Ge:-2,3,4 полностью истощала эти антитела, в том числе сущеественно убывала aHTH-Ge2-активность (Booth и соавт. [10,11]).
McShane и Chung [67] нашли аллоиммунные анти-Ое4-антитела у сенсибилизированной женщины с фенотипом Ge:-2,-3,-4, Leach.
Daniels и соавт. [29] выявили анти-Ое4-антитела в сыворотке крови больного с транзиторным дефицитом гликофорина С.
Получен ряд серий МКА, специфичность которых в серологических реакциях соответствовала aHTH-Ge4 (Anderson и соавт. [3], Anstee и соавт. [4, 5], Dahr и соавт. [21], Daniels и соавт. [26], Smythe и соавт. [115], Telen и соавт. [123]).
Антитела Gerbich регистрировали на эритроцитах новорожденных, у которых прямая антиглобулиновая проба была положительной. Их удавалось элю-ировать. Вместе с тем они не вызывали клинически выраженной ГБН, хотя в ряде случаев относились к субклассу IgG3 и положительно реагировали в тестах с монослоем моноцитов (Peddle и соавт. [87], Reid и соавт. [91], Miller и соавт. [68], Rosenfield и соавт. [106], Sacks и соавт. [108]).
У больного Ge:-2,-3,4, имевшего aHTH-Ge-антитела, после переливания трех доз серологически несовместимых эритроцитов наблюдалась желтуха, продолжительность циркуляции перелитых эритроцитов была уменьшена (Smart и соавт. [114]). Другому больному, имевшему анти-Ое2-антитела, перелили 16 доз несовместимых эритроцитов. Через 3 недели после гемотрансфузии признаков гемолиза in vivo не наблюдали (Mochizuki и соавт. [69]).
Проверка приживаемости несовместимых эритроцитов in vivo в большинстве случаев показала, что антитела Gerbich не относятся к трансфузионно опасным (DiNapoli и соавт. [31], Nance и соавт. [76], Pearson и соавт. [86], Tilley и соавт. [124]).
Один образец aHTH-Ge-антител реагировал с эритроцитами Rh u, -D- и некоторыми из других вариантов Rh-Hr (Issitt и соавт. [41]).
Описаны аутоантитела Gerbich. В 4 случаях они вызвали тяжелую форму аутоиммунной гемолитической анемии. В 3 из них аутоантитела имели anra-Ge2-специфичность (Gottsche и соавт. [35], Reynolds и соавт. [105], Sererat и соавт. [109]), в одном - anra-Ge3 (Shulman и соавт. [111]). В одном случае аутоантитела относились к IgA (Gottsche и соавт. [35]), в другом - к IgM (Sererat и соавт. [109]). У одного больного Ge+ с наличием аутоантител airra-Ge2 прямой антиглобулиновый тест был отрицательным, аутоантитела выявлялись только после их элюции с эритроцитов (Poole и соавт. [89]). Методом иммуноблоттинга с двумя образцами аутоантител anra-Ge2 было показано, что они взаимодействуют только с гликофорином С. Это отличает их or большинства аллоиммунных антител той же специфичности, которые реагируют с эпитопами Ge2 на гликофорине D (Poole и соавт. [89], Reid и соавт. [104]). У больных, имевших аутоантитела aHra-Ge2, экспрессия антигена Ge2 была снижена.
Аутоантитела анти-ОеЗ в иммуноблоттинге взаимодействовали с гликофори-нами обоих типов и по этому свойству имели сходство с аллоиммунными анти-Ge3-антителами (Reid и соавт. [104]).
Обнаружены аутоантитела с анти-Ое4-подобной специфичностью у пациентки Ge:2,3,4, страдавшей апластической анемией. Эритроциты больной имели эллипсоидную форму. Аутоантитела не вызывали гемолиза in vivo (Beattie, Sigmund [7], Daniels и соавт. [29]). Они реагировали с гликофоринами GPC, GPC.Ge и GPC. Yus, с гликофорином D не реагировали (Daniels и соавт. [29]). Количество гликофорина С в эритроцитах было снижено, гликофорина D - нормальное. Через 2 года аутоантитела исчезли, содержание глифорина С в эритроцитах нормализовалось, эллиптоцитоз не наблюдался. Тем не менее сыворотки из ранее полученных проб продолжали реагировать с эритроцитами женщины (Daniels и соавт. [29]).
Описан необычный случай, когда у больной женщины были найдены анти-Ое2-антитела, при этом ее эритроциты агглютинировались двадцатью образцами аллоиммунных сывороток anra-Ge2, двумя сыворотками, содержавшими аутоантитела aHTH-Ge2, четырьмя сыворотками amn-Ge3 и одной сывороткой aHra-Ge4. Эритроциты больной не реагировали с собственной сывороткой, одной сывороткой aHTH-Ge2, одной сывороткой aHTH-Ge3 и одной сывороткой, содержавшей аутоантитела anra-Ge4. Эритроциты больной содержали гликофорины С, D и GPC. Ge. С помощью молекулярно-генетических методов было показано, что больная имела два очень редких гена GYPC. Один из них (GPC. Ge-подобный) кодировал гликофорин GPC.Ge, другой имел мутацию А 173 Т в экзоне 3. Мутация приводила к замене аспарагина на валин в позиции 58 гликофорина Сив позиции 37 гликофорина D. Антитела, выявленные у больной, реагировали с гликофорином С, имеющим аспарагиновую кислоту в положении 58. С гликофорином, имеющим в этой позиции валин, антитела больной не реагировали (King и соавт. [49]).
Получено несколько серий моноклональных антител, распознающих Gerbich-подобные антигены на гликофорине С, расположенные вблизи области
N-гликозилирования. В серологических реакциях они проявляли себя как анти-
Ge4 (Anderson и соавт, [3], Anstee и соавт. [4, 5], Dahr и соавт. [21], Daniels и соавт. [26], Loirat и соавт. [56], Reid и соавт. [96], Smythe и соавт. [115], Telen и соавт. [123], Uchikawa и соавт. [126], Villeval и соавт. [128]). Большинство распознаваемых этими антителами эпитопов содержало метионин в позиции 1, в формировании некоторых эпитопов участвовали аминокислоты в позиции 16-23 (Reid и соавт. [96], Uchikawa и соавт. [126]).
Мышиные МКА aHTH-Ge2 связывались с гликофорином С (Reid и соавт. [96, 102]) или обоими гликофоринами одновременно.
Показано, что МКА aHTH-Ge2 распознают аминокислоты в позиции 36-39 и 31-40 (Janvier и соавт. [43], Reid и соавт. [96]). Один образц МКА aHTH-Ge2 реагировал с гликофорином GPC.Ge, однако с эритроцитами Ge: -2,-3,4 (Gerbich) реакции не было (Janvier и соавт. [43]). Другой образец МКА amrH-Ge2 класса IgM распознавал эпитоп, расположенный в последовательности 15-22 на гликофорине С, но при этом не реагировал с эритроцитами Ge:-2,-3,4 (Loirat и соавт. [55]). МКА показывали перекрестные реакции с эпитопом в последовательности 22-27, расположенной в цитоплазматическом N-терминальном домене протеина полосы 3.
Получено несколько мышиных МКА со специфичностью aHTH-Ge3 (Loirat и соавт. [56, 57], Smythe и соавт. [115])..
К системе Gerbich отнесены 4 редких антигена: Wb, Lsa, Апа и Dha, получившие обозначения GE5, GE6, GE7 и GE8. Они были включены в систему Gerbich в основном по результатам биохимических исследований, в которых было установлено место их расположения на гликофоринах С и D.
В эритроцитах обладателей редких антигенов Gerbich наряду с атипичными гликофоринами, несущими указанные редкие антигены, содержатся нормальные гликофорины С и D. Индивиды, гомозиготные по редким антигенам, не выявлены.
Wb
Антиген Wb (Webb) описали Simmons и Albrey [112] в 1963 г. Антитела анти-Wb присутствовали в одной из сывороток для определения группы крови АВО. Три образца aHTH-Wb-антител обнаружено при проведении скрининга 7544 сывороток (Bloomfield и соавт. [9], Race, Sanger [90]).
На эритроцитах Wb+ гликофорин С частично замещен атипичным гликофорином (GPC.Wb), имеющим более низкую мол. массу (на 3 кДа ниже, чем гликофорин С) (Macdonald, Gerns [60], Reid и соавт. [101]).
В этироцитах лиц Wb- указанный атипичный гликофорин отсутствует. Однако обработка эритроцитов Wb- эндогликозилазой F, которая отщепляет N-связанные олигосахариды, приводила к уменьшению мол. массы гликофорина С до значений, соответствующих таковым у GPC.Wb. Обработка эндогликозилазой F гликофорина GPC.Wb не оказывала на него влияния.
У лиц Wb+ выявлена мутация А 23 G в экзоне 1 гена GYPC, ведущая к замещению аспарагиновой кислоты серином в позиции 8 молекулы гликофорина С (Chang и соавт. [13], Telen и соавт. [122]).
У лиц Wb- аспарагиновая кислота в положении 8 N-гликозилирована, что обусловливает большую мол. массу нормального гликофорина С по сравнению с атипичным гликофорином GPC.Wb, который в этой точке не N-гликозилирован. Неизвестно, подвергается ли аспарагиновая кислота в положении 8 О-гликозилированию, что, возможно, могло бы привести к появлению нового редкого антигенного эпитопа Gerbich.
Антиген Wb разрушается трипсином и сиалидазой, но устойчив к химотрип-сину (Macdonald, Gerns [60], Reid и соавт. [95,101]).
Lsa
Антигены Lsa (Lewis II) и Rla при сравнении оказались одним и тем же антигеном (Kornstad и соавт. [50, 51]). Он выявляется у финнов и негров с частотой около 2 %, у других народов он встречается реже (табл. 20.5).
Анти-Ь8а-антитела впервые выявлены в анти-В-реагенте для определения группы крови АВО. Другие образцы идентифицированы в сыворотках с комбинированными антителами (Kornstad [50]), а также при выполнении проб на индивидуальную совместимость перед гемотрансфузией (Clark, Dorman [14]). Антитела анти-Ls3 в одном случае сопровождали ГБН, потребовавшую для лечения обменного переливания крови, однако их причинная роль в ГБН осталась недоказаной (Sistonen [ИЗ]). Один образец arnn-Ls* найден при скрининге 4000 сывороток европеоидов (Kornstad и соавт. [51], Race, Sanger [90]). При обследовании 44 ООО доноров японцев найдено 19 образцов сывороток с антителами aHTH-Lsa (Onodera и соавт. [82]).
Таблица 20.5
Распределение редких антигенов Gerbich у разных народов
|
Антиген |
Популяция |
Количество |
Частота, % |
Источник |
|
|
обследованных |
из них Ge+ |
||||
|
Wb (GE5) |
Белые австралийцы |
3 550 |
2 |
0,06 |
[112] |
|
|
Англичане |
15 815 |
3 |
0,02 |
[90] |
|
|
Валлийцы |
10 117 |
8 |
0,08 |
[9] |
|
|
Японцы |
3 470 |
0,00 |
[9,40,75] |
|
|
Lsa (GE6) |
Финны |
1 113 |
18 |
1,62 |
[15,90] |
|
|
Норвежцы |
7 151 |
8 |
0,11 |
[50] |
|
|
Американские негры |
ПО |
1 |
0,91 |
[90] |
|
|
Негры Вест-Индии |
878 |
9 |
1,03 |
[90] |
|
|
Негры Западной Африки |
81 |
2 |
2,04 |
[90] |
|
|
Японцы |
200 000 |
8 |
0,004 |
[82] |
|
|
Англичане |
5 887 |
0,00 |
[90] |
|
|
Ana (GE7) |
Финны |
10 000 |
6 |
0,06 |
[34] |
|
|
Шведы |
3 266 |
2 |
0,06 |
[34] |
|
Dha (GE8) |
Датчане |
2 493 |
0,00 |
[45] |
|
Антиген Lsa чувствителен к действию трипсина, но устойчив к фицину и си-алидазе (Macdonald и соавт. [59]). Ассоциация фактора Lsa с системой Gerbich установлена по наличию на эритроцитах лиц Ls(a+) необычных молекул гликофоринов С и D в дополнение к нормальным. Необычные гликофорины имели мол. массу, превышающую на 5,5 кДа мол. массу нормальных гликофоринов С и D (Macdonald и соавт. [59]).
Указанные атипичные гликофорины реагировали с антителами анти-веЗ. Гликофорин GPC.Ls3 взаимодействовал с МКА aHTH-Ge4 и связывал антитела aHTH-Ge2. Ш
У лиц Ls(a+) выявлена дупликация экзона 3 гена GYPC. Присутствие второго экзона 3 объясняет повышенное содержание в эритроцитах Ge3+ликофорина GPC.Lsa и гликофорина GPD.Lsa.
Предполагается, что возникновение фенотипов Ge:-2,3,4 и Ge:-2,-3,4 является результатом кроссинговера участков с делециями в экзонах 2 и 3 (Colin и соавт. [18], High и соавт. [39]). Неравновесный кроссинговер ведет к образованию гена GYPC с удвоением и выпадением отдельных участков экзонов 2 и 3. Удвоение экзона 3 приводит к синтезу необычной аминокислотной последовательности, которую, очевидно, и распознают анти-Ь8а-антитела. Синтетический пептид (TPTIMDIWIA-EPDRG), представляющий собой 11 аминокислот, кодируемых областью У экзона 3, и 5 аминокислот, кодируемых областью 5', ин-гибировал активность анти-Ь8а-антител (Stony и соавт. [119]).
Удвоение экзона 2 не приводило к какой-либо необычной аминокислотной последовательности в гликофорине и не сопровождалось появлением новой антигенной специфичности Gerbich.
Моноклональные антитела к одному из эпитопов гликофорина С (СВС-96) реагировали с эритроцитами Ls(a+) сильнее и в существенно большем разведении, чем с эритроцитами Ls(a-).
Onodera и соавт. [82], Uchikawa и соавт. [125, 126] исследовали эритроциты 200 ООО доноров японцев с помощью МКА анти-СВС-96 и нашли 60 образцов эритроцитов, дававших сильные положительные реакции; 8 из них были Ls(a+). Среди указанных 8 образцов в 1 образце эритроцитов экспрессия антигена Lsa была особенно высока. Эритроциты содержали необычные гликофорины С и D (GPC.KS и GPD.KS), отличавшиеся от гликофоринов GPC.Ls3 и GPD. Lsa большей (на 6 кДа) мол. массой. Молекулярно-генетическое исследование показало утроение экзона 3 гена GYPC. У 40 (0,02 %) лиц выявлено удвоение экзона 2 GYPC вследствие неравновесного кроссинговера. В отдельных случаях кроссинговер сопровождался делецией части экзона 2, что обусловливало возникновение фенотипа Ge:-2,3,4. У 6 (0,003 %) лиц указанные выше авторы выявили учетверение экзона 2, которое, как и ожидали авторы, не сопровождалось появлением качественно новых антигенов Gerbich (High и соавт. [39]).
Апа
Редкий антиген Ana (Ahonen) описан Furuhjelm и соавт. [34]. Его частота составляет 0,06 % среди финнов и шведов. Антитела анти-Апа имели естественное происхождение и встречались с частотой 1 : 1000 среди здоровых лиц (Furuhjelm и соавт. [34]).
Антиген Апа разрушался под воздействием трипсина, папаина и сиалидазы.
Daniels и соавт. [28] посредством иммуноблоттинга с выделенными из эритроцитов Ап(а+) гликофоринами показали, что антиген Апа располагается в гликофорине D, а в гликофорине С он отсутствует. При анализе кДНК 2 лиц Ап(а+) выявлена нуклеотидная замена G 67 Т в экзоне 2. Данная мутация приводила к замене аланина на серии в позиции 23 гликофорина С и позиции 2 гликофорина D. Результаты титрования анти-Ое2-антител с использованием эритроцитов Ап(а+) и Ап(а-) указывали на то, что гликофорин GPD.Ana вариабелен. Некоторые образцы анти-Ое2-антител с ним не реагировали.
Dha
Антитела анти-Dh* обнаружили Jorgensen и соавт. [45] у датчанина при проведении пробы на индивидуальную совместимость перед гемотрансфузи-ей. Антитела относились к IgM и, судя по анамнезу реципиента, имели естественное происхождение. Вскоре найдены еще 2 донора, имевших анти-ОЬа-антитела, что позволило Spring и соавт. [117] обследовать три поколения одной английской семьи и выявить 8 человек Dh(a+).
Антиген Dha оказался устойчив к действию химотрипсина. Обработка эритроцитов трипсином, фицином, папаином, проназой и сиалидазой его разрушала (Jorgensen и соавт. [45], Spring и соавт. [117]).
Посредством иммуноблоттинга с использованием специфических антител и гликофорина, выделенного из эритроцитов, показано, что антигенные детерминанты Dha расположены на гликофорине С. На гликофорине D антиген Dha отсутствует, поскольку контролирующий его кодон расположен вне участка, обеспечивающего синтез гликофорина D (Spring [118]).
При обследовании 2 сибсов Dh(a+) с использованием молекулярно-генетических методов выявлена нуклеотидная замена С 40 Т в экзоне 1 гена GYPC и соответственно замещение лейцина на фенилаланин в позиции 14 (King и соавт. [46]).
Антиген Dha не разрушался эндогликозидазой F и не был N-гликозилирован в позиции 8, которую занимает аспарагиновая кислота (Spring [118]). Тот факт, что антиген Dha чувствителен к сиалидазе, дал основание полагать, что для формирования эпитопов Dha необходимо О-гликозилирование гликофорина С. Искусственно сконструированный пептид NSTAWPFSLEPNPG, повторяющий последовательность 8-21 гликофорина GPC.Dha, специфически ингибировал анти-011а-антитела (Stony и соавт. [119]).
GEIS
В 2004 г. появилось краткое сообщение Yabe и соавт. [130] о выявлении у японской женщины антител к редко встречающемуся антигену - IS. Авторы установили, что антитела открывают эпитопы, расположенные на гликофоринах С и D. Экспрессия антигена была обусловлена заменой треонина на аспарагин в положении 32 гликофорина С и позиции 11 глифокорина D. Указанная мутация явилась результатом замещения С 95 А. Антиген обнаружен только у японцев. Его частота менее 0,1 %. В 2004 г. указанный антиген включен в систему Gerbich с обозначением GEIS (GE9).
Gerbich-отрицательные фенотипы у европеоидов крайне редки. При обследовании более 45 тыс. европейцев Gerbich-отрицательный фенотип выявлен лишь у одного (табл. 20.4). Существенно чаще люди, лишенные антигенов Gerbich, встречаются среди жителей Папуа - Новой Гвинеи.
Многие Gerbich-отрицательные лица выявлены в связи с присутствием в сыворотке их крови антител Gerbich (Anstee и соавт. [5], Barnes, Lewis [6], Daniels
и соавт. [29, 3], McLouglin, Rogers [66], Muller и соавт. [74], Nunn и соавт. [78], Okubo и соавт. [81], Peddle и соавт. [87], Reid и соавт. [91, 98], Rosenfield и соавт. [106], Rountree и соавт. [107], Sacks и соавт. [108]).
Фенотип Yus (Ge: -2,3,4) встречается реже, чем Ge:-2,-3, но такое соотношение может отражать лишь неодинаковую способность лиц с указанным фенотипом к антителообразованию (Daniels [25], Reid и соавт. [91]).
Лица Ge:-2,3,4 были обнаружены среди арабов, турок-киприотов и евреев, а также у негров.
Исследования посредством SDS-PAGE и иммуноблоттинга с МКА показано, что эритроциты Ge:-2,3,4 не содержат гликофорины С и D. Однако они несут гликофорин-С-подобную структуру с мол. массой 32,5-36,5 кДа, промежуточную между гликофоринами С и D (Anstee и соавт. [5], Dahr и соавт. [23], Reid и соавт. [94]). В эритроцитах гетерозигот GYPC'/GYPC. Yus гликофорины С и D присутствуют (Reid и соавт. [ 102]).
Анализ геномной и кодирующей ДНК показал, что лица Ge:-2,3,4 гомозиготны по гену GYP С. Yus, в котором экзон 2 подвергся делеций (Chang и соавт. [13], High и соавт. [39], Johnson, Daniels [44]). Продуктом указанного гена является гликофорин-С-подобный протеин без аминокислот в позициях 17-35, экспрессия антигенов Ge3 и Ge4 при этом сохранена. Вторая стартовая точка трансляции (Met 22) отсутствует, поэтому не происходит синтеза гликофорина D, несущего антиген Ge2.
Локализация эпитопов Ge2-4 на гликофорине С и D
Частота Gerbich-отрицательных фенотипов у разных народов
|
Реагент, использованный при обследовании |
Популяция |
Количество обследованных |
Количество лиц Ge- |
Источник |
|
AHTH-Ge2 |
Англичане, датчане |
28 331 |
[66,90,106] |
|
|
Анти-веЗ |
Жители Нью-Йорка |
11000 |
[106] |
|
|
|
Французы |
5 912 |
1 |
[74,90] |
|
Всего: |
45 243 |
1 |
|
|
|
AHTH-Ge2 |
Жители Папуа - Новой Гвинеи: |
|||
|
|
провинция Сепик |
748 |
182 |
[П] |
|
|
провинция Моробе |
1014 |
517 |
|
|
|
Всего: |
1 762 |
699 |
|
|
Анти-Ge (точная специфичность неизвестна) |
Жители Таиланда |
4 253 |
1 |
[12] |
|
Анти-Ое2 |
Японцы |
22 ООО |
[81] |
|
Фенотип Ge:-2, 3, 4 может быть также результатом гетерозиготности по GYPC.Yus/GYPC.Ge (Loirat и соавт. [58], Moulds и соавт. [72]). У 5 из 10 лиц Ge:-2, 3 определялись оба типа гликофоринов - Yus и Ge (Moulds и соавт. [72]).
Фенотип Ge:-2,-3,4 является типичным Gerbich-отрицательньш. Он оказался полиморфным в некоторых районах Папуа - Новой Гвинеи (Booth, McLouglin и соавт. [11]). В других географических зонах земного шара фенотип Ge:-2,-3 встречается крайне редко, лишь в единичных случаях он был найден у европеоидов и негроидов, а также у монголоидов (японцев) и австралоидов (полинезийцев). Посемейные исследования показали, что гены, обусловливающие фенотип Ge:-2,-3, передаются по наследству (Nunn и соавт. [78], Okubo и соавт. [81], Reid и соавт. [100,102], Rosenfield и соавт. [106]).
Подобно эритроцитам Ge:-2,3,4, эритроциты Ge:-2,-3 не содержат гликофорины С и D, однако несут гликофорин-С-подобную структуру GPC.Ge с мол. массой 30,5-34,5 кДа, несколько меньшей по сравненю с мол. массой GPC.Yus. По электрофоретической подвижности вещество GPC.Ge занимает промежуточное положение между гликофоринами С и D (Anstee и соавт. [5], Dahr и соавт. [23], Reid и соавт. [94]). Гликофорин Gerbich-типа (GPC.Ge) содержит антиген Ge4, антиген Ge3 в нем отсутствует (Anstee и соавт. [5], Reid и соавт. [94]). В отличие от гликофоринов С, D и GPC.Yus, GPC.Ge устойчив к действию трипсина (Anstee и соавт. [5]). Моноклональные антитела к GPC.Ge (aHTH-Ge4) агглютинируют эритроциты Ge:-2,-3,4, обработанные трипсином. Они также агглютинируют эритроциты лиц, гетерозиготных по гену Ge~2,~3,4.
Фенотип Ge:-2,-3,4 возникает в результате делеций экзона 3 GPC (Colin и соавт. [18], Chang и соавт. [13], High и соавт. [39], Loirat и соавт. [58], Serjeantson и соавт. [ПО]). Аллель GPC.Ge кодирует гликофорин-С-подобную структуру, лишенную аминокислот в положениях 36-63. GPC.Ge несколько меньше гликофорина GPC.Yus, поскольку экзон 2 лишен вставки из 27 нуклеотидов, присутствующей в экзоне 3.
Еще один Gerbich-отрицательный фенотип, Ge:-2,-3,-4, получил обозначение Leach. Он является истинно нулевым фенотипом: эритроциты лиц с указанной редкой группой крови лишены всех антигенов системы Gerbich. В литературе имеются описания шести лиц Ge:-2,-3,-4. Все они оказались европеоидами (англичане, американцы) (Anstee и соавт. [5], Daniels и соавт. [30], McShane, Chung [67], Reid и соавт. [98], Rountree и соавт. [107]).
В двух семьях удалось показать наследование рецессивных генов, обусловливающих возникновение фенотипа Ge:-2,-3,-4 (Daniels и соавт. [30], Reid и соавт. [98]). На эритроцитах лиц с этой крайне редкой группой крови гликофорины С и D полностью отсутствуют (Anstee и соавт. [5], Daniels и соавт. [30], High и соавт. [39], Reid и соавт. [94, 98]).
Фенотип Leach (Ge:-2,-3,-4) может быть обусловлен разными причинами. У 5 не состоящих в родстве лиц, выявлена делеция экзона 3 и 4 гена GYPC (High и соавт. [39], Johnson, Daniels [44], Telen и соавт. [121], Winardi и соавт. [129]). В то же время из ретикулоцитов лиц Ge:-2,-3,-4 были выделены обычные транскрипты гена GYPC (Winardi и соавт. [129]).
У другого индивида Ge:-2,-3,-4 выделен полноценный ген GYPC, однако при секвенировании экзона 3 отмечена мутация, образующая стоп-кодон в позиции 56 (Telen и соавт. [121]). При этом не транслировалась большая часть экзона 3 и весь экзон 4. Тем не менее у обследуемых был выявлен небольшой фрагмент с мол. массой 12 кДа, напоминавший терминальную часть гликофоринов С и D (Pinder и соавт. [88]). В связи с этим высказано предположение, что трансляция дефектного гена GYPC может начинаться в других точках.
Имеется несколько сообщений о низкой экспрессии на эритроцитах Ge:-2,-3 антигенов Kell. Степень подавления у индивидов Ge:-2,-3 варьировала (Anstee и соавт. [5], Daniels и соавт. [25, 30], McShane, Chung [67], Nash и соавт. [77], Okubo и соавт. [81]). Снижение экспрессии отмечено в отношении часто встречающихся антигенов Kell, в также антигена KEL1. У одного индивида отмечена слабая экспрессия антигена KEL11 (Daniels [25]), выраженность других антигенов соответствовала норме. В 9 из 11 образцов эритроцитов Ge:-2,-3 отмечена слабая выраженность антигенов Kell. В то же время шесть образцов эритроцитов Ge:-2,3 имели нормальную экспрессию этих антигенов.
У 4 лиц Ge:-2,-3,-4 экспрессия антигенов Kell была слабой (Anstee и соавт. [5], Daniels и соавт. [30], McShane, Chung [67]).
Фенотипическая зависимость антигенов Kell от системы Gerbich реализуется, по-видимому, не на генетическом уровне, поскольку гены, контролирующие синтез вещества Gerbich и вещества Kell, расположены на разных хромосомах и непосредственное влияние их друг на друга исключено.
В 1960-х годах полагали, что существует один антиген Gerbich, выявляемый сывороткой миссис Gerbich и двумя другими однотипно реагирующими сыворотками. Этот антиген был описан Rosenfield и соавт. [106] и позднее получил обозначение Ge3. В 1961 г. Barnes и Lewis [6] нашли еще один антиген этой системы - Ge2, выявляемый сывороткой миссис Yussef. И наконец, в середине 80-х годов Anstee и соавт. [5], Daniels и соавт. [26], McShane и Chung [67] обнаружили антитела, идентифицирующие третий часто встречающийся антиген - Ge4.
Ge2, Ge3 и Ge4
Как установили Barnes и Lewis [6], эритроциты миссис Yussef, жительницы Кипра турецкого происхождения, агглютинировались сывороткой Gerbich, но не реагировали с сыворотками анти-Ge, полученными от других лиц Ge-. ыворотка миссис Yussef содержала антитела, реагировавшие со всем образцами эритроцитов за исключением собственных эритроцитов и эритроцитов трех ранее найденных Ge-отрицательных лиц. Адсорбция сыворотки Gerbich эритроцитами Yussef полностью устраняла ее активность. Таким образом, с помощью двух разнореагирующих сывороток (Gerbich и Yussef) были идентифицированы два антигена системы Gerbich.
Обследование жителей Папуа - Новой Гвинеи позволило получить новые данные об этой системе. Booth и соавт. [10, 11] нашли Gerbich-ассоциированные антитела у меланезийца Ge+, которые не реагировали с эритроцитами лиц, имевших фенотип Gerbich и Yus, а также с эритроцитами 15 % меланезийцев Ge+. Стало очевидным, что существует третья разновидность анти-Ое-антител, с помощью которой можно идентифицировать три Ge-отрицательных фенотипа, каждый из которых лишен одного из трех антигенов, составляющих систему Gerbich (табл. 20.3).
Таблица 20.3
Редкие фенотипы Gerbich
|
Носительница антител |
Фенотип |
Специфичность антител |
|
Mrs. Yussef |
Ge:-2,3,4 |
aHTH-Ge2 |
|
Mrs. Gerbich |
Ge:-2,-3,4 |
aHTH-Ge3 |
|
Mrs. Leach |
Ge:-2,-3,-4 |
aHTH-Ge4 |
Однако эритроциты меланезийца Ge:-1,2,3 и его анти-Gel-сыворотка вскоре стали недоступны. Соответственно, меланезийский вариант Gerbich-отрицательного фенотипа (Ge:-1,2,3) и анти-Gel-антитела не вошли в классификацию и больше не используются (Booth и соавт. [11,61], Daniels [24]).
Anstee и соавт. [5] и Daniels и соавт. [26] обнаружили, что некоторые исследованные ими моноклональные антитела обладали Gerbich-ассоциированной специфичностью. Эти антитела реагировали со всеми образцами эритроцитов Ge+ и Ge-, включая эритроциты Ge:-2,-3. В то же время были найдены образцы эритроцитов Ge:-2,-3, которые не реагировали с Gerbich-ассоциированными МКА (Anstee и соавт. [4, 5]). Этот Gerbich-отрицательный фенотип получил название Leach. Антитела, имевшиеся у миссис Leach, давали реакции, сходные с реакциями Gerbich-ассоциированных МКА. Антиген, открываемый ими, получил обозначение Ge4 (McShane, Chung [67]). Фенотип Leach обозначен в цифровой номенклатуре как Ge:-2,-3,-4. Все другие образцы эритроцитов содержат антиген Ge4 (см. табл. 20.3).
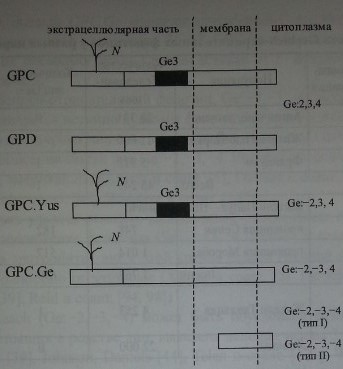
Посредством иммуноблоттинга с использованием нескольких образцов анти-Ое2-антител показано, что антиген Ge2 распологается на гликофорине D (рис 20.6). Гликофорин С не содержит этот антиген (Dahr и соавт. [22], Reid и соавт. [94]). Эпитопы Ge2 расположены на N-терминальном пептиде гликофорина D (аминокислоты в позициях 1-27) (Dahr и соавт. [22]). Обработка эритроцитов трипсином или папаином разрушает антиген Ge2, в то время как химотрипсин и проназа на него не действуют (Daniels [25]). Примерно половина образцов анти-Ое2-антител реагировала слабее с эритроцитами, обработанными сиалидазой (Daniels [25]).
Поскольку гликофорин D является укороченным аналогом гликофорина С анти-Ое2-антитела могут распознать аминокислотную последовательность, если она находится на N-терминальном участке гликофорина D, но не на гомологичном участке гликофорина С. Вместе с тем в образовании эпитопа Ge2 могут участвовать свободные аминогруппы гликофорина D. Некоторые образцы анти-Ое2-антител не реагируют с эритроцитами, обработанными уксусным ангидридом. Это дает основание полагать, что аминогруппы также вовлечены в формирование эпитопов, распознаваемых анти-Ое2-антителами. Анти-Ое2-антитела, по-видимому, являются гетерогенными и распознают эпитопы на разных участках гликофорина D, в том числе на N-терминальном участке (Daniels и соавт. [28]).
Подобно антигену Ge2, антиген Ge3 разрушается трипсином. К химотрипси-ну и проназе он устойчив. В отличие от Ge2 антиген Ge3 устойчив к действию папаина (Mohammed и соавт. [70]). Соответственно эритроциты, обработанные папаином, можно использовать для дифференциации антител aHTH-Ge2 от анти-Ge3 при отсутствии эритроцитов редкого фенотипа Ge:-2,3,4.
Методом иммуноблоттинга с МКА было показано, что эпитопы Ge3 локализуются на гликофоринах С и D (рис. 20.6) (Dahr и соавт. [22], Loirat и соавт. [56, 57], Reid и соавт. [94], Smythe и соавт. [115]). Аллоиммунные анти-веЗ-антитела удавалось элюировать с гликофоринов обоих типов (Reid и соавт. [94]).
Антиген Ge3 кодируется экзоном 3 GYPC. При делеций указанного участка антиген Ge3 отсутствует. Делеция экзона 2 не приводит к исчезновению экспрессии Ge3. Экзоны 2 и 3 имеют большое сходство и различаются лишь вставкой из 27 нуклеотидов, кодирующих аминокислоты в позициях 42-50 на гликофорине С и 21-29 - на гликофорине D, поэтому эпитопы Ge3 присутствуют именно в указанных областях соответствующих гликофоринов (Dahr и соавт. [22]).
Антиген Ge4 располагается в N-терминальной части гликофорина С (см. рис. 20.6). На гликофорине D он отсутствует (Anstee и соавт. [4, 5], Dahr и соавт. [21], Daniels и соавт. [29]).
Детальный анализ специфических МКА показал, что некоторым из них для связывания эпитопами Ge4 требовалась аминогруппа в позиции Metl на гликофорине С. В то же время другие МКА распознавали эпитопы среди первых 20 аминокислот гликофорина С и Metl в реакцию вовлечен не был (Anstee и соавт. [5], Dahr и соавт. [21]). Более значимым для связывания антител оказалось О-гликозилирование гликофорина С. Антиген Ge4 разрушается трипсином и папаином.