Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система Chido/Rodgers
Клиническое значение
Антитела системы Chido/Rodgers чаще представлены иммуноглобулинами субклассов IgG2 и IgG4 (Szymanski и соавт. [88]), в связи с чем их не относят к трансфузионно опасным. Указанные антитела ни разу не описаны в качестве причины посттрансфузионных осложнений и ГБН.
Тесты с радиоактивной меткой показали, что сроки циркуляции эритроцитов Ch+, введенных реципиентам, имеющим анти-СЬ-антитела, не отличаются от контрольных (Harris и соавт. [40], Middleton [53], Moore и соавт. [57], Nordhagen, Aas [60], Silvergleid и соавт. [84], Strohm, Molthan [86], Tilley и соавт. [91]).
Антитела указанной системы описаны как причина анафилактических реакций, которые развились после переливания свежезамороженной плазмы (Lambin и соавт. [44], Westhoff и соавт. [94], Wibaut и соавт. [96]).
Биологическая роль
Компонент С4, как и другие факторы комплемента, участвует в системе иммунологического надзора, обеспечивая постоянство внутренней среды организма, элиминацию стареющих и перерождающихся клеток.
Каскадная активация факторов 1-9 комплемента во взаимодействии с антителами приводит к разрыву мембраны клеток-мишеней и их гибели.
Связь с заболеваниями
Дефицит С4-компонента комплемента и сопровождающий его нулевой фенотип Ch-Rg- наблюдают при системной красной волчанке (СКВ). Одной из причин этого заболевания является неэффективная элиминация аутоиммунных комплексов из-за отсутствия компонента С4 (Moulds [58], Porter [72]).
У больных СКВ наблюдалась делеция гена, контролирующего синтез С4А (Dunckley и соавт. [17], Fan и соавт. [19], Fielder и соавт. [20], O'Neill и соавт. [65], Reveille и соавт. [74]).
Симптомы СКВ существенно чаще проявлялись у лиц Rg-, гомозиготных по гаплотипу ШШШШ чем у индивидов Rg+ (Edwards-Moulds и соавт. [18]).
Выявлена также корреляция между гаплотипом C4A*Q0 и другими видами аутоиммунной патологии: ревматоидным артритом, подострым склерозирую-щим панэнцефалитом, хроническим активным гепатитом и инсулин-зависимым диабетом (Schenkel-Brunner [83]).
Антитела анти-Ch обнаружили Harris, Tegoli, Swanson и соавт. в 1967 г. [40]. Все образцы сывороток анти-Ch, имевшихся в распоряжении авторов, были получены от реципиентов, которым производили гемотрансфузии. Шесть из 7 сывороток содержали моноспецифические анти-СЬ-антитела. Авторы квалифицировали их как нечеткие из-за низкой авидности положительных реакций. Выраженность антигена, открываемого антителами анти-Ch, сильно варьировала. В некоторых случаях слабоположительные пробы трудно было отличить от отрицательных. Пробы с адсорбцией антител на эритроцитах также не давали стабильных результатов.
Позднее Middleton и Crookston [54] обнаружили, что активность анти-Ch-антител ингибируется плазмой крови, полученной от лиц Ch+. Плазма лиц Ch-aHTH-Ch-антитела не ингибировала.
Atkins [1] отметил, что выраженной ингибирующей способностью обладает плазма лиц и со слабоэкспрессированным на эритроцитах антигеном Ch. Таким образом было показано, что реакция нейтрализации специфических анти-Ch-антител плазмой исследуемого лица более приемлема для определения антигенов Chido, чем прямая реакция гемагглютинации.
Eolthan [56] и Swanson [87] установили, что эритроциты Ch- можно преобразовать в Ch+ путем инкубации в плазме лиц Ch+, что еще раз подчеркивает происхождение этого антигена из плазмы.
В 1976 г. Longster и Giles [47] описали aHra-Rg-антитела, напоминавшие анти-Ch. Они выявляли антиген, имевший частоту приблизительно 97 %, ингибирова-лись плазмой от лиц Rg+. Экспрессия антигена, подобно Ch, также варьировала в широких пределах. Около 3 % обследованных имели фенотип Ch-Rg- Оказалось, что этот фенотип ассоциирован с наличием у таких лиц антигена HLA-B8 системы HLA (Giles и соавт. [32], James и соавт. [43]). Ген Rg наследовался кодоминантно.
Образцы плазмы лиц Rg+ проявляли неодинаковую активность в реакции ингибиции специфических антител. Как было установлено Giles и соавт. [22, 23, 24], Nordhagen и соавт. [62, 63, 64], неполная ингибиция антител обусловлена присутствием в сыворотках нескольких разновидностей антител анти-Ch и анти-Rg. Использование стандартизированных реагентов давало более удовлетворительные результаты (Lomas и соавт. [46], Rittner и соавт. [76]).
Особенностью антител системы Chido/Rodgers является их низкая авид-ность в реакции с нативными эритроцитами, даже если антитела имеют высокий титр. Эритроциты, предварительно сенсибилизированные комплементом в растворе сахарозы, приобретают способность непосредственно агглютинироваться указанными антителами. Этот методический прием часто используют при фенотипировании по Chido/Rodgers и скрининге антител этой системы.
При установлении специфичности антител большое значение придают тестам на ингибицию активности антител смесями сывороток от нескольких лиц. Для ее проведения достаточно 30-минутной экспозиции тестовой сыворотки с исследуемой смесью при комнатной температуре (Issitt, Anstee [42]). Далее активность антител исследуется повторно с эритроцитами, сенсибилизированными комплементом. Исчезновение активности указывает на присутствие антигенов системы Chido/Rodgers.
Практически все сыворотки анти-Rg содержат антитела анти-Rg 1 и анти-Rg2. Все сыворотки анти-Ch содержат анти-Ch 1-антитела, которые часто оказываются моноспецифическими (Giles и соавт. [22,23, 33]).
Частота антител в анти-СЬ-сыворотках составила: анти-СЬ4 - 75 %, анти-Ch2 - 25 %, aHTH-Ch5 - 16 %, анти Ch3 - 10 %.
Обнаружено всего по два образца сывороток с антителами анти-СЬб и анти-WH.
Антитела анти-Ch обычно находили у лиц с нулевым фенотипом -Ch:—1,-2,-3,-4,~5,~6. Антитела анти-Rg присутствовали у индивидов Rg:-l,-2.
Описаны анти-С112 + СЬ5-антитела у человека, имевшего фенотип Ch: 1,-2,3,4,-5,6 (Giles и соавт. [33]). Ahth-C1i2+СЬ4-антитела найдены у индивида Ch: 1,-2,3,-4,5,6 (Fisher и соавт. [21]), анти-Ch 1-антитела - у лица группы Ch:-l,-2,-3,-4,5,6 (Poole и соавт. [71]). Комбинированные anra-Chl+Ch3+Ch4-антитела присутствовали у индивида Ch:~l,-2,-3,-4,5 (Poole и соавт. [71]).
В сыворотках крови лиц Ch-Rg- (С4-дефицитных) найдены антитела, которые отличались от всех других антител системы Ch/Rg (Giles, Swanson [36]).
В двух сыворотках анти-Rg, содержавших антитела анти-Rg 1 и aHTH-Rg2, были найдены сопутствующие антитела, открывающие антигенные детерминанты на р-цепях компонента С4 (Robson и соавт. [77]). Антитела не удалось отделить путем адсорбции от aHTH-Rg2, что указывает на определенную связь между антигеном Rg2 и антигенами (3-цепи С4.
К настоящему времени получено большое количество мышиных моноклональных антител к С4-компоненту комплемента человека. Некоторые из них обладают специфичностью анти-Ch 1, анти-Rg 1 и анти-СЬЗ
Эритроциты, сенсибилизированные in vitro протеином С4, непосредственно агглютинируются антителами анти-Ch и анти-Rg. Нативные эритроциты реагируют с указанными антителами только в непрямой антиглобулиновой пробе (Tilley и соавт. [92]). Эта особенность связана с низким уровнем адсорбции эритроцитами протеина С4 in vivo (Atkinson и соавт. [2]).
Сенсибилизацию эритроцитов комплементом in vitro проводят посредством их инкубации со свежей нативной сывороткой в 10% сахарозе. При этом клетки могут быть сенсибилизированы как собственным комплементом, так и привнесенным с плазмой другого АВО-совместимого лица (Giles [26], Tilley и соавт. [92]). Этот методический прием используют при определении группы Ch/Rg, а также при стандартизации антиглобулиновых реагентов (для выявления антикомплементарных анти-С4-антител, которые считаются нежелательными при выполнении непрямой антиглобулиновой пробы).
Антигены Ch/Rg на нативных эритроцитах, не сенсибилизированных комплементом в 10% сахарозе, разрушаются трипсином, химотрипсином, папаином, фицином и проназой (Atkins [1], Longster, Giles [47], Middleton, Grookston [54], Nordhagen и соавт. [61], Tilley и соавт. [92]). Путем подсчета молекул C4d, связанных с эритроцитами, было показано, что их количество уменьшается в 2 раза после обработки трипсином (Giles и соавт. [29]). Антигены Ch/Rg устойчивы к действию сульфгидрила и сиалидазы, однако эритроциты, обработанные сиалидазой, утрачивают способность адсорбировать комплемент в растворе сахарозы (Wilfert и соавт. [97]). На этом основании полагают, что связывание компонента С4 с эритроцитами отчасти зависит от сиаловых кислот. В эритроцитах лиц, имеющих редкие группы крови Еп(а-) и Мк по системе MN, содержание сиаловой кислоты низкое, и антигены Ch/Rg на них также слабо выражены (Tippett и соавт. [93]).
Отмечена низкая экспрессия указанных детерминант на эритроцитах пуповинной крови, однако сыворотки крови новорожденных ингибировали антитела анти-Ch и анти-Rg так же активно, как и плазма взрослых людей (Atkins [1], Middleton, Crookston [54], Nordhagen и соавт. [61].
Существуют 4 основных серологических метода для определения фенотипа Ch/Rg (Daniels [15]).
- прямая агглютинация исследуемых эритроцитов реагентами анти-Ch и анти-Rg;
- нейтрализация активности стандартных реагентов анти-Ch и анти-Rg плазмой обследуемого лица с последующим учетом результатов по пассивной агглютинации стандартных эритроцитов;
- агглютинация эритроцитов, сенсибилизированных собственным комплементом;
- агглютинация аллогенных эритроцитов, сенсибилизированных комплементом обследуемого индивида.
Антигены Chi, Ch2 и Ch3 выявляют используя нативные эритроциты, без предварительной сенсибилизации комплементом (Atkins [1]).
Предложено несколько методов определения аллотипов С4: иммунофик-сация десиалилированной плазмы, электрофорез в полиакриламидном геле (SDS-PAGE), иммуноблоттинг с антителами анти-С4, анти-Ch и анти-Rg (Giles, Robson [35],
С помощью реакции нейтрализации специфических антител выявлено три фенотипа Rodgers: Rg+, Rg- и частично ингибирующий Rg+ (Longster, Giles [47]), а также четыре фенотипа Chido: Ch+, Ch- и два частично ингибирующих Ch+ (Giles и соавт. [24], Nordhagen и соавт. [63]).
Идентифицированы две разновидности антител анти-Rodgers (анти-Rgl и aHTH-Rg2) и три разновидности антител анти-Chido (анти-Chl, анти-Сп2 и анти-Ch3), распознающих антигены, имеющие высокую частоту.
Плазма Rg+, полностью ингибирующая aнти-Rodgers-aнтитeлa, была получена от лиц с фенотипом Rg:l,2. Плазма Rg-, не ингибирующая указанные антитела, принадлежала индивидам Rg:-l,-2. Частичную ингибицию анти-Rodgers-антител вызывала плазма лиц Rg:l,-2. Фенотип Rg:-1,2 не найден.
Плазма, ингибирующая активность aHTH-Chido-антител, получена от лиц Ch: 1,2,3, плазма, не обладающая такой способностью, - от индивидов Ch:-l,-2,-3. Плазма лиц Ch:l,-2, 3, Ch:l,2,-3 и Ch:l,-2,3 вызывала частичную ингибицию антител анти-Chido. Три последних фенотипа встречаются редко (Giles и соавт. [38], Skanes и соавт. [85]). Фенотипы Ch:—1,2,3 и Ch:—1,-2,3 не найдены (Yu и соавт. [100]).
Молекулы С4 экспрессируют антиген Rgl или Chi. Оба антигена вместе на эритроцитах не присутствуют.
Частично ингибирующий фенотип Rg:l,-2 находят преимущественно у лиц, наследующих гаплотип C4A*3A*2B*Q0. Отмечена выраженная ассоциация фенотипа Ch:l,-2, 3 с гаплотипом С4В*2, фенотипа Ch:l,2,-3 с гаплотипами С4А*6В*1 и С4А*ЗВ*1. В остальном фенотипы Ch и Rg не коррелируют с алло-типами С4 (Giles и соавт. [28]).
Серология системы Ch/Rg еще более усложнилась после открытия Giles [27] трех новых часто встречающихся антигенов: Ch4, Ch5 и Ch6. Антитела к этим детерминантам могут быть выявлены только с использованием эритроцитов Ch:-1,-2,-3, нагруженных компонентом С4 различных аллотипов, в том числе с обратной антигенностью Ch/Rg.
Антиген Ch4 свойствен всем С4В-аллотипам, но не встречается при наличии нулевых гаплотипов: C4B*Q0 и C4A*1B*Q0. Последний кодирует антигены Chi и Ch3 в отсутствие Rgl и Rg2.
Антиген Ch5 ассоциирован с Ch2 на протеине С4В, но может присутствовать
Антиген Ch6 ассоциирован с Ch3 на протеине С4В, однако в отличие от Ch3 всегда присутствует у лиц Rg:l,-2.
Еще один антиген системы Ch/Rg - WH - был выявлен Giles, Jones [34] у мужчины, получавшего множественные гемотрансфузии. Сыворотка реципиента содержала также антитела анти-Chl и анти-Сп4.
Антиген WH экспрессируется в том случае, если присутствуют антигены Ch6 и Rgl одновременно, а антиген Rg2 отсутствует (Giles, Jones [34], Moulds и соавт. [59]).
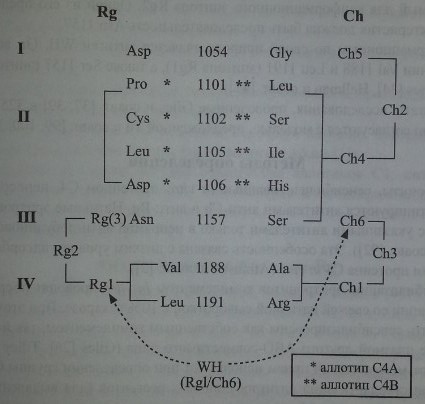
Yu и соавт. [99, 100, 101] предложили модель, объясняющую формирование антигенных детерминант Ch/Rg
Антигенная модель системы Chido/Rodgers
Первый тип - мутационные антигены (антигены последовательностей), то есть антигены, специфичность которых обусловлена разной последовательностью (заменами) аминокислот в одних и тех же позициях протеина. К этому типу относятся антигены Chi, Ch4, Ch5, Ch6 и Rgl.
Второй тип - конформационные антигены. Их экспрессия зависит от того или иного сочетания мутационных антигенов. К конформационным антигенам относятся Ch2, Ch3 и Rgl.
Молекулярная основа мутационных антигенов: для экспрессии антигена Chi необходимо присутствие Ala 1188 и Arg 1191, для экспрессии антигена Ch6 необходимо присутствие Ser 1157, эпитоп Ch4 формируется Leu 1101, Ser 1102, Не 1105 и His 1106, эпитоп Ch5 формируется Gly 1054,
антиген Rgl присутствует при последовательности Val 1188 и Leu 1191.
Молекулярная основа конформационных антигенов: эпитоп Ch2 формируется при одновременном присутствии антигенов Ch4 и Ch5, для эпитопа Ch3 необходимо присутствие антигенов Chi и Ch6, антиген Rg2 требует присутствия антигена Rgl и последовательности Asn 1157.
Полагают, что должен существовать еще один мутационный антиген - Rg3, необходимый для конформационного эпитопа Rg2. Одной из его предполагаемых характеристик должна быть последовательность Asn 1157.
Конформационным по своей природе является антиген WH. Он возникает при наличии Val 1188 и Leu 1191 (эпитопа Rgl), а также Ser 1157 (эпитопа Ch6) (Giles, Jones [34], Hellman и соавт. [41]).
Компонент С4 комплемента представляет собой полипептидную цепь с мол. массой 200 кДа, состоящую из трех фрагментов: а (95 кДа), р (75 кДа) и у (30 кДа). Все три полипептида гликозилированы и связаны между собой дис-ульфиднми мостиками (рис. 19.1). Цепи а С4А и С4В имеют мол. массу 96 и 94 кДа соответственно (Lundwall и соавт. [48], Roos и соавт. [78, 79]), обладают наибольшей биологической активностью и обусловливают антигенные различия С4-компонента комплемента. Они состоят из относительно большого фрагмента С4Ь и короткого N-терминального фрагмента С4а. Связанный с мембраной полипептид С4Ь под влиянием фактора I комплемента преобразуется в C4d. Сходное действие в отношении С4Ь оказывает трипсин (Law, Reid [45]).
Rosenfield и соавт. [80], использовав метод электрофореза, установили, что компонент С4 комплемента неоднороден и состоит из отдельных фракций.
Последующие исследования с помощью иммуноэлектрофореза в геле позволили O'Neill и соавт. [67], Teisberg и соавт. [89] определить, что С4-компонент комплемента у большинства людей присутствует в виде одного из трех типов (рис. 19.2). Первый тип комплемента - С4А (acidic, кислый) - характеризуется четырьмя быстро мигрирующими полосами, второй - С4В (basic, щелочной) - четырьмя медленно мигрирующими полосами, третий (С4АВ) имеет обе группы полос. Авторы различали также C4F (fast, быстрый) и C4S (slow, медленный) типы.
О'Neil и соавт. [67] показали, что антигены Ch и Rg связаны с С4-компонентом комплемента. Плазма лиц Ch+Rg+ имела оба изотипа (С4А и С4В) компонента С4, плазма индивидов Ch+Rg- содержала С4В-изотип, а плазма лиц Ch-Rg+ -изотип С4А (см. рис. 19.2). Таким образом, антигены Ch и Rg вели себя как производные локусов С4В и С4А соответственно. Дефицит С4-компонента наблюдали только у лиц Ch-Rg- (Atkinson и соавт. [2], Crookston и соавт. [14], Giles и соавт. [36], O'Neill и соавт. [66, 68]). Эритроциты С4-дефицитных лиц реагировали с некоторыми сыворотками анти-Ch и анти-Rg, однако, как было установлено позднее Giles и соавт. [36], положительные реакции были обусловлены присутствием в этих сыворотках сопутствующих анти-НЬА-антител.
Как отмечалось выше, эритроциты, сенсибилизированные комплементом in vitro, приобретают фенотип донора плазмы, в которой они были инкубированы. Адсорбированный на эритроцитах компонент C4d устойчив к действию трипсина: выраженность эпитопов Ch и Rg на нем сохраняется (ТШеу и соавт. [92]).
Двухлокусная генетическая модель протеина С4, предложенная О'Neil и соавт. [66], в целом подтвердилась, хотя последующие исследования показали, что антигены Ch и Rg более полиморфны, чем это должно быть при наличии только двух локусов.
Антигены Ch и Rg
Структурный полиморфизм
Широкие исследования компонента С4, в том числе субстратов, лишенных сиаловых кислот, показали, что указанный протеин полиморфен (Awdeh и соавт. [3], Bruun-Petersen и соавт. [9], Mauff и соавт. [51], Olaisen и соавт. [69]). К настоящему времени известно более 50 его разновидностей, отличающихся электрофоретической подвижностью: 24 разновидности компонента С4А и 27 разновидностей компонента С4В, включая нулевые фенотипы C4A*Q0 и C4B*Q0 (Mauff и соавт [49, 50, 52]).
Изотипы компонента С4, богатые сиаловыми кислотами и движущиеся к аноду при проведении электрофореза, обозначены С4А, изотипы, движущихся к катоду, - С4В.
Вариантам С4-компонента комплемента и образующим их генам присвоены идентификационные номера [95].
Для европеоидов характерны четыре фенотипа С4А (С4А2, С4АЗ, С4А4 и С4А6) и три фенотипа С4В (С4В1, С4В2 и С4ВЗ). Наиболее частые варианты С4АЗиС4В1.
Установлено, что С4А эффективнее связывается с аминокислотными остатками, в то время как С4В лучше взаимодействует с гидроксильными группами (Dodds и соавт. [16]). С4В более активен по сравнению с С4А в реакции опосредованного антителами гемолиза эритроцитов (Awdeh и соавт. [3]).
Протеин С4А экспрессирует антигены Rg, протеин С4В - антигены Ch. Существуют исключения из этого правила в виде так называемой обратной ан-тигенности. Так, протеин С4А1 реагирует с анти-СЬ-антителами, но не реагирует с антителами анти-Rg, а протеин С4В5 взаимодействует с анти-Rg-антителами и некоторыми образцами анти-Ch (Rittner [75], Roos и соавт.[78]).
Генетический полиморфизм
Гены, кодирующие антигены Chi и Rgl, идентифицированы Barba и соавт. [5], Schneider и соавт. [82] посредством ПЦР.
Локус С4А имеет величину 22 кб и состоит из 41 экзона; С4В имеет протяженность 16 или 22 кб, возникновение укороченного варианта связано с утратой интрона величиной 6,8 кб (Carroll и соавт. [10], Yu [98]).
Гены С4А и С4В весьма консервативны. При секвенировании ДНК и определении аминокислотных последовательностей выявлено сходство обоих протеинов, превышающее 99 % (Belr и соавт. [6]). Восемь аминокислотных различий внутри а-цепи C4d^pameHTa определяют различия аллотипов С4А и С4В (Belr и соавт. [6, 7], Moulds [58]). Четыре аминокислотных остатка, кодируемых экзоном 26, определяют изотип внутри группы. Так, С4А имеет последовательность Pro-Cys-Pro-Val-Leu-Asp в позициях 1101-1106, для С4В характерна последовательность Leu-Ser-Pro-Val-Ile-His в тех же позициях (Yu и соавт. [101]). Аминокислотные замены в положениях 1054,1157,1188 и 1191, кодируемые эк-зонами 25 и 28, определяют специфичность антигенных детерминант Ch и Rg.
Изменения &/-гаплотипов могут быть обусловлены дупликацией генов С4А и С4В. Некоторые из удвоенных генов (С4А*ЗА*2 и С4В*2В*1) встречаются с частотой около 1 % среди европеоидов (Bruun-Petersen и соавт. [9], Carroll и соавт. [11], Giles и соавт. [38], Nordhagen и соавт. [62], Raum и соавт. [73]).
Примерно половина молчащих аллелей обусловлена делецией участка ДНК протяженностью 28 кб (Schneider и соавт. [81].
Carrol и соавт. [12] предположили, что дупликация и делеций приводят к неэквивалентному кроссинговеру. Молчащий аллель С4А *Q0 может возникать в результате встраивания участка ДНК величиной 2 пн в экзоне 29. Это приводит к формированию стоп-кодона в следующем за ним экзоне 30 (Barba и соавт. [4]). Локус С4В может быть полностью заменен копией С4А в случае генной конверсии (Braun и соавт. [8], Palsdottir и соавт. [70]). Неэквивалентный
кроссинговер с образованием гибридных генов С4А/В объясняет возникновение обратной антигенности. При этом возникают протеины С4А и С4В, экспрессирующие необычные антигенные детерминанты Ch и Rg (Giles и соавт. [28], Roos и соавт. [78]).
Молекулярно-генетический анализ 76 гаплотипов показал, что в 58 случаях присутствовало два С4-локуса, в 12 - один, в 6 - сразу четыре (Teisberg и соавт. [90]).
Локус С4В фланкирован геном CYP21B (ген стероидной 21-гидроксилазы), а локус С4А - псевдогеном CYP21A. Указанные генетические структуры тесно связаны между собой на хромосоме 6 в регионе III большого комплекса гистосовместимости. Некоторые гаплотипы С4А и HLA показывают высокую степень неравновесного сцепления. Так, гаплотип С4А *Q0 у европеоидов ассоциирован с фенотипом HLA-A1,B8,DR3, у негроидов - с фенотипом HLA-B44,DR2, гаплотип C4B*Q0 чаще встречается у лиц HLA-B5,B 12.