Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
- Категория: Системы Ok, RAPH, JMH
Антиген Ока
Антиген 0ка (OKI) - пока единственный из образующих эту систему. Он встречается практически у всех людей. Лица Ок(а-) обнаружены только среди японцев. Этот фактор расположен на иммуноглобулине CD 147. Ген BSG, кодирующий вещество Ока, находится на хромосоме 19 (19pter-pl3.2). Редкий фенотип Ок(а-) обусловлен аминокислотной заменой Glu 92 Lys.
Антитела анти-Ока обнаружены Morrel и Hamilton в 1979 г. [11] у жительницы небольшого японского острова. Женщина не имела беременностей, но, по данным авторов, перенесла трансфузию крови. Ее родители, оказавшиеся близкими родственниками, и 2 сибса были также Ок(а-). У ее сестры Ок(а-) было 5 детей, в том числе 2 Ок(а+), однако анти-Ока-антитела у нее не образовались. Других лиц с фенотпом Ок(а-) Morrel и Hamilton не обнаружили, обследовав с использованием указанной анти-Ока-сыворотки 1270 японцев (400 жителей этого острова и 870 доноров других частей Японии), 3976 американцев азиатского происхождения, 1570 американских негров и 1378 мексиканцев.
По данным Spring и соавт. [14], известно 8 лиц с фенотипом Ок(а-) - все японцы.
Антиген Окане разрушается после обработки эритроцитов трипсином, химо-трипсином, папаином, проназой, сиалидазой, редуцентами дисульфидных связей: АЕТ (2-аминоэтилизотиоурониумбромид).
Анти-Ока-антитела
Morrel и Hamilton [11] отметили, что аллоиммунные анти-Ока-антитела существенно укорачивали продолжительность жизни эритроцитов Ok(a+) invivo. Через 3 ч в кровотоке пробанда обнаруживалось лишь 10 % введенных клеток с радиоактивной меткой.
Второй случай обнаружения аллоиммунных анти-Ока-антител описали Yamaguchi и Okubo (цит. по Daniels [4]).
Williams и соавт. [17] нашли, что анти-Ока-специфичностью обладают моно-клональные антитела TRA-1-85, полученные путем культивирования спленоци-тов мышей, иммунизированных клетками тератокарциномы человека. Эти ан-ЗШеда относились к субклассу IgGl и были направлены к CD 147. Они реагировали в непрямой антиглобулиновой пробе со всеми образцами эритроцитов,
за исключением эритроцитов Ок(а-). Антитела TRA-1-85 также реагировали с Лейкоцитами лиц Ок(а+), но не реагировали с лейкоцитами лиц Ок(а-) в радиоиммунном методе.
Mattes и соавт. [9], Kasinrerk и соавт. [7, 8], Stokinger и соавт. [16] описали несколько других моноклональных антител к CD 147, однако ни одно из них не обладало анти-Ока-специфичностью.
Локализация и структура антигена Ока
Иммуноблоттинг субстрата, выделенного из мембран эритроцитов Ок(а+), с моноклональными мышиными анти-Ока- и аллогенными анти-Ока-антителами показал, что антигенные детерминанты Ока расположены на гликопротеине с мол. массой 35-68 кДа (Williams и соавт. [17]).
Spring и соавт. [14] использовали для очистки Ok-гликопротеина монокло-нальные антитела МА103, реагирующие с Ok-гликопротеином эритроцитов как Ок(а+), так и Ок(а-). При изучении выделенного гликопротеина оказалось, что его N-терминальный участок идентичен N-терминальному участку гликопротеина Мб (Kasinrerk и соавт. [7]). Этот гликопротеин известен как EMMPRIN (индуктор матричной металлопротеиназы у человека), базигин (у мышей), ОХ-47 (у крыс), нейротелин (у кур). Общее его обозначение - кластер дифференци-ровки CD147 (Starrier, Stockinger [15]).
Miyauchi и соавт. [10] выделили ген CD147 из клеток костного мозга человека, Kasinrerk и соавт. [7] - из Т- и В-лимфоцитов.
Клетки мышиной клеточной линии NS-0, трансфецированные геном CD147 лиц Ок(а+), экспрессировали антиген Ока. После трансфекции указанных клеток геном CD147 лиц Ок(а-) экспрессию антигена Ок(а+) не наблюдали (Spring и соавт. [14]).
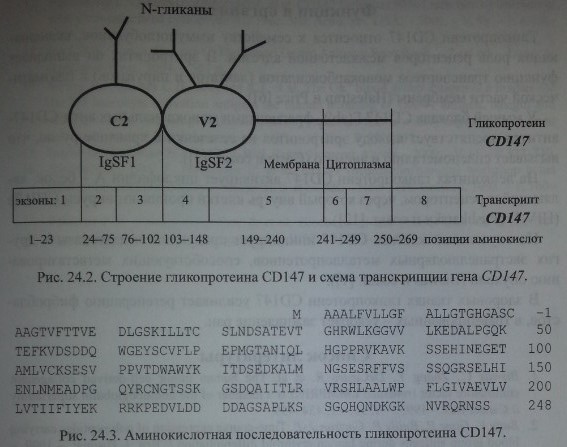
Генный локус CD 147 включает 8 экзонов величиной 10,8 кб
Строение гена OK (EMPRIN) по Reid и Lomas-Francis
Экстрацеллюлярная часть CD 147 организована в виде двух IgSF-доменов. Один из них (С) - константный, другой (V) - вариабельный. С константным доменом связан один N-гликан, с вариабельным - два N-гликана (см. рис. 24.2). На долю указанных гликанов приходится около 50 % мол. массы гликопротеина CD 147 (Biswas и соавт. [1], Kasinrerk и соавт. [7]).
Поскольку лица Ок(а-) являются гомозиготными по мутации G 274 А, вполне возможно существование антитетичного антигена Окь, и, как полагают первооткрыватели, обнаружение анти-Окь-антител в Японии не явится неожиданным.
- Категория: Системы Ok, RAPH, JMH
Онтогенез, распределение в тканях
На ранних гемопоэтических предшественниках антиген Ока выражен сильнее, чем на зрелых эритроцитах. Экспрессия его снижается по мере созревания клеток (Bony и соавт. [2]).
Помимо эритроцитов, гликопротеин CD 147 представлен на лимфоцитах, гра-нудоцитах и других клетках организма, а также лейкемических клеточных ли-Ц$р&.человека (Spring и соавт. [14], Williams и соавт. [17], Mattes и соавт. [9], щсоавт. [7]).
CD 147 присутствует в разных количествах в веществе межклеточного пространства.
Функции в организме
Гликопротеин CD 147 относится к семейству иммуноглобулинов, выполняющих роль рецепторов межклеточной адгезии. В эритроцитах он выполняет функцию транспортера монокарбоксилатов (лактатов и пируватов) к плазматической части мембраны (Halestrap и Price [6]).
У мышей блокада CD147 Р(аЬ')2-фрагментами моноклональных анти-С0147-антител препятствует выходу эритроцитов из селезенки в кровяное русло, что вызывает спленомегалию и анемию (Coste и соавт. [3]).
На лейкоцитах гликопротеин CD 147 активирует циклофилин А - белок, являющийся рецептором, через который внутрь клетки проникают вирусы СПИДа (HIV-1) (Pushkarsky и соавт. [12]).
На опухолевых клетках CD 147 инициирует продукцию коллагеназы и других экстрацеллюлярных металлопротеинов, способствующих метастазирова-нию опухоли (Biswas и соавт. [1]).
В здоровых тканях гликопротеин CD 147 усиливает регенерацию фибробла-стов, в травмированных - ускоряет заживление ран.
- Категория: Системы Ok, RAPH, JMH
Система JMH
Система JMH названа по имени человека, у которого впервые выявлены - John Milton Hagen. До 2006 г. система включала один антиген -JMH1, встречающийся у всех 100 % лиц во всех обследованных популяциях. В 2006 г. система пополнилась сразу 4 часто встречающимися антигенами -JMH2, 3, 4 и 5. Найдены JMH-нулевые фенотипы, являющиеся, как правило, приобретенными.
Антигены JMH связаны с протеином CDwl08, известным как семафорин.
Ген SEMA7A, кодирующий синтез CDwl08, картирован на хромосоме 15 в позиции 15q23-24.
Антигены JMH
Первое сообщение об обнаружении нового часто встречающегося антигена с помощью сыворотки JMH опубликовали в 1978 г. Sabo и соавт. [19]. Авторы выявили несколько образцов антител, причем последние обнаруживались преимущественно у пожилых мужчин и, по-видимому, были аутоиммунного происхождения. Носители антител имели фенотип JMH-, который оказался приобретенным и нередко носил транзиторный характер.
Описаны 2 детей, у которых фенотип JMH- сменился на JMH+.
У некоторых носителей анти-ХМН-антител эритроциты содержали слабовы-раженный антиген JMH, который удавалось выявить с помощью антиглобули-новой пробы (Whitsett и соавт. [24]). В элюатах с сенсибилизированных эритроцитов определялись анти-ЖН-антитела.
Описана семья, в которой в трех поколениях прослежена передача по наследству аутосомного доминантного гена, обусловливающего фенотип JMH-(Kollmar и соавт. [12]). Ни у кого из JMH-отрицательных членов этой семьи не выявлено aHTH-JMH-антител, и их эритроциты давали отрицательные реакции в прямой антиглобулиновой пробе.
Обнаружено несколько образцов aHTH-JMH-антител, полученных от JMH-положительных лиц. Антитела проявляли выраженную гетерогенность и перекрестную реактивность. Так, 4 сыворотки (RM, VG, GP и DW) давали перекрестные реакции с эритроцитами носителей этих антител (Moulds и соавт. [15], Mudad и соавт. [17], Issitt и Anstee [11], Daniels и Knowles [7, 8]). Авторы шлагали, что у обладателей антител RM, VG, GP и DW содержались парциаль-тые антигены JMH и соответственно парциальные антиЛМН-антитела. Однако далее было установлено, что антитела, обозначавшиеся ранее как анти-JMH-подобные, не являются парциальными и имеют разную специфическую направленность. Открываемые ими антигены получили обозначения JMHK, JMHL, JMHG и JMHM (табл. 26.1). Носителями антител к этим антигенам оказались лица, гомозиготные по точковым мутациям в различных участках гена SEMA7A(Daniels и соавт. [6], Seltsam и соавт. [20]).
Таблица 26.1 Антигены JMH
|
Обозначение |
Частота, % |
Замена |
||
|
традиционное |
ISBT |
нуклеотидая |
аминокислотная |
|
|
JMH |
JMH1 |
100 |
|
|
|
JMHK |
JMH2 |
100 |
С619Т |
Arg 207 Тгр |
|
JMHL |
JMH3 |
100 |
G620A |
Arg 207 Gin |
|
JMHG |
JMH4 |
100 |
G1379 А |
Arg 460 His |
|
JMHM |
JMH5 |
100 |
С 1381Т |
Arg 461 Cys |
Антигены JMH разрушаются папаином, трипсином, химотрипсином и дис-ульфидными редуцентами, но устойчивы к действию сиалидазы.
На эритроцитах новорожденных антигены JMH обычно экспрессированы слабо, их полное развитие происходит в первые годы жизни.
- Категория: Системы Ok, RAPH, JMH
Часто встречающийся антиген RAPH, получивший обозначение MER2, впервые описали Daniels и соавт. [3] в 1987 г. Это был первый эритроцитарный антиген, открытый с помощью моноклональных антител. Четыре образца поли-клональных сывороток анти-МЕ112 были найдены позднее (Daniels и соавт. [2]).
Статус системы RAPH получил в 1998 г., когда был картирован контролирующий ее ген, находящийся на коротком плече хромосомы 11 в позиции lip 15.
Антиген MER2 (RAPH1)
Единственным антигеном системы RAPH является фактор MER2 (RAPH1), идентифицируемый антителами анти-МЕИ2. Частота этого антигена у европеоидов составляет 92 %, остальные 8 % людей его не содержат и являются MER2-(Daniels и соавт. [3])
Расчетная частота аллелей MER2+и MER2~0,72 и 0,28 соответственно. Обследование 103 семей показало, что указанные аллели передаются в соответствии с законом наследования.
Титрование антигена MER2 в эритроцитах членов одной большой семьи (жителей о. Сардиния, Италия) анти-МЕ112-антителами показало, что ин-гибиторный ген In(Lu) (см. Lutheran) угнетает экспрессию антигена MER2. Выраженность агглютинации в каждом из разведений тестовых реагентов учитывали по 12-балльной шкале. Титр антигена составил от 0 до 15 (в среднем 6) у членов семьи, имеющих ген In(Lu), и 12-21 (в среднем 16) у членов семьи, лишенных указанного гена.
Антиген MER2 устойчив к действию папаина и сиалидазы, но разрушается трипсином, химотрипсином, проназой и сульфгидрильными реагентами.
Посредством иммунопреципитации специфическими антителами с последующим электрофорезом в геле выделен гликопротеин с мол. массой 40 кДа (Lucien и соавт. [4]).
Предпринимались попытки найти связь между антигеном MER2 и гликопро-теином CD44, который, так же как и MER2, контролируется геном, находящимся на хромосоме 11, и подвержен супрессии со стороны гена In(Lu). Уместно упомянуть, что CD44 несет антигены групповой системы Indian. Однако, как выяснилось, антиген MER2 не связан с гликопротеином CD44. Ahth-CD44-антитела одинаково реагировали с эритроцитами MER2+ и MER2-, а гены, дапролирующие системы Indian и RAPH, располагались в разных участках хромосомы 11. Полагали также, что антиген MER2 идентичен гликопротеину LYVE-1 (или HAR), гомологу CD44, контролируемому локусом 11р15. Однако последующие исследования показали, что MER2 и LYVE-1 отличаются распределением в тканях (Banerji и соавт. [1], Winkleman и соавт. [6]).
Анти-МЕК2-антитела
Daniels и соавт. [3] получили моноклональные анти-МЕ112-антитела серий ID 12 и 2F7 путем слияния спленоцитов мышей, иммунизированных клетками линии мелкоклеточной карциномы человека, с миеломными клетками. Скрининг антител проводили методом комплементзависимой цитотоксичности с использованием гибридных клеток человек - хомяк, содержащих хромосому 11 человека. Эксперименты по блокированию генов этой хромосомы показали, что обе серии антител распознают эпитопы одного и того же антигена (Daniels и соавт. [3]).
В 1988 г. Daniels и соавт. [2] нашли 3 образца аллогенных анти-МЕ112-антител у евреев, выходцев из Южной Индии, проживающих в Израиле, 2 из которых оказались родственниками. У носителей антител была почечная недостаточность, в связи с чем им проводили систематически гемодиализ и ге-мотрансфузии. Антитела во всех 3 образцах сывороток реагировали в непрямой антиглобулиновой пробе. В 2 случаях антитела выявили до проведения гемодиализа и гемотрансфузий. На протяжении многих лет больные получали трансфузии МЕ112-несовместимой крови, однако каких-либо реакций не было. Приживаемость перелитых эритроцитов invivoбыла нормальной.
При параллельном сравнительном исследовании эритроцитов 138 доноров с использованием поли- и моноклональных антител получены одинаковые результаты. Редкие исключения, когда поликлональные антитела давали положительную реакцию, а моноклональные - отрицательную, были обусловлены присутствием примеси анти-В§а-антител (анти-НЬАВ7) во всех трех аллогенных сыворотках. Поликлональные антитела, инкубированные с эритроцитами MER2+, блокировали связывание моноклональных анти-МЕ112-антител. Это подтверждало ранее полученные данные о том, что поли- и моноклональные антитела реагируют с одними и теми же эпитопами.
Четвертый образец анти-МЕЯ2-антител нашли Verhoeven и соавт. [5] у донора, женщины турецкого происхождения. Она имела 2 беременности, гемотрансфузий не было.
Несмотря на относительно высокую вероятность аллоиммунизации лиц MER2- (92 % реципиентов MER2- получают кровь MER2+), известно всего 4 случая обнаружения анти-МЕ112-антител. В 3 из них антитела присутствовали у больных с хронической почечной недостаточностью, происходивших из одной небольшой этнической группы. На этом основании выказано предположение, что у большинства лиц MER2- указанный антиген отсутствует только на эритроцитах, но имеется на других клетках. Это позволяет объяснить чрезвычайную редкость анти-МЕ112-антител. Возможно, у некоторых лиц, входящих в упомянутую этническую группу, имеются гены с делецией аллеля MER2, в связи с чем в организме отсутствует соответствующий антиген. Возникло также суждение о возможной связи ХПН с системой RAPH. Однако какие-либо данные, подтверждающие то или иное предположение, в литературе отсутствуют.
- Категория: Системы Ok, RAPH, JMH
Антитела JMH
Лица JMH- были обнаружены исключительно благодаря присутствию в сыворотках их крови анти-ХМН-антител. В анамнезе этих людей часто отсутствовали указания на беременности и гемотрансфузии (Baldwin и соавт. [1], Moulds и соавт. [15]), что служит основанием относить эти антитела к естественным или аутоиммунным по происхождению.
Антитела JMH чаще представлены субклассом IgG4, описаны также анти- ^ тела субклассов IgGl и IgG2 (Baldwin и соавт. [1], Pope и соавт. [18], Tregellas и соавт. [23]), а также IgG3 (Geisland и соавт. [9]).
Имеются сообщения о переливании реципиентам, содержащим анти-JMH-антитела, несовместимых invitroэритроцитов JMH+. Трансфузии не сопровождались трансфузионными реакциями (Sabo и соавт. [19], Whitsett и соавт. [24], Baldwin и соавт. [1], Tregellas и соавт. [23]). Одному из таких реципиентов в течение 10 мес. лечения перелили 20 доз эритроцитов JMH+ без реакций, при этом у него был достигнуто желаемое увеличение содержания гемоглобина (Tregellas и соавт. [23]).
Срок циркуляции эритроцитов JMH+ в кровяном русле больных, имевших анти-1МН-антитела, не был сокращен по сравнению с нормой (Sabo и соавт. [19], Whitsett и соавт. [24], Tregellas и соавт. [23]). Некоторые анти-JMH-антитела проявляли себя invitroкак клинически значимые (Geisland и соавт. [9], Hadley и соавт. [10]).
Данные, позволяющие сделать заключение о возможном значении анти-JMH-антител в акушерстве, отсутствуют. В большинстве случаев женщины, у которых выявляли эти антитела, были старше детородного возраста. Анамнестические сведения не были убедительными.
В одном случае женщина 26 лет, имевшая анти-ДМН-антитела, родила здоровую двойню, оба ребенка имели фенотип JMH-. Повторное обследование детей через 10 мес. показало, что один из них имел нормально выраженный антиген JMH, у другого он выявлялся слабо.
Моноклональные антитела, реагировавшие с гликопротеином CDwl08, одновременно реагировали с антигеном JMH и квалифицировались как анти-JMH (Mudad и соавт. [16]).
Daniels и Knowles [7, 8] показали, что моноклональные aHra-CDwl08-антитела блокируют реакцию аллогенных анти-ЛУШ-антител, что свидетельствовало если не об идентичности, то об одинаковой специфической направленности aHTH-CDwl08- и анти-ЛУШ-антител.
Локализация и строение антигенов JMH
Методом иммуноблоттинга и иммунопреципитации с аллогенными и моно-клональными антителами показано, что антигены JMH расположены на глико-протеине с мол. массой 76 кДа. Этот белок присутствует на эритроцитах JMH+, на эритроцитах JMH- он не найден (Bobolis и соавт. [3]). Гликопротеины, несущие антигены JMH, относятся к гликозилфосфатидилинозитол (ГФИ) связанным протеинам. Они отделяются от мембраны эритроцитов соответствующим ферментом - ГФИ-фосфолипазой С.
Гликопротеин JMH содержит 19 цистеиновых остатков и как полагают, имеет дисульфидные связи. Доказательством этому может служить тот факт, что антигены JMH разрушаются сульфгидрильными реагентами.
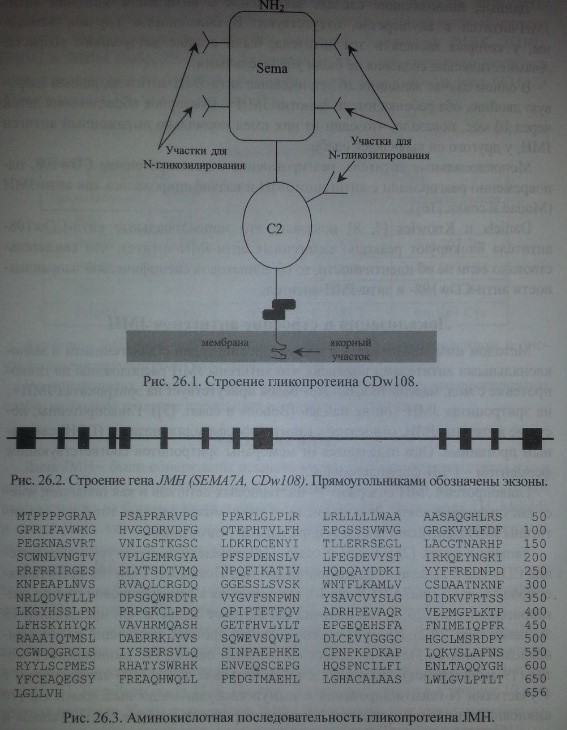
Yamada и соавт. [25], Lange и соавт. [14] определили структуру гликопроте-ина CDwl08 и выделили кодирующий его ген. Поскольку CDwl08 представляет собой белок Sema7A (H-Sema-L), относящийся к семафориновой группе гли-копротеинов (рис. 26.1), ген получил обозначение SEMA7A. Он представлен 13 экзонами (рис. 26.2). Продуктом гена является протеин, состоящий из 656 аминокислот (рис. 26.3). Он включает сигнальный пептид (46 аминокислот), мотив (19 аминокислот), связанный с ГФИ, большой домен (500 аминокислот) с 4 участками N-гликозилирования и иммуноглобулиноподобный домен С2 (70 аминокислот) с одним участком N-гликозилирования (см. рис. 26.1) (Yamada и соавт. [25], Lange и соавт. [14]).
Как показали Mudad и соавт. [16], гликопротеины JMH и CDwl08 являются одним и тем же белком и имеют одинаковою аминокислотную последовательность. Они отсутствуют на эритроцитах JMH-.
Описаны Л больных дизэритропоэтической анемией, эритроциты которых содержали слабый антиген JMH (Bobolis и соавт. [2]).
Секретируемые и мембранные семафорины выполняют функцию сигнальных белков (белков наведения), способствующих росту аксонов нервной клетки в нужном направлении {Вгоп и соавт. [5], Kolodkinи соавт. [13]), участвуют в межклеточных взаимодействиях (Tamagnone, Comoglio [21]).
Плексины - основные рецепторы семафоринов - участвуют в регуляции деятельности эндокринной, иммунной, сердечно-сосудистой, желудочно-кишечной и других важнейших систем организма (Yazdani, Terman [26]).
Гликопротеин CDwl08 экспрессирован преимущественно на активированных лимфоцитах и содержит аминокислотную последовательность Arg-Gly-Asp (267-269), характерную для молекул клеточной адгезии. Большое количество РНК-транскриптов SEMA7Aвыявлено в плаценте, тестикулах, селезенке, низкое - в головном мозге и тимусе (Lange и соавт. [14], Yamada и соавт. [25]).
Утрата антигенов JMH (и обретение фенотипа JMH-) invivoможет быть обусловлена действием внутриклеточных протеаз (Bobolis, Telen [4]). Инкубация эритроцитов при 37 °С в течение 45 мин приводила к появлению в супернатанте серологически активного JMH-протеина с мол. массой 67 кДа. Отделение протеина тормозилось ингибиторами протеаз. Высвобождение протеина JMH из изолированных мембран происходило только при добавлении цитоплазмы или нейтрофилов (Bobolis, Telen [4]).