Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система Colton (Колтон) представлена тремя антигенами. Два из них, Соа (частый) и Соь (редкий), находятся в антитетичных отношениях. Третий антиген, СоЗ, присутствует на всех эритроцитах, за исключением эритроцитов лиц с нулевым фенотипом, Со(а-Ь-) (табл. 17.1). Групповые детерминанты Colton расположены на белке, получившем название аквапорин-1 (AQP-1).
Генный локус СО картирован на коротком плече хромосомы 7. Нулевой фенотип Со(а-Ь-) может быть обусловлен моносомией по хромосоме 7. Антигенные различия Colton обусловлены одиночными мутациями гена СО, приводящими к замене аланина в позиции 45 валином.
Таблица 17.1
Антигены Colton
|
Обозначение |
Частота |
Примечание |
|
|
традиционное |
ISBT |
||
|
Соа |
С01 |
Высокая |
Антитетичен Со\ Ala 45 |
|
Соь |
С02 |
Низкая |
Антитетичен Соа, Val 45 |
|
СоЗ |
СОЗ |
Очень высокая |
Отсутствует у лиц Со(а-Ь-) |
Негликозилированный вариант AQP-1 имеет мол. массу 28 кДа, гликозили-рованный - от 40 до 60 кДа (Denker et al [14]. Количество молекул AQP-1 на одну клетку составляет 120-160 тыс.
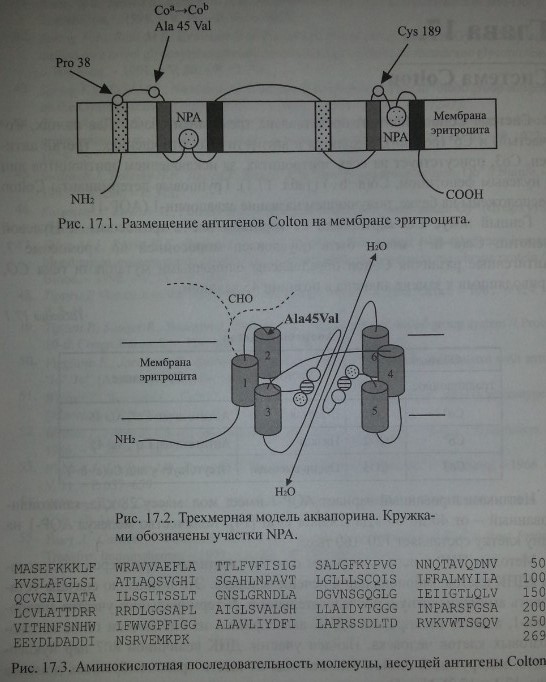
Методом ПЦР с использованием олигонуклеотидных праймеров исследована кДНК клеток эмбриональной печени человека. Это позволило сначала установить аминокислотную последовательность N-терминального участка аквапо-рина-1, а затем изолировать кДНК аквапорина-1 из библиотеки генов костномозговых клеток человека. Найден участок ДНК величиной 807 пар нуклео-тидов, кодирующий синтез полипептида из шести трансмембранных доменов (рис. 17.1 и 17.2). N- и С-терминальные участки полипептида расположены внутри клетки (Preston, Agre [43]). Полипептид, несущий антигены Colton, состоит из 269 аминокислот (рис. 17.3).
Обе половины молекулы аквапорина (по три трансмембранных домена в каждой) имеют участки NPA со сходной последовательностью аминокислот. Согласно предложенной трехмерной модели, участки NPA между трансмембранными доменами образуют канал транспорта воды и функционируют как целое.
Система Colton
Система Colton (Колтон) представлена тремя антигенами. Два из них, Соа (частый) и Соь (редкий), находятся в антитетичных отношениях. Третий антиген, СоЗ, присутствует на всех эритроцитах, за исключением эритроцитов лиц с нулевым фенотипом, Со(а-Ь-) (табл. 17.1). Групповые детерминанты Colton расположены на белке, получившем название аквапорин-1 (AQP-1).
Генный локус СО картирован на коротком плече хромосомы 7. Нулевой фенотип Со(а-Ь-) может быть обусловлен моносомией по хромосоме 7. Антигенные различия Colton обусловлены одиночными мутациями гена СО, приводящими к замене аланина в позиции 45 валином.
Таблица 17.1
Антигены Colton
|
Обозначение |
Частота |
Примечание |
|
|
традиционное |
ISBT |
||
|
Соа |
С01 |
Высокая |
Антитетичен Со\ Ala 45 |
|
Соь |
С02 |
Низкая |
Антитетичен Соа, Val 45 |
|
СоЗ |
СОЗ |
Очень высокая |
Отсутствует у лиц Со(а-Ь-) |
Негликозилированный вариант AQP-1 имеет мол. массу 28 кДа, гликозили-рованный - от 40 до 60 кДа (Denker et al [14]. Количество молекул AQP-1 на одну клетку составляет 120-160 тыс.
Методом ПЦР с использованием олигонуклеотидных праймеров исследована кДНК клеток эмбриональной печени человека. Это позволило сначала установить аминокислотную последовательность N-терминального участка аквапо-рина-1, а затем изолировать кДНК аквапорина-1 из библиотеки генов костномозговых клеток человека. Найден участок ДНК величиной 807 пар нуклео-тидов, кодирующий синтез полипептида из шести трансмембранных доменов (рис. 17.1 и 17.2). N- и С-терминальные участки полипептида расположены внутри клетки (Preston, Agre [43]). Полипептид, несущий антигены Colton, состоит из 269 аминокислот (рис. 17.3).
Обе половины молекулы аквапорина (по три трансмембранных домена в каждой) имеют участки NPA со сходной последовательностью аминокислот. Согласно предложенной трехмерной модели, участки NPA между трансмембранными доменами образуют канал транспорта воды и функционируют как
Сист
Первая экстрацеллюлярная петля молекулы аквапорина может быть N-гликозилирована и, подобно протеину полосы 3, обладать АВН-антигенной активностью (Smith и соавт. [52]).
Ген AQP-1 локализован в позиции 7р14, имеет величину 17 кб и представлен четырьмя экзонами (рис. 17.4), кодирующими аминокислоты в позициях 1-128
Вскоре после обнаружения того факта, что локусы СО и AQP-1 находятся в одном и том же участке хромосомы 7, были получены новые данные. Установлено, что антитела анти-Соа и анти-Соь могут избирательно преципитировать молекулы аквапорина на эритроцитах, содержащих антиген Соа или
Соь соответственно (Smith и соавт. [52]). Анти-СоЗ-антитела позволяли посредством иммунопреципитации выделить аквапорин из эритроцитов Со(а+Ь-) и Co(a-b+).
СоаиСоь
В 1967 г. Heisto и соавт. [19] сообщили о выявлении трех образцов сывороток, открывавших новый антиген с высокой частотой встречаемости. Антиген был обозначен как Соа, или Colton, по имени первого пробанда. Любопытен тот факт, что в действительности его фамилия была Calton, но она, как отметили Reid и Lomas-Francis [46], была неразборчиво написана на пробирке с кровью.
Тремя годами позже Giles и соавт. [18] идентифицировали антитела, открывавшие антиген Соь, антитетичный Соа.
С использованием сыворотки анти-Соа обследованы 1706 американских негров, все оказались Соа+ (Race, Sanger [45]). Среди 13 460 европейцев (жителей стран Северной Европы, США и Канады), обследованных разными авторами, выявлены 27 человек Со(а-) (Heisto и соавт. [19], Lewis и соавт. [30], Race, Sanger [45]), Smith и соавт. [53], (Wray, Simpson [58]). Частота антигена Соа, таким образом, составила 99,8 %.
Сыворотка анти-Соь использована при обследовании 799 испанцев, проживающих в Майами (Issitt и соавт. [23]), 100 канадских индейцев племени кри (Lucciola и соавт. [31]) и 2244 японцев (Nagao и соавт. [38]. Частота выявления антигена Соь в указанных популяциях составила 4,6 %, 2 % и 0,22 % соответственно.
Из 5186 доноров, обследованных Giles и соавт. [18] в Англии, Lewis и соавт. [30] в Канаде, Case [7], Brackenridge и соавт. [5] в Австралии и Новой Зеландии, 443 (8,5 %) имели фенотип Со(Ь+) (табл. 17.2).
Результаты посемейных исследований [19, 30,45] свидетельствуют, что гены Со и Соb наследуются кодоминантно.
Описаны две семьи с необычным характером наследования генов Соа и Cob (Moulds и соавт. [35], Swanson, Eckman [55]). Количественное исследование антигенов эритроцитов членов этих семей путем титрования антител анти-Соа и анти-СоЗ показало, что они несли по одной дозе указанных антигенов, что, по-видимому, было обусловлено передачей от одного из родителей молчащего аллеля Со.Таблица 17.2
Частота признаков Colton у европеоидов
|
Частота, % |
||
|
антигена |
гена |
генотипа |
|
Соа 99,8 |
Соа 95,5 |
CoVCo* 91,2 Coa/Cob 8,6 |
|
Соь 8,5 |
Соь 4,5 |
Cob/Cob 0,2 |
Антигенный полиморфизм Colton связан с заменой нуклеотидов С 134 Т в экзоне 1 гена СО. Аллель Соа кодирует аланин в позиции 45, в то время как при наличии гена Соъ это положение занимает валин. Антигенные эпитопы Colton расположены на экстрацеллюлярной петле второго домена AQP-1 (см. рис. 17.1 и 17.2) вблизи участка N-гликозилирования Asn 42. Нарушение процесса глико-зилирования влияет на экспрессию антигенов Colton (Smith и соавт. [52]).
Антигены Соа и Соь устойчивы к действию протеолитических ферментов: папаша, трипсина, химотрипсина, проназы, сиалидазы и сульфгидрильных реагентов.
Dunstan [15], используя метод проточной цитофлюориметрии, показал, что антиген Соа отсутствует на лимфоцитах, моноцитах и гранулоцитах.
Антиген Соь полностью развит на эритроцитах к моменту рождения (Henke и соавт. [20]).
СоЗ
В 1974 г. Rogers и соавт. [47] идентифицировали фенотип Со(а-Ь-). Его обнаружение было ожидаемым. Указанная редкая группа крови была установлена у жительницы Канады французского происхождения и у 2 из ее 4 сибсов. Родители женщины и 2 других сибса имели фенотип Со(а+Ь-). Сыворотка крови женщины содержала анти-СоЗ-антитела, которые реагировали со всеми образцами эритроцитов, за исключением собственных эритроцитов и 2 ее сибсов. Исследования методом адсорбции - элюции показали, что анти-СоЗ-антитела не являются простой смесью антител анти-Соа и анти-Соь, а представляют собой несепарируемый комплекс анти-СоаЬ. Активность этих антител полностью истощалась посредством адсорбции эритроцитами как Со(а+Ь-), так и Со(а-Ь+). Элюаты с эритроцитов Со(а+Ь-) реагировали перекрестно с эритроцитами Со(а-Ь+) и, наоборот, элюаты с эритроцитов Со(а-Ь+) реагировали с эритроцитами Со(а+Ь-).
Вслед за Rogers и соавт. [47] другие исследрватели описали 5 лиц с нулевым фенотипом Со(а-Ь-), не состоявших в родстве. Все они были европейцами и были выявлены в связи с обнаружением у них анти-СоЗ-антител (Fuhrmann и соавт. [17], Theuriere и соавт. [56], Savona-Ventura и соавт. [49], Lacey и соавт. [27], Chretien и соавт. [9]).
Поиск других лиц с нулевым фенотипом Colton среди 40 тыс. американских, 9 тыс. австралийских и 2 тыс. финских доноров не дал положительного результата (Lacey и соавт. [27]).
Молекулярно-генетическое обследование лиц Со(а-Ь-) показало, что указанный редкий фенотип могут обусловливать четыре фактора:
- Гомозиготность по полной или частичной делеций экзона 1 гена СО (Preston и соавт. [44]).
- Гомозиготность по вставке одной пары нуклеотидов в позиции 307 экзона 1 (Preston и соавт. [44]). Оба фактора блокировали синтез аквапорина. Его не удавалось обнаружить на эритроцитах методом иммуноблоттин-га (Preston и соавт. [44]).
- Гомозиготность по мутации С 614 А в экзоне 3, которая приводит к аминокислотной замене Asn 192 Lys в экстрацеллюлярном участке третьего домена аквапорина с преобразованием аминокислотной последовательности Asn-Pro-Ala в Lys-Pro-Ala (Chretien и соавт. [9]). При таких изменениях протеин утрачивает способность транспортироваться к поверхности мембраны эритроцита. Двое детей пробанда Со(а-Ь-) были гетерозиготны по мутации С 614 А, в результате чего имели фенотип Со(а+Ь~).
- Гомозиготность по мутации С 113 Т в экзоне 1 с аминокислотной заменой Pro 38 Leu (Preston и соавт. [44]). В этом случае на эритроцитах выявлялись следовые количества аквапорина. Эритроциты давали слабоположительные реакции с мощными (титр 1 :32 ООО) анти-СоЗ-антителами (Lacey и соавт. [27]).
У лиц Со(а-Ь-) эритроциты были нормальными по физиологическим показателям, содержание гемоглобина и гематокрит были в пределах нормы, отмечено уменьшение продолжительности жизни эритроцитов in vivo (Mathaj и соавт. [33]).
Эритроциты одного ребенка с редкой формой конгенитальной дизэритропоэ-тической анемии без мутаций гена AQP-1 содержали аквапорин-1 в количестве менее 10 % от нормы, были Со(а-Ь-), однако при этом реагировали с анти-СоЗ-антителами (Parsons и соавт. [41], Agre и соавт. [2]). Эритроциты ребенка, так же как и его родителей, были дефицитны по содержанию CD44, имели группу In(a-b-) AnWj - по системе Indian, слабый антиген LWab системы LW, обладали очень низкой проницаемостью для воды. Эритроциты больных с другими формами конгенитальной дизэритропоэтической анемии содержали нормально выраженные антигены Colton.
Антиген СоЗ, как и факторы Соа и Соь, устойчив к действию протеолитиче-ских ферментов и сульфгидрильных реагентов.
Большинство выявленных анти-Соа-антител относилось к классу IgG. Реакции антител усиливались после энзимирования эритроцитов. Описаны также агглютинины анти-Соа класса IgM (Kurtz и соавт. [26]).
Анти-Соа-антитела вызывали тяжелые формы ГБН (Simpson [50]), острые посттрансфузионные осложнения (Covin и соавт. [10]) и замедленные гемолитические реакции (Kitzke и соавт. [25]).
Изучение приживаемости радиоактивно меченных эритроцитов Со(а+Ь-) в кровяном русле реципиентов, имевших анти-Соа-антитела, показало выраженное деструктивное действие этих антител на иногруппные эритроциты. Реципиентам с анти-Соа-антителами при необходимости трансфузии эритроцитов в обязательном порядке следует подбирать донора редкой группы Со(а-Ь+) (Kurtz и соавт. [26]).
Leo и соавт. [29] описали больного, имевшего генотип Соа/Соь по результатам ПЦР. В сыворотке крови больного присутствовали анти-Соа-антитела. Высказано предположение, что столь необычный случай мог быть обусловлен двумя причинами: во-первых, больной мог обладать парциальным антигеном Соа; во-вторых, анти-Соа-антитела могли иметь аутоиммунное происхождение.
Анти-Соь-антитела встречаются редко. Они не были обнаружены среди 1430 больных, имевших гемотрансфузии. Семерым реципиентам была перелита кровь Co(a-b+) (Heisto и соавт. [19]).
Анти-Соь-антитела выявляли в полиспецифических сыворотках, анти-Соа-антитела чаще встречались как моноспецифические (Daniels [11], Issitt, Anstee [22]).
В одном случае анти-Соь-антитела вызвали острое гемолитическое пост-трансфузионное осложнение (Lee, Bennett [28]). Описана также замедленная посттрансфузионная реакция, обусловленная этими антителами (Squires и соавт. [54]). Тесты на приживаемость меченых эритроцитов в кровотоке сенсибилизированных реципиентов показали ускоренную элиминацию клеток, обусловленную антителами анти-Соь (Dzik, Blank [16], Hoffmann, Overbeeke [21]).
Случаи развития тяжелых форм ГБН, обусловленной анти-Соь-антителами, не описаны, хотя, по мнению Issitt и Anstee [22], они не исключены.
Анти-СоЗ-антитела вызывали тяжелые формы ГБН, в связи с чем потребовалось проведение обменных переливаний эритроцитов (Savona-Ventura и соавт. [49], Lacey и соавт. [27]).
Трансфузия крови Со(а+Ь-) реципиенту с антителами анти-СоЗ сопровождалась умеренно выраженной гемолитической реакцией. Функция почек при этом не нарушалась (Chretien и соавт. [9]), хотя антитела имели высокий титр, были представлены IgGl, IgG2 и IgG3, связывали комплемент и вызывали гемолиз эритроцитов in vitro (Lacey и соавт. [27]).
Moulds и соавт. [36]) обнаружили у больного Со(а-Ь-)СоЗ+, страдавшего неходжкинской лимфомой, аутоантитела со специфичностью анти-СоЗ. Антитела можно было выявить только в непрямой антиглобулиновой пробе с папаинизированными эритроцитами.
Campbell и соавт. [6] нашли необычные антитела к Со-ассоциированному антигену, которые реагировали со всеми образцами эритроцитов Со(а+Ь+), большинством образцов Co(a+b-), но давали отрицательные реакции с эритроцитами Со(а-Ь+). Антитела присутствовали у больного, имевшего фенотип Со(а+Ь-). Полагают, что антиген, с которым реагируют указанные антитела, образован валином и аланином в одном и том же положении 45, но на различных молекулах тетрамеров аквапорина-1.
Система LW (Landsteiner - Wiener) получила статус самостоятельной групповой системы лишь в 1982 г., хотя фактически она была открыта в начале 40-х годов.
Первый образец aHTH-LW-антител получили Landsteiner и Wiener [28] путем иммунизации кроликов и морских свинок эритроцитами обезьян Macacus rhesus. По характеру реагирования (~ 85 % положительных результатов, 15 % отрицательных) эти ксеногенные антитела были близки аллогенным, которые годом раньше, в 1939 г., описали Levine и Stetson [36] (см. Система RH). Оба вида антител были обозначены как анти-Rh.
Однако уже в 1942 г. Fisk и Foord [16] показали, что антитела, вырабатываемые морскими свинками, отличаются от анти-Ю1-антител человека. Сыворотки морских свинок агглютинировали эритроциты практически всех новорожденных, в то время как с помощью анти-Шьантител аллогенного происхождения эритроциты новорожденных, так же как и взрослых, можно было разделить на Rh+ и Rh-. В 1952 г. Murray и Clark [40], иммунизируя морских свинок эритроцитами человека Rh+ и Rh-, получили антитела одинаковой специфичности. Аналогичные антитела были получены путем иммунизации животных экстрактами из эритроцитов Rh+ и Rh-.
Далее Levine и соавт. [30, 31] установили, что агглютинация эритроцитов ал-логенными сыворотками не блокировалась, если эритроциты были предварительно нагружены антителами, полученными от животных. Путем адсорбции - элюции антител было показано, что анти-Ш>подобные антитела, полученные от животных, связывались с Rh-отрицательными эритроцитами, хотя в прямых агглю-тинационных тестах они реагировали только с Rh-положительными клетками.
Race и Sanger [48] нашли у 2 Rh-отрицательных женщин антитела, похожие по специфичности на анти-Rh, однако последние легко адсорбировались Rh-отрицательными эритроцитами и тем самым демонстрировали aHTH-Rh-подобную специфичность, аналогичную специфичности антител, полученных от животных.
Поскольку обозначение Rh было дано резус-антигену, Levine и соавт. [35] предложили обозначить антиген, открываемый ксеногенными анти-Rh-подобными антителами, буквами LW в честь Landstainer и Wiener.
Антигены D и LW фенотипически очень близки, хотя и представляют собой разные системы. Некоторые образцы aHTH-LW-антител ошибочно идентифицировались как анти-D, и их можно было отличить только при использовании эритроцитов D+LW-, с которыми они не реагировали.
На эритроцитах D+ антиген LW выражен сильнее, чем на эритроцитах D-, у лиц Rh антигены LW отсутствуют (Levine и соавт. [35]).
Фенотипы LW+D+ и LW+D- Levine и Celano [32] обозначили как LWj и LW2.
Swanson и соавт. [60, 63] и DeVeber [14) показали, что aHTH-LW-антитела ге-терогенны, в связи с чем Beck [3] подразделил LW-отрицательные эритроциты на LW3 и LW4. Эритроциты LW3 не реагировали с aHTH-LW3-aHTm^aMH, но агглютинировались антителами, образовавшимися у лиц LW.. Эритроциты LW4 никакими сыворотками анти-LW не агглютинировались. и
Giles и соавт. [18, 19] нашли лиц с транзиторным фенотипом LW-, который трудно было отличить от LW3 и LW. jr
После обнаружения Sistonen и соавт. [51, 53] редко встречающегося антигена Nea система LW усложнилась.
Sistonen и Tippett [54] нашли, что антитела анти-Кеа и анти-LW, образовавшиеся у лиц LW3, выявляют антитетичные антигены. Это привело к изменению номенклатуры в системе LW: антиген, идентифицируемый сыворотками анти-LW от лиц LW3, получил обозначение LWa, антиген Nea - LWb, фенотип LW4 был переименован в LW(a-b-), антитела, продуцируемые индивидами LW4, названы aHra-LWab (табл. 18.1).
Таблица 18.1
Фенотипы и генотипы LW
|
Обозначение фенотипа |
Генотип |
Реакции с антителами |
||||
|
старое |
новое |
LWa |
LWb |
LWab |
||
|
LW+ |
LWj, LW2 |
LW(a+b-) LW(a+b+) |
LWa/LWa или LWVLW LWa/LWb |
+ + |
— |
+ + |
|
LW- |
LW3 |
LW(a-b+) |
LWb/LWb или LWb/LW |
— |
+ |
+ |
|
LW- |
4 |
LW(a-b-) |
LW/LW |
— |
— |
— |
|
LW О |
Rh .. null |
LW(a-b-) |
|
— |
— |
— |
При включении системы LW в номенклатуру ISBT принято решение отказаться от старых обозначений: LW1, LW2, LW3 и LW4, чтобы избежать путаницы, и заменить их новыми
Аквапорин участвует в регуляции осмотического давления внутри клетки. Согласно модели, предложенной Murata и соавт. [37], две трансмембранные петли аквапорина-1 образуют в мембране клетки канал с просветом около 3 ангстрем, чуть больше размера молекулы воды. Взаимодействия в участках NPA (см. рис. 17.2) усиливают перемещение молекул воды и в то же время препятствуют транспорту ионов водорода. Аквапорин-1 может, подобно аквапорину-3, участвовать в формировании каналов транспорта глицерина (Roudier и соавт. [48])
Помимо эритроцитов, аквапорин-1 присутствует в клетках почечного эндотелия и некоторых других эпителиальных и эндотелиальных клетках. Он участвует в реабсорбции воды в почечных клубочках и нисходящих участках петель Генле (Agre и соавт. [1], Borginia и соавт. [4]), способствует быстрой реги-дратации эритроцитов после их пребывания в высокоосмолярной среде, уменьшает сморщивание эритроцитов в мозговом слое почек, увеличивая проницаемость мембраны эритроцитов для мочевины (Smith и соавт. [51]).
Полагают, что аквапорин эритроцитов участвует в транспорте С2 (Nakhoul и соавт. [39], Yang и соавт. [59]). В легких он, возможно, поддерживает водный баланс, в мозговой ткани влияет на образование спинномозговой жидкости, в слизистых оболочках глаза регулирует влажность (Agre и соавт. [1], Borginia и соавт. [4]).
У 3 соматически здоровых индивидов Со(а-Ь-) проницаемость эритроцитов для воды была снижена на 80 %, аквапорин отсутствовал в почечных канальцах (Preston и соавт. [44]).
Мыши с неактивными генами аквапорина после лишения их воды на 36 ч были сильно обезвожены по сравнению с особями контрольной группы (Ма и соавт. [32]). В связи с этим представляется вполне обоснованным предположение, что аквапорин-1, имеющийся в клетках нисходящей петли Генле, участвует в процессе концентрирования мочи в условиях дефицита воды (Chou и соавт. [8]).
Поскольку аквапорин-1 участвует в выделительной функции почек, можно полагать, что аутоантитела Colton могут играть определенную роль в патогенезе хронической почечной недостаточности.
Моносомия по хромосоме 7
Утрата хромосомы 7 стволовыми гемопоэтическими клетками или моносомия клеток костного мозга по хромосоме 7 - редкая генетическая аномалия, наблюдаемая при миелолейкозе и предлейкемическом дизэритропоэтическом синдроме.
Моносомия по хромосоме 7 нередко сочетается с фенотипом Со(а-Ь-) СоЗ-или сниженной экспрессией антигенов Соа и СоЗ (De la Chapelle и соавт. [13], Boetius и соавт. [3]).
По наблюдениям Pasquali и соавт. [42], 8 из 35 пациентов с моносомией по хромосоме 7 имели фенотип Со(а-Ь-)СоЗ- и Co(a+wb-)Co3+w. До исследования им не производили гемотрансфузии, в то время как другие больные (21 из 27), которым выполняли переливания крови, имели фенотип Со(а+Ь-). Возможно, гемотрансфузии усиливали экспрессию антигенов Colton.
Zelinski и соавт. [60] высказали предположение, что отсутствие антигенов Colton при моносомии по хромосоме 7 является результатом утраты одного из аллелей Со в сочетании с подавлением функции другого вследствие нарушений гемопоэза.
Антигены LW представляют собой гликопротеины с мол. массой около 40 кДа. Разрушение дисульфидных связей инактивирует вещество LW (Konigshaus, Holland [27]).
Ген LW картирован на коротком плече хромосомы 19 в позиции 19р13.3. Антигенный полиморфизм (LWa/LWb) обусловлен перемещением А 308 G в экзоне 1, что приводит к аминокислотной замене: глицин на аргинин в позиции 70 в первом IgSF-домене гликопротеина LW (Hermand и соавт. [21]).
Мол. масса гликопротеина, полученного посредством иммунопреципитации с использованием аллогенных анти-1ЖаЬ-антител (от миссис Big.), соответствовала 37-47 кДа (Mallinson и соавт. [38], Bloy и соавт. [5, 6], Moore [39]). Субстрат, полученный при использовании моноклональных анти-Ь\\^аЬ-антител, имел меньшую мол. массу - от 36 до 43 кДа.
Мол. масса гликопротеина снижалась до 2 и 17 кДа после обработки N- и О-гликаназами соответственно (Bloy и соавт. [5]). Добавление Ка2-ЭДТА.(три-лон Б) к эритроцитам ингибировало антигены LW (Bloy и соавт. [6]). Ионы Mg2+ восстанавливали активность антигенов LW, ионы Мп2+ и Са2+ были инертны.
Основываясь на результатах сравнительного исследования гликопротеина LW и протеина Rh с помощью химотриптического йодпептидного картирования, Bloy и соавт. [5, 7] высказали предположение, что гликопротеин LW может являться гликозилированной формой Rh-протеина или, иными словами, Rh-полипептид является субстанцией-предшественником гликопротеина LW. Протеин Rh с мол. массой 31 кДа преципитировался одновременно с гликопротеином LW, и это свидетельствовало, что указанные структуры эритроцитарной мембраны тесно связаны.
Bailly и соавт. [1] частично воспроизвели аминокислотную последовательность гликопротеина LW, что позволило создать олигонуклеотидные прайме-ры, исследовать к ДНК и установить, что кодируемый пептид имеет мол. массу 26,5 кДа. Кроличьи антитела к синтетическому пептиду, состоящему из 15 аминокислот, реагировали в непрямой антиглобулиновой пробе со всеми образцами эритроцитов за исключением LW(a-b-). Эритроциты D+ реагировали интенсивнее, чем эритроциты D-. Эритроциты D+LW(a-b+) давали слабовыраженные реакции.
Аминокислотная последовательность протеина LW
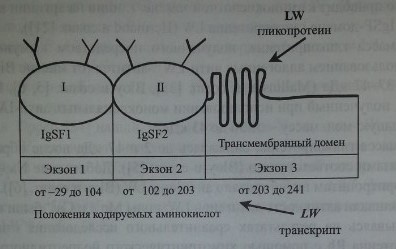
Как показали Bailly и соавт. [1], Hermand и соавт. [21], ген LW кодирует протеин, включающий 271 аминокислоту (рис. 18.1), в том числе сигнальный пептид аминокислот, экстрацеллюлярный N-терминальный домен (208 аминокислот), трансмембранный гидрофобный домен (21 аминокислота) и С-терминальный цитоплазматический домен (12 аминокислот). Имеется четыре потенциальных участка N-гликозилирования: 38, 48, 160 и 191, которые занимает аспарагин. N-гликозилирование этих участков приводит к формированию.
Гликопротеин LW включает два IgSF-домена (рис. 18.2) и структурно связан с молекулами межклеточной адгезии ICAM-1, ICAM-2 и ICAM-3. Предложена трехмерная модель гликопротеина LW (Hermand и соавт. [22], Spring и соавт. [59]).
Ген LW имеет величину 2,65 кб, организован в виде трех экзонов (см. рис. 18.2) Экзон 1 кодирует нетранслируемую последовательность из 96 ко-донов, сигнальный пептид и первый IgSF-домен. Экзоны 1 и 2 отделены друг от друга интроном из 129 пар оснований. Еще один интрон (147 пар оснований) разделяет экзоны 2 и 3. Экзон 2 кодирует второй IgSF-домен. Экзон 3 кодирует трансмембранный и интрацеллюлярный домены и содержит в области У нетранслируемую последовательность. Промоторная область гена содержит участки, влияющие на экспрессию антигенов LW на других клетках
Строение гликопротеина LW и транскрипта гена LW