Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система MNS (до 1982 г. MN, или MNSs) была открыта второй по счету, в 1927 г., почти 3 десятилетия спустя после открытия системы АВО. Примечательно, что в открытии этой системы участвовал первооткрыватель групп крови человека Карл Ландштейнер. Он и его ученик Филипп Левин, иммунизируя кроликов, впервые получили гемагглютинирующие сыворотки, открывавшие 2 новых, ранее неизвестных антигена эритроцитов крови человека. Вновь открытые факторы авторы обозначили буквами М и N. Закономерность реагирования сывороток анти-М и анти-N указывала на антитетичную связь выявляемых с их помощью антигенов. Когда отрицательно реагировала одна сыворотка, обязательно давала положительные реакции другая (реципрокные отношения). В некоторых образцах эритроцитов были оба фактора - М и N. Клетки, не содержавшие антигена М, неизменно оказывались N-положительными и, наоборот, практически все N-отрицательные эритроциты агглютинировались сыворотками анти-М. Исследования семей подтвердили первоначальное предположение о том, что антигены М и N ведут себя как серологически определяемые продукты аллельных генов Ми N (Chown и соавт. [43], Cleghorn [45], Wiener и соавт. [263]). Так была открыта групповая система MN, которая на протяжении последующих 20 лет считалась диаллельной системой, представленной только двумя антигенами.
Получение специфических антисьшорЮток иммунизацией кроликов не требовало больших затрат, и в последующие десятилетия тестирование эритроцитов крови людей по факторам М и N было широко внедрено в различных областях. Антропологи подробно изучили распределение антигенов М и N среди представителей различных рас и этнических групп (Ж. Доссе [2], Т.А. Ичаловская и T.M. Пискунова [3], П.Н. Косяков [4], А.К. Туманов, В.В. Томилин [9], Mourant и соавт. [173], Race, Sanger [191]). Судебные медики вплоть до настоящего времени применяют кроличьи сыворотки анти-М и анти-N для экспертизы вещественных доказательств, исключения отцовства или материнства и подмены детей (П.Н. Косяков [4], Прокоп, Геллер [7], А.К. Туманов, В.В. Томилин [9]). Помимо ксеногенных (полученных от животных) анти-М- и aimi-N-антител используют сыворотки аллогенного происхождения.
В клинической трансфузиологии антигены М и N не имеют столь большого значения, как АВО (М.А. Умнова [1], Mollison и соавт. [166]). Анти-М- и aHTH-N-антитела, как правило, не вызывают серьезных посттрансфузионных осложнений. При разногруппной по системе MN беременности аллоиммуниза-ция происходит редко, ГБН протекает в легкой форме или совсем не развивается.
Последующие открытия в системе MN произошли лишь спустя 2 десятилетия, когда были обнаружены антигены S и s, которые оказались антитетичными по отношению друг к другу точно так же, как факторы М и N. Установлено также, что обе пары антигенов (MN и Ss) взаимосвязаны (Chown и соавт. [43], Heiken [91], Sanger и соавт. [219, 220, 222]). Далее был открыт антиген U, который, за редким исключением, содержится практически у всех людей (Allen и соавт. [12], Wiener и соавт. [261,262]). Таким образом система MN усложнилась. Разные группы исследователей обозначали ее как MNS, MNSs или MNSsU. Официальное, утвержденное ISBT, обозначение этой системы -MNS.
До 1990 г. открыто много других ассоциированных с MN антигенов, редко встречающихся у европейцев (табл. 6.1). Их находили, главным образом, у представителей негроидной и монголоидной рас. Посемейные исследования подтвердили ассоциативную связь редких факторов с антигенами М, N, S и s. Позднее было установлено, что некоторые из редких антигенов также взаимосвязаны. Попытки систематизировать данные серологических, в том числе посемейных, исследований позволили выделить в системе MN подсистему Мильтенбергер -коллекцию редко встречающихся связанных между собой антигенов (Gleghorn [44, 46]). Первые 4 класса антигенов, выделенные Cleghorn в 1966 г., пополнились 7 новыми антигенами, отличающимися друг от друга серологически (Daniels [56], Issitt, Anstee [ИЗ], Reid, Lomas-Francis [202]). Антигены, причисленные к подсистеме, обнаруживали преимущественно у монголоидов (Metaxas-Buehler и соавт. [163], Nguen ТЫ Huingh и соавт. [174]). Выделение подсистемы Мильтенбергер не вызвало возражений у иммуносерологов. Однако в последнее десятилетие в связи с использованием молекулярно-генетических методов исследования стало очевидно, что подразделение антигенов системы MNS на классы и подсистемы неточно, и дальнейшая детализация подсистем нецелесообразна (Dahr [53], Reid, Tippett [209], Tippett и соавт. [247]). Обозначения гибридных гликофоринов, обусловливающих антигенные различия, по-видимому, в скором будущем претерпят изменения.
С 1970-х годов антигены системы MNS изучали биохимическими (Dahr [52, 54, 55]), а затем молекулярно-генетическими методами, с помощью которых установлено, что система MNS полиморфна и сопоставима по своей сложности только с системой Rh (Akane и соавт. [10], Issitt, Anstee [113], Fukuda [72], Huang и соавт. [97,99,101-107]).
В настоящее время система MNS представлена 46 антигенами (см. табл. 6.1). Некоторые антигены, ассоциированные с системой MN, являются продуктом гликозилирования гликофоринов под действием генов, не зависимых от локуса MN. Установлены количественные варианты некоторых факторов. В связи с этим такие антигены, как Ни, Mv Tm и Sj, не получили статуса антигенов системы MNS с присвоением соответствующего обозначения в номенклатуре ISBT;количественные варианты (М2, N2, S2, Su SB, Uz) в систему MNS также не включены.
|
Обозначение |
Год открытия |
Частота, % |
|||
|
авторское |
традиционное |
ISBT |
европеоиды |
негроиды |
|
|
М |
M |
MNS1 |
1927 |
78 |
74 |
|
N |
N |
MNS2 |
1927 |
72 |
75 |
|
S |
S |
MNS3 |
1947 |
57 |
30 |
|
s |
s |
MNS4 |
1951 |
88 |
93 |
|
Henshaw |
He |
MNS6 |
1951 |
< 1 |
3 |
|
Miltenberger |
Mia |
MNS7 |
1951 |
<1 |
<1 |
|
и |
U |
MNS5 |
1953 |
>99,9 |
99,7 |
|
Мс |
Mc |
MNS 8 |
1953 |
<0,1 |
<0,1 |
|
Gr, Verweyst |
Vw |
MNS9 |
1954 |
<0,1 |
<0,1 |
|
Gilfeather |
Mg |
MNS 11 |
1958 |
<0,01 |
< 0,01 |
|
Verdergaal |
Vr |
MNS12 |
1958 |
<0,1 |
<0,1 |
|
Murrel |
Mur |
MNS 10 |
1961 |
<0,1 |
<од |
|
Me |
Me |
MNS13 |
1961 |
0,5 |
1 |
|
Martin |
Mta |
MNS14 |
1962 |
0,25 |
<од |
|
Stones |
Sta |
MNS15 |
1962 |
0,1 |
<0,1 |
|
Ridley |
Ria |
MNS16 |
1962 |
<0,1 |
<0,1 |
|
Caldwell |
Cla |
MNS 17 |
1963 |
<0,1 |
<0,1 |
|
Nyberg |
Nya |
MNS18 |
1964 |
<0,1 |
<0,1 |
|
Orris |
Or |
MNS31 |
1964 |
<0,1 |
<0,1 |
|
Hutchinson |
Hut |
MNS19 |
1966 |
<0,1 |
<0,1 |
|
Hill |
Hil |
MNS20 |
1966 |
<0,1 |
<0,1 |
|
Armstrong |
Mv |
MNS21 |
1966 |
0,6 |
|
|
Kamhuber |
Far |
MNS22 |
1968 |
<0,1 |
<0,1 |
|
Ena |
EnaTS |
MNS28 |
1969 |
>99,9 |
>99,9 |
|
EnaTS |
EnaFS |
|
1969 |
>99,9 |
>99,9 |
|
EnaFS |
EnaFR |
|
1969 |
>99,9 |
>99,9 |
|
EnaFR |
N' |
MNS30 |
1977 |
>99,9 |
99,9 |
|
Anek |
Hop |
MNS26 |
1977 |
<0,1 |
<0,1 |
|
Raddon/Lane |
Nob |
MNS27 |
1977 |
<0,1 |
<0,1 |
|
Dryer |
sD |
MNS23 |
1978 |
<0,1 |
<0,1 |
|
Mitchel |
Mit |
MNS24 |
1980 |
0,12 |
<0,1 I |
|
Dantu |
Dantu |
MNS25 |
1982 |
<0,1 |
0,5 |
|
Osa |
Osa |
MNS38 |
1983 |
|
|
|
EnaKT |
EnaKT |
MNS29 |
1986 |
>99,9 |
> 99,9 ] |
|
DANE |
DANE |
MNS32 |
1991 |
0,4 |
|
|
SAT |
SAT |
MNS36 |
1991 |
0,01 |
|
|
TSEN |
TSEN |
MNS33 |
1992 |
|
|
|
MINT |
MINY |
MNS34 |
1992 |
|
|
|
MUT |
MUT |
MNS35 |
1992 |
<0,1 |
<0,1 |
|
MARS (Marsden) |
MARS |
MNS43 |
1992 |
<0,1 |
<0,1 |
|
ERIK |
ERIK |
MNS37 |
1993 |
|
|
|
ENEH |
ENEH |
MNS40 |
1993 |
>99,9 |
> 99,9 |
|
ENEP |
ENEP |
MNS39 |
1995 |
>99,9 |
> 99,9 |
|
HAG |
HAG |
MNS41 |
1995 |
|
|
|
ENAV(AVIS) |
ENAV |
MNS42 |
1996 |
>99,9 |
|
|
ENDA |
ENDA |
MNS44 |
2005 |
>99,9 |
>99,9 |
|
ENEV |
ENEV |
MNS45 |
2006 |
>99,9 |
>99,9 |
|
MNTD |
MNTD |
MNS46 |
2006 |
<0,1 |
|
Как указывалось выше, антитела против антигенов М и N впервые были получены иммунизацией кроликов эритроцитами людей. Позднее были найдены антитела анти-М и анти-N аллогенного происхождения (А. Майский, Л. Кучера [5], А.А. Михайлова, Т.А. Ичаловская [6], А.Е. Скудицкий [8], Alperin и соавт. [13], Ballas и соавт. [20], Beattie и соавт. [22], Chapman и соавт. [39], Duguid и соавт. [65], Furlong и соавт. [73], Immel и соавт. [ПО], Као и соавт. [128]).
В 1947 г. Walsh и соавт. [257] описали антитела к антигену, связанному как с фактором М, так и N. Антитела получили обозначение анти-S от названия города, где были обнаружены - Сидней, Австралия. Четыре года спустя, в 1951 г., Levine и соавт. [145] нашли сыворотку с антителами к антигену, антитетичному антигену S. Она реагировала положительно со многими образцами эритроцитов, но S-отрицательные клетки неизменно давали положительную реакцию. Так был открыт фактор s, обозначенный строчной буквой из-за его антитетичной связи с антигеном S.
|
Фенотип |
Частота (в %) среди |
|
|
европеоидов |
негроидов |
|
|
M+N-S+s- |
6 |
2,1 |
|
M+N-S+S+ |
14 |
7 |
|
M+N-S-S+ |
8 |
15,5 |
|
M+N-S-s- |
< 0,01 |
0,4 |
|
M+N+S+s- |
4 |
2,2 |
|
M+N+S+S+ Щ |
24 |
13 |
|
M+N+S-S+ |
22 |
33,4 |
|
M+N+S-s- |
< 0,01 |
0,4 |
|
M-N+S+s- |
1 |
1,6 |
|
M-N+S+S+ |
6 |
4,5 |
|
M-N+S-S+ |
15 |
19,2 |
|
M-N+S-s- |
< 0,01 |
0,7 |
При обследовании представителей различных рас и этнических групп выявлены особенности в распределении антигенов М, N, S и s (табл. 6.2). В большинстве изученных популяций частота гена Мсоставила 50-60 %, N- 40-50 %. Частота гена М оказалась выше среди жителей стран Балтии и европейской части России [2-4, 7, 9, 43, 45, 173, 191, 219-222]. Этот ген реже выявляли (около 2 %) среди островитян Тихого океана и австралийских аборигенов. Частота гена S оказалась низкой среди жителей Дальнего Востока и у австралийских аборигенов (Mourant и соавт. [173]).
Посемейные исследования показали, что антигены MN и Ss фенотипически и генетически связаны между собой и являются продуктами двух частично сцепленных генных локусов - MN и Ss (Cleghorn [43, 45], Mourant и соавт. [173], Race, Sanger [191], Sanger и соавт. [220]).
В рандомизированных выборках чаще встречается генный комплекс Ns, несколько реже - Ads, а комплекс MS - еще реже. Наиболее редким был гаплотип NS. Эти 4 генных комплекса найдены у представителей практически всех изучавшихся популяций (Mourant и соавт. [173]).
Распределение фенотипов MNS
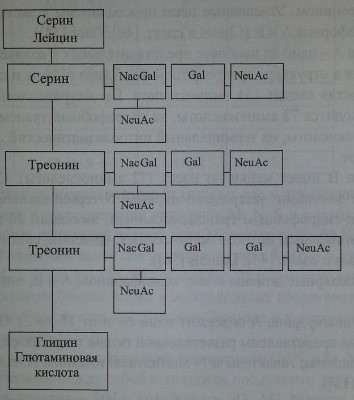
Серологически выявляемая М-антигенная активность обусловлена присутствием серина в позиции 1 и глицина в позиции 5 на экстрацеллюлярном домене гликофорина A (Dahr и соавт. [55]). На N-положительных клетках в этих позициях находятся лейцин и глютаминовая кислота соответственно (рис. 6.1). В экспрессии антигенов важную роль играют О-гликаны и сиаловые кислоты. Позиции 2-4 пептидной цепи гликофорина А гликозилированы (Dahr и соавт. [55], Issitt, Anstee [113], Schenkel-Brunner [223]).
Строение терминальных участков гликофорина А.
Нередко антитела анти-М и анти-N обнаруживают у лиц, не имевших беременностей и гемотрансфузии (Garratty [78], Као и соавт. [128]). Такие антитела естественные, часто представляют собой IgM и реагируют при комнатной температуре как агглютинины. Описаны IgG-антитела той же специфичности (Garratty [78], Issitt, Anstee [113]). Многим антителам, особенно анти-М, свойствен эффект дозы. Эритроциты гомозигот М/М и N/N реагируют с антителами анти-М и анти-N сильнее, чем эритроциты гетерозигот. Большинство образцов указанных антител не обладает способностью активировать комплемент. Считается, что антитела анти-М и анти-N, относящиеся к Холодовым, не имеют клинического значения, поскольку не способны вызвать гемолиз эритроцитов in vivo (Garratty [78], Issitt, Anstee [113]). Дщучаи ||БН (Duguid и соавт. [65], Stone и соавт. [234], Teleschi и соавт 46]) й трансфузионные реакции (Alperin и соавт. [13], Ballas и соавт. 20], Furlong и соавт. [73], Sancho и соавт. [217]), обусловленные указанными антителами, редки.
В отечественной литературе имеется 2 сообщения об аллоиммунизации антигеном М в результате беременности. Выраженных клинических проявлений ГБН при этом не наблюдали (А.А. Михайлова, ТА. Ичаловская [6], А.Е. Скудицкий [8]).
Антитела анти-М обнаруживали у детей и взрослых, перенесших бактериальные инфекции (Као и соавт. [128]). Антитела выявляли у беременных, дети которых, как позже выяснилось, не имели антигена М. Анти-М-антитела иногда сопутствовали другим антителам (Rh, Kell, Kidd, Duffy) у гематологических больных, получивших многочисленные переливания компонентов крови (А. Майский, Л. Кучера [5], Gales и соавт. [77]).
Помимо естественных и аллоиммунных антител описаны аутоантитела анти-М и анти-N (Chapman и соавт. [39], Garratty и соавт. [79], Immel и соавт. [ПО], Sacher и соавт. [215]). В некоторых случаях течение аутоиммунной гемолитической анемии, обусловленной этими антителами, было тяжелым (Garratty и соавт. [79], Immel и соавт. [ПО]).
Различают рН-зависимые и глюкозозависимые антитела анти-М и анти-N (Beattie и соавт. [22], Reid и соавт. [200]). В отличие от обычных антител, для которых кислотность среды не столь существенна, рН-зависимые анти-М и анти-К-антитела наиболее активно реагируют с эритроцитами, несущими соответствующий антиген, при значении рН 6,5. Глюкозозависимые антитела проявляют свое действие лишь с эритроцитами, инкубированными в растворе глюкозы. Установлено, что активность некоторых образцов антител анти-М и анти-N ингибируется растворами мальтозы и маннита, но остается неизмененной в присутствии фруктозы, рибозы, галактозы, лактозы и сахарозы. Такие антитела выявляли главным образом у больных сахарным диабетом.
У больных почечной недостаточностью, находившихся на гемодиализе, обнаруживали особые антитела анти-N, реагирующие с эритроцитами, обработанными формальдегидом (Dzik и соавт. [66], Howell и соавт. [96], McLeish и соавт. [157], Sandler и соавт. [218], White и соавт. [259]). Такие антитела были обозначены как aHra-Nform. Дальнейшие исследования показали, что anra-Nf -антитела образовались в результате модификации мембраны эритроцитов больных следами формальдегида в гемодиализной системе (стерилизацию систем для гемодиализа проводили с использованием формальдегида).
AHTH-N-подобную специфичность имеют лектины растительного происхождения - Vicia graminea (А.К. Туманов, В.В. Томилин [9], Prigent [190]).
К настоящему времени получено большое количество образцов моноклональных антител анти-М и анти-N (Lisowska [149], Reid и соавт. [201]). Последние с успехом используют для фенотипирования эритроцитов, однако некоторые из них, в частности анти-М, не строго специфичны и в высоких концентрациях реагируют с эритроцитами M-N+, т. е. диспецифичны. Для придания им анти-М-специфичности прибегают к их разведению, что вполне приемлемо для рутинного анализа, но не для метода адсорбции - элюции. На активность моноклональных анти-М- и анти-К-антител влияют рН среды и температурные условия постановки реакции. Поликлональные антитела анти-М и анти-N алло- и ксеногенного происхождения менее зависимы от этих условий.
Протеолитические ферменты, применяемые в практике иммуносерологи-ческих лабораторий (папаин, фицин, бромелин, протеаза), разрушают антигены М и N, в связи с чем энзимные пробы при работе с антителами анти-М и анти-N не используют (Hirsch и соавт. [93], Issitt, Anstee [113], Race, Sanger [191], Reid и соавт. [201]).
Антигены MNS располагаются в структурах, известных как гликофорины А (GPA, MN-сиалогликопротеины, CD235A) и В (GPB, Ss-сиалогликопротеины, CD235B) (Dahr и соавт. [52, 54, 55]). Гликофорины представляют собой трансмембранные пептиды, терминальная карбоксильная группа которых обращена внутрь клетки (С-участок), а аминная группа (N-участок) выступает над эритроцитарной мембраной (Chasis и соавт. [40]). Существует 2 типа присоединения полисахаридных группировок к полипептиднои части: посредством О- и N-связи. Эти участки обозначают как О- и N-гликаны (Chasis и соавт. [40], Daniels [56]). Последние представлены сложными полисахаридными цепями, связанными с пептидной цепью через аминогруппы аспарагина, чаще с N-ацетилгалактозамином (Chasis и соавт. [40], Dahr [54]). Последовательность Asn/...n-Thr/Ser, где позицию ...п может занимать любая аминокислота, кроме пролина, является участком N-гликозилирования. Гликофорин А имеет один N-гликан, гликофорины В и Е не содержат N-гликаны. О-гликаны меньше по размеру и гликозилированы через гидроксильные группы, образованные се-рином или треонином. Углеводные цепи присоединены к экстрацеллюлярным участкам гликофорина А и В (Chasis и соавт. [40], Dahr [54]).
Гликофорин А - одно из наиболее представительных в количественном отношении веществ в структуре эритроцитной мембраны (Chasis и соавт. [40], Dahr [54]). В его состав входит 131 аминокислота. На экстрацеллюлярный участок, N-домен, приходится 72 аминокислоты, на гидрофобный трансмембранный домен - 23 аминокислоты, на терминальный цитоплазматический, или С-домен, -36 аминокислот.
Гликофорин В имеет меньшую массу (72 аминокислоты). Он также представлен тремя доменами: экстрацеллюлярным, N-терминальным, имеющим 44 аминокислоты; гидрофобным трансмембранным, имеющим 20 аминокислот, и коротким терминальным цитоплазматическим С-доменом, состоящим из 8 аминокислот (Chasis и соавт. [40], Daniels [56]).
Экстрацеллюлярные домены обоих гликофоринов, А и В, интенсивно гликозилированы.
Молекула гликофорина А содержит один N- и от 15 до 21 О-гликанов, при этом О-гликаны представлены разветвленной цепью тетрасахаридов, состоящей из сиаловой кислоты, галактозы и N-ацетилгалактозамина (Chasis и соавт. [40], Issitt, Anstee [113]).
Степень гликозилирования гликофоринов у разных лиц неодинакова. Строение О-гликанов гликофорина А во многом сходно с таковым гликофорина В. Так, первые 26 аминокислотных остатков в экстрацеллюлярном домене гликофорина А с N-серологической активностью такие же, как и на гликофо-рине В (Blumenfeld и соавт. [29], Booth [31], Chasis и соавт. [40], Dahr [54], Schenkel-Brunner [223]). Этим объясняется N-антигенная активность гликофорина В, которую обозначают как fNf для ее дифференциации от антигена N, находящегося на молекуле гликофорина A (Issitt, Anstee [113], Judd и соавт. [127]). Трансмембранные домены гликофоринов А и В также практически идентичны между собой (Chasis и соавт. [40], Daniels [56], Schenkel-Brunner [223]).
Антигены М и N несет гликофорин А, антигены S и s расположены на гли-кофорине В (Schenkel-Brunner [223]). Количество молекул гликофорина А на 1 эритроцит составляет 800 тыс.-1 млн, гликофорида В 1170-250 тыс. (Schenkel-Brunner [223]).
Специфичность антигенов S и s обусловлена заменой одной амин&кислоты в экстрацеллюлярной части гликофорина В, в позиции 29 (Chasis и соавт. [40], Dahr [54]). На цепях, несущих S-антигенную активность, эту позицию занимает метионин, на цепях, несущих s-антигенную активность, - треонин. Полагают, что важную роль в экспрессии указанных антигенов играет гликозилирование цепей гликофорина В в позициях 25, 34 и 35. Вместе с тем S- и s-антигенную активность связывают с терминальными пентапептидными участками гликофоринов А и В (Daniels [56], Issitt, Anstee [113], Reid, Lomas-Francis [202]).
Антитела анти-S и анти-s встречаются реже по сравнению с анти-М- и анти-N-антителами. Они имеют, как правило, аллогенное происхождение (Sanger [191]). Их обнаруживают у лиц, подвергавшихся гемотрансфузиям, и у женщин, имевших беременности. Описан также случай естественных анти-8-антител (Constantoulis и соавт. [47]).
Большинство образцов антител к антигенам S и s относится к классу IgG, некоторые содержат фракцию IgM (Garratty [78]). Антитела непосредственно вызывают агглютинацию эритроцитов S+ нередко при температуре ниже 37 °С. В отличие от антител к антигенам М и N агглютинины анти-S эффектом дозы не обладают. Отдельные образцы анти-8-антител рН-зависимы и реагируют наиболее интенсивно при рН 6,0. Многие образцы анти-S содержали также специфические антитела к редким антигенам эритроцитов других групповых систем: анти-Wr*, анти-Swa и др., отнесенных в настоящее время к системе Diego. Большинство из описанных в литературе образцов антител анти-s были IgG, они проявляли активность при 37 °С и лучше всего выявлялись непрямой антиглобулиновой пробой (Beck и соавт. [23]). Естественные aHra-s-антитела крайне редки (Lalezari и соавт. [135]).
Протеолитические ферменты, обычно применяемые в иммуносерологии, разрушают антигены S и s.
Антиген S разрушается следовым количеством хлора (Long и соавт. [151]). Известен способ обработки эритроцитов гипохлоритом натрия с целью ингиб-и S-антигенной активности. Его используют для дифференциации антител aHT№-S с антителами другой специфичности (Judd [124]).
Антитела анти-S и анти-s часто выявляют как сопутствующие одновременно с антителами другие групповых систем: анти-D, анти-Е, анти-с, анти-С™, анти-К, анти-Руа и анти-Jk3 (Gales и соавт. [77]). Описаны аутоантитела анти-S (Fabijanska-Mitek и соавт. [68], Johnson и соавт. [122]).
Антитела к антигенам S и s относят к клинически значимыми (Drachmann и соавт. [64], Giblett и соавт. [81], Levine и соавт. [144]). Описаны случаи тяжелой ГБН, обусловленной антителами анти-S и анти-s, с летальным исходом (Giblett и соавт. [81]). Поиск совместимых доноров затруднен из-за высокой частоты антигенов S и s. Одновременное присутствие у реципиента других антител еще более осложняет подбор.