Слабая выраженность антигенов Lewis обусловлена аминокислотными заменами в генах, контролирующих продукцию фукозилтрансфераз [71,134,172,180].
Koda и соавт. [134] нашли у японцев Le(a-b-) 2 мутации в гене FUT3 (Leu 20 —> Arg, Gly 170 —> Ser). Опыты с клонированием гена Le в COS-клетках показали, что замена Gly 170 —> Ser приводит к продукции неактивного фермента, тогда как при замене Leu 20 щ Arg вырабатывалась активная фукозилтрансфераза, о чем свидетельствовало появление антигена Leb на поверхности COS-клеток.
Mollicone и соавт. [172] также выявили мутацию Leu 20 щ Arg у индонезийцев Le(a-b-), которые содержали антигены Lewis в слюне. Такие же замены описаны у японцев [180] и шведов [71]. Замена аргинина на лицин приводила к экспрессии слабовыраженного антигена Lewis.
Nishihara и соавт. [179] и Mollicone и соавт. [172] описали мутацию Не 356 —» Lys. Гетерозигота по этой мутации, 18 из 19 индонезийцев Le(a-b-), не содержали антигенов Lewis ни на эритроцитах, ни в слюне.
Cooling и Gu [59] исследовали с помощью ПЦР 15 афроамериканцев, имевших фенотип Lenull, Отмечены варианты мутаций в FUT3, которые приводили к продукции неактивного фермента и в результате формировали нулевой фенотип. Одну из мутаций (G —> А) в нуклеотиде 13 обнаружили у 50 % обследованных (рис. 9.3), она приводила к замене Gly 5 —£ Ser. У других обследованных обнаружили мутации G —► Т в нуклеотиде 1022, G Щ А в нуклеотиде 484, G ->
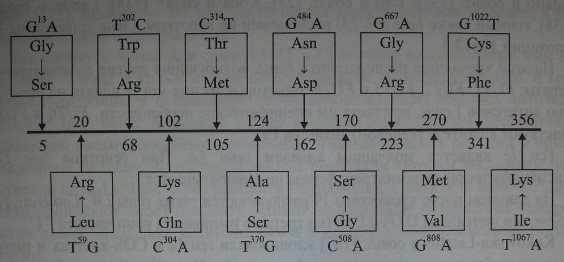
Мутации в гене FUT3 у лиц с фенотипом Lewisnuir Двенадцать нуклеотидных замен, приводящих к продукции неактивной фукозилтрансферазы, по Cooling, Gu [59].
А в нуклеотиде 667. Они приводили к замене Cys 341 Щ Phe, Не 356 Ш Lys, которые также сочетались с низкой активностью фукозилтрансферазы.
Две мутации, Trp 68 —► Arg и Thr 105 —> Met, найдены Elmgren и соавт. [71]. Для того чтобы определить их влияние на активность фукозилтрансферазы, Elmgren и соавт. [70] сконструировали 2 химеричных протеина: FUT3 с Trp 68 —> Arg и FUT3 с Thr 105 —> Met. При первой замене продуцировался фермент с низкой активностью, тогда как при второй замене активность фермента соответствовала норме. Авторы пришли к выводу, что гомозиготность по Trp 68 —* Arg дает фенотип Le(a-b-).
Orntoft и соавт. [187] описали мутацию (С 445 А) у человека Le(a-b-), больного раком. Эта мутация приводила к продукции метионина в позиции 146, однако такая же мутация обнаруживалась и у здоровых лиц.
Mollicone и соавт. [171] установили, что примерно 9 % жителей острова Ява не имеют <х(1,3)-фукозилтрансферазы (FUT6), обычно присутствующей в плазме человека, однако содержат антигены Lewis.
При клонировании гена FUT5 от лиц с дефицитом а(1,3)-фукозилтрансферазы найдены 3 точки мутаций: Arg 173 Щ Cys, Pro 187 Ш Leu, Thr 388 —► Met, которые, однако, не сказывались на активности фермента.
При клонировании гена FUT6 выявлены замены Pro 124 —► Ser, Glu 247 —> Lys, Туг 315 —► стоп-кодон. Две последние замены приводили к продукции неактивного фермента. Замены Glu 247 т Lys и Tur 315—» стоп-кодон в FUT6, которые сочетались с дефицитом а(1,3)-фукозилтрансферазы, обнаружены среди полинезийцев и шведов (Larson и соавт. цит. по [115]). Таким образом, ген FUT6 отвечает за активность <х(1,3)-фукозилтрансферазы в плазме у людей и как другие гены FUT полиморфен.







