Антигены LW представляют собой гликопротеины с мол. массой около 40 кДа. Разрушение дисульфидных связей инактивирует вещество LW (Konigshaus, Holland [27]).
Ген LW картирован на коротком плече хромосомы 19 в позиции 19р13.3. Антигенный полиморфизм (LWa/LWb) обусловлен перемещением А 308 G в экзоне 1, что приводит к аминокислотной замене: глицин на аргинин в позиции 70 в первом IgSF-домене гликопротеина LW (Hermand и соавт. [21]).
Мол. масса гликопротеина, полученного посредством иммунопреципитации с использованием аллогенных анти-1ЖаЬ-антител (от миссис Big.), соответствовала 37-47 кДа (Mallinson и соавт. [38], Bloy и соавт. [5, 6], Moore [39]). Субстрат, полученный при использовании моноклональных анти-Ь\\^аЬ-антител, имел меньшую мол. массу - от 36 до 43 кДа.
Мол. масса гликопротеина снижалась до 2 и 17 кДа после обработки N- и О-гликаназами соответственно (Bloy и соавт. [5]). Добавление Ка2-ЭДТА.(три-лон Б) к эритроцитам ингибировало антигены LW (Bloy и соавт. [6]). Ионы Mg2+ восстанавливали активность антигенов LW, ионы Мп2+ и Са2+ были инертны.
Основываясь на результатах сравнительного исследования гликопротеина LW и протеина Rh с помощью химотриптического йодпептидного картирования, Bloy и соавт. [5, 7] высказали предположение, что гликопротеин LW может являться гликозилированной формой Rh-протеина или, иными словами, Rh-полипептид является субстанцией-предшественником гликопротеина LW. Протеин Rh с мол. массой 31 кДа преципитировался одновременно с гликопротеином LW, и это свидетельствовало, что указанные структуры эритроцитарной мембраны тесно связаны.
Bailly и соавт. [1] частично воспроизвели аминокислотную последовательность гликопротеина LW, что позволило создать олигонуклеотидные прайме-ры, исследовать к ДНК и установить, что кодируемый пептид имеет мол. массу 26,5 кДа. Кроличьи антитела к синтетическому пептиду, состоящему из 15 аминокислот, реагировали в непрямой антиглобулиновой пробе со всеми образцами эритроцитов за исключением LW(a-b-). Эритроциты D+ реагировали интенсивнее, чем эритроциты D-. Эритроциты D+LW(a-b+) давали слабовыраженные реакции.

Аминокислотная последовательность протеина LW
Как показали Bailly и соавт. [1], Hermand и соавт. [21], ген LW кодирует протеин, включающий 271 аминокислоту (рис. 18.1), в том числе сигнальный пептид аминокислот, экстрацеллюлярный N-терминальный домен (208 аминокислот), трансмембранный гидрофобный домен (21 аминокислота) и С-терминальный цитоплазматический домен (12 аминокислот). Имеется четыре потенциальных участка N-гликозилирования: 38, 48, 160 и 191, которые занимает аспарагин. N-гликозилирование этих участков приводит к формированию.
Гликопротеин LW включает два IgSF-домена (рис. 18.2) и структурно связан с молекулами межклеточной адгезии ICAM-1, ICAM-2 и ICAM-3. Предложена трехмерная модель гликопротеина LW (Hermand и соавт. [22], Spring и соавт. [59]).
Ген LW имеет величину 2,65 кб, организован в виде трех экзонов (см. рис. 18.2) Экзон 1 кодирует нетранслируемую последовательность из 96 ко-донов, сигнальный пептид и первый IgSF-домен. Экзоны 1 и 2 отделены друг от друга интроном из 129 пар оснований. Еще один интрон (147 пар оснований) разделяет экзоны 2 и 3. Экзон 2 кодирует второй IgSF-домен. Экзон 3 кодирует трансмембранный и интрацеллюлярный домены и содержит в области У нетранслируемую последовательность. Промоторная область гена содержит участки, влияющие на экспрессию антигенов LW на других клетках
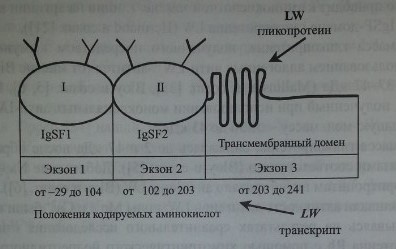
Строение гликопротеина LW и транскрипта гена LW







