Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
После открытия антигенов Doa и Dob [23, 45] последовала серия сообщений о выявлении новых образцов антител aHTH-Doa (Webb и соавт. [53], Williams, Crawford [54], Polesky и соавт. [31], Moulds и соавт. [25], Kruskall и соавт. [17], Judd, Steiner [15], Roxby и соавт. [39], Strupp и соавт. [44]) и анти-Боь (Strupp и соавт. [44], Yvart и соавт. [55], Moheng и соавт. [22], Halverson и соавт. [11], Shirey и соавт. [41]).
Частота анти-Боа-антител в исследованных выборках практически не отличалась от частоты антител aHTH-Dob и соответствовала ожидаемой, рассчитанной по частоте генов. На основании этого исследователи пришли к выводу, что антигены Doa и Dob одинаковы по своей способности вызывать аллоиммуни-зацию (Issitt, Anstee [13]). Антитела Dombrock чаще сопутствовали антителам другой специфичности, однако известны также сыворотки, содержащие моноспецифические анти-Боа-антитела (Moulds и соавт. [25], Roxby и соавт. [39]) и моноспецифические анти-Ооь-антитела (Shirey и соавт. [41]). О выявлении естественных антител Dombrock не сообщалось.
Polesky и соавт. [31] наблюдали женщину, у которой анти-Ооа-антитела образовались во время первой беременности. Ребенок имел фенотип Do(a+).
Антитела анти-Do3 и анти-Эоь относятся к классу IgG, не обладают способностью связывать комплемент (Polesky, Swanson [30], Moulds и соавт. [25], Yvart и соавт. [55]). Их ни разу не описывали как причину ГБН. В отдельных случаях эти антитела обусловливали положительную прямую антиглобулиновую пробу с эритроцитами новорожденных без гемолитической реакции (Polesky и соавт. [31], Moulds и соавт. [25], Yvart и соавт. [55]).
Вместе с тем анти-Эоа-антитела вызывали как острые, так и замедленные посттрансфузионные реакции, особенно у больных с серповидно-клеточной анемией (Kruskall и соавт. [17], Judd, Steiner [15], Strupp и соавт. [44]). Такие же реакции вызывали и анти-Ооь-антитела (Strupp и соавт. [44], Moheng и соавт. [22], Halverson и соавт. [11], Shirey и соавт. [41]).
Тесты на приживление эритроцитов in vivo, а также эксперименты с монослоем моноцитов in vitro, показали, что антитела Dombrock ускоряют разрушение эритроцитов, несущих антигены Dombrock (Polesky, Swanson [30], Shirey и соавт. [41]).
В одном случае, описанном Gudino и соавт, [10], у пациента, имевшего анти-Ооа-антитела, приживаемость эритроцитов Do(a+) была нормальной. Переливание ему Ооа-положительных эритроцитов не вызвало реакции.
В некоторых случаях антитела анти-Ооа и анти-Ооь выявляли post factum, когда трансфузии уже были выполнены. В отдельных случаях эти антитела трактовали как слабые аллогенные, не имеющие клинического значения, аутоиммунные или HLA-антитела (Kruskall и соавт. [17], Judd, Steiner [15], Strupp и соавт. [44], Halverson и соавт. [11]).
В противоположность антигенам Doa и Dob антиген Gya более иммуногенен и выраженно проявляет себя при разногруппной беременности женщин Gy(a-) (Swanson и соавт. [46], Race, Sanger [32], Clark и соавт. [6], Okubo и соавт. [29]).
Антитела anra-Gya, анти-Ну и анти-Jo3 естественного происхождения не описаны (Daniels [7]). Однако могут быть исключения. Ellisor и соавт. [8] выявили анти-Оуа-антитела у пожилого мужчины, которому не проводили гемотрансфузии. Через 3 мес. антитела исчезли. Эритроциты этого человека, фенотип которого был определен как Gy(a-), адсорбировали анти-Ну-антитела, которые можно было затем элюировать. Стандартные эритроциты Gy(a-) такой способностью не обладали. Это дает основания полагать, что фенотип Gy(a-) может быть приобретенным (Reid и соавт. [34]). Процесс подобной трансформации, по-видимому, может сопровождаться появлением соответствующих транзиторных антител.
Антитела aHTH-Gya, анти-Ну и анти-Joа, как правило, относятся к классу IgG (Swanson и соавт. [46], Clark и соавт. [6], Moulds и соавт. [26], Beattie, Castillo [3], Hsu и соавт. [12], Jensen и соавт. [14], Morel и соавт. [24], Brown и соавт. [4], Ellisor и соавт. [8], Barrett и соавт. [2]). Один образец анти-Оуа-антител содержал фракцию IgA и, как удалось установить с помощью антиглобулиновой пробы, связывал комплемент (Clark и соавт. [6]). Один образец анти-Ну-антител, вызывавший прямую агглютинацию эритроцитов, помимо IgG, содержал фракцию IgM (Barrett и соавт. [2]).
Beattie и Castillo [3] описали случай гемолитической посттрансфузионной реакции у мужчины, имевшего анти-Ну-антитела, которому были перелиты две дозы эритроцитов Ну+.
Описан также реципиент с наличием анти-Оуа-антител, которому были произведены трансфузии 10 доз эритроцитов Gy(a+) (Мак и соавт. [20]). Каких-либо проявлений несовместимости при этом авторы не наблюдали.
У больного с транзиторными анти-Суа-антителами приживаемость эритроцитов Gy(a+) in vivo была нормальной (Hsu и соавт. [12]). В аналогичных исследованиях ускоренную элиминацию эритроцитов in vivo вызывали антитела анти-Ну (Hsu и соавт. [12]) и анти-Jo3 (Viggiano и соавт. [50]).
В последние годы Rao и соавт. [33] получили мышиные МКА, реагирующие со всеми антигенами Dombrock, но дающие слабые реакции с эритроцитами Gy(a-).
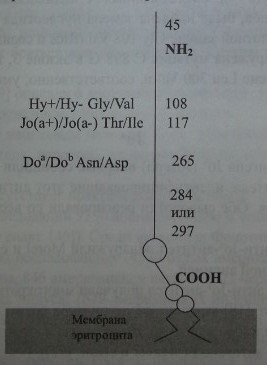
Banks и соавт. [1], Spring и соавт. [42, 43] посредством перекрестной иммунопреципитации показали, что антигенные детерминанты Doa, Gya, Ну и Joaрасположены на одном и том же экстрацеллюлярном гликопротеине (рис. 16.1), имеющем мол. массу 46,75-57,5 кДа. Обработка эритроцитов эндогликозила-зой F приводила к уменьшению мол массы гликопротеина до 11 кДа, что свидетельствовало о N-гликозилировании изучаемого субстрата. Вместе с тем протеин Dombrock не подвергался О-гликозилированию.
Строение гликопротеина Dombrock.
В процессе иммунопреципитации предположительно выделялись также ди-меры указанных соединений.
В экспрессии антигенов Gya и Ну участвуют дисульфидные связи. При обработке сульфгидрильными реагентами мол. масса гликопротеина уменьшалась до 40-50 кДа и он быстрее мигрировал в полиакриламидном геле в присутствии додецил-сульфата.
Gubin и соавт. [9] провели скрининг базы данных, включающих около 5000 нуклеотидных последовательностей хромосом, полученных из дифференцирующихся эритроидных клеточных линий. Оказалось, что синтез ГФИ-ассоциированных протеинов кодируют гены, расположенные на хромосоме 12.
Идентифицирован фрагмент ДНК, который, по-видимому, и является геном Dombrock. Трансфекция этого фрагмента в эритролейкемические клетки К562 приводила к экспрессии на их поверхности антигенов Doa, Gya, Ну и Joa (Gubin и соавт. [9]).
Локус DO имеет величину 14 кб, состоит из трех экзонов (рис. 16.2) и кодирует синтез протеина, состоящего из 314 аминокислот (рис. 16.3). Экзон 1 кодирует аминокислоты в позиции 1-45, экзон 2 - в позиции 49-285, экзон 3 - в позиции 286-314, включая ГФИ-ассоциированный фрагмент из 17 аминокислот (Reid, Lomas-Francis [35]).
Аминокислотная последовательность гликопротеина Dombrock.
Обследование индивидов Do(a+) и Do(a-) с использованием молекулярно-генетических методов показало, что антигенные различия Doa/Dob обусловлены нуклеотидной заменой А 793 G в экзоне 2 гена DO (Gubin и соавт. [9], Rios и соавт. [36]). Последняя приводит к аминокислотной замене Asn 265 Asp (табл. 16.4). Два других замещения нуклеотидов, приводящие к появлению аминокислотных остатков Туг 126 и Leu 208, также связаны с различиями Doa/Dob. Антигенные различия Ну+/Ну- и Jo(a+)/Jo(a-) обусловлены заменами Gly 108 Val и Thr 117 Не.
РНК-транскрипты гена DO обнаруживали в селезенке, лимфатических узлах, костном мозге и эмбриональной печени; в тимусе и лейкоцитах периферической крови они отсутствовали (Gubin и соавт. [9]). Они не выявлялись в течение первых 4 дней культивирования клеток периферической крови человека в присутствии эритропоэтина
Молекулярная основа антигенов Dombrock
|
Фенотип'' |
Замена нуклеотидов |
Экзон |
Замена аминокислот |
|
Doa/Dob |
A793G |
2 |
Asn 265 Asp |
|
Ну+/Ну- |
G323T |
2 |
Gly 108 Val |
|
Jo(a+)/Jo(a-) |
С350Т |
2 |
Thr117 He |
Биологическая функция
Продукт аллеля Dob содержит аминокислотную последовательность Arg -Gly - Asp, характерную для молекул клеточной адгезии. Аллель Do" кодирует в том же участке фрагмент с другой последовательностью аминокислот, Arg -Gly - Asn, что может повлиять на адгезивную способность субстрата.
Экзон 2 локуса DO содержит участок, характерный для генов, контролирующих синтез аденозиндифосфатрибозилтрансферазы (АДФ-трансферазы) (Koch-Nolte, Haag [16]). Возможно, гены Dombrock способны модифицировать этот фермент и таким образом влиять на его функциональную активность (Gubin и соавт. [9]).
Spring и соавт. [42, 43], Telen и соавт. [47] наблюдали у больных пароксиз-мальной холодовой гемоглобинурией две популяции эритроцитов, одна из которых была лишена ГФИ-ассоциированных протеинов и не содержала антигенов Dombrock. Эти эритроциты были более чувствительны к комплементу.
Антигены Scianna расположены на гликопротеине, известном как HERMAP (human erythroid membarne associated protein - протеин, ассоциированный с мембраной эритроидных клеток человека). Синтез этого гликопротеина контролирует ген ERMAP, картированным на коротком плече хромосомы 1 в позиции 1р34.1. Ген ERMAP включает 11 экзонов протяженностью 19 пн.
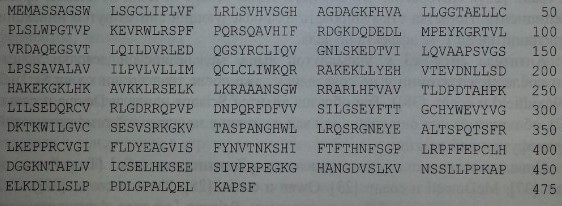
Протеин HERMAP состоит из 475 аминокислот (рис. 15.2) и представлен экстрацеллюлярным, трансмембранным и интрацеллюлярным доменами, включающими соответственно 157, 20 и 198 аминокислот
Последовательность протеина HERMAP
Молекулярная основа нулевого фенотипа Scianna разнородна (см. табл. 15.4). В результате мутаций или делеций генетического материала у лиц с нулевым фенотипом (Sc:-1,-2,-3) синтезируемый протеин HERMAP утрачивает антигенные эпитопы, распознаваемые антителами Scianna. Фенотипически это проявляется в отсутствии всех без исключения антигенов указанной системы. Как уже отмечено выше, лица с фенотипом Sc „ могут быть аллоиммунизированы часто встречающимся антигеном Sc3.
До 1995 г. к системе Dombrock (Домброк) относили два антитетичных антигена - DoaH Dob. В 1995 г. Banks и соавт. [1] установили, что у лиц, лишенных антигенов Do8 и Dob, отсутствуют также еще три антигена - Gya, Ну и Joa - и они имеют фенотип Do(a-b-)Gy(a-)Hy-Jo(a-). Столь очевидная фенотипи-ческая связь позволила расширить систему Dombrock до пяти единиц. В нее были включены часто встречающиеся антигены Gya (Gregory), Ну (Holley) и Joa(Joseph), получившие обозначения D03, D04 и D05 в номенклатуре ISBT. Антигены DoaH Dob получили обозначения D01 и D02 (табл. 16.1).
Таблица 16.1
Антигены Dombrock
|
Обозначение |
Частота среди европеоидов, % |
Примечание |
|
|
традиционное |
ISBT |
||
|
Doa (Dombrock) |
DOl |
66 |
Антитетичен антигену Do , замена Asn 265 |
|
Dob |
D02 |
82 |
Антитетичен антигену Doa, замена Asp 265 |
|
Gya (Gregory) |
D03 |
>99 |
Отсутствует на эритроцитах лиц Do(a-b-) |
|
Ну (Holley) |
D04 |
>99 |
Отсутствие антигена Ну обусловлено заменами Gly 108 Val и Leu 300 Val, при этом антигены Dob и Gya слабо выражены |
|
Joa (Joseph) |
D05 |
>99 |
Отсутствует на эритроцитах Ну- |
|
DOYA |
D06 |
|
См. гл. 37 |
Антигены Doa, Dob и Joa полностью развиты к моменту рождения (Swanson и соавт. [45], Molthan и соавт. [23], Laird-Fryer и соавт. [18], Jensen и соавт. [14]). Антигены Gya и Ну, наоборот, на эритроцитах новорожденных выражены слабо (Clark и соавт. [6], Moulds и соавт. [26]).
Обработка эритроцитов папаином или фицином повышает серологическую активность антигенов Dombrock, поэтому антиглобулиновый тест с клетками, предварительно обработанными указанными ферментами, является оптимальным, особенно при определении антигенов Doa и Dob.
Вещество Dombrock разрушается трипсином, химотрипсином, проназой и сульфгидрильными редуцентами. Сиалидаза подобного эффекта не оказывает (Banks и соавт. [1], Brown [4], Spring и соавт. [42,43]).
Антигены Dombrock расположены на гликопротеине, связанном с гликозил-фосфадитилинозитолом (ГФИ). Этот пептид относится к группе аденозинди-фосфатрибозилтрансфераз.
Генный локус DO картирован на хромосоме 12 в позиции 12р13.2-12.1
Doa и Dob
В 1965 г. Swanson и соавт. [45] обнаружили у европейки по фамилии Dombrock антитела, реагирующие с эритроцитами примерно 64 % произвольно выбранных доноров. Авторы показали, что антиген, обозначенный ими Doa, не связан с другими антигенами эритроцитов и может быть отнесен к новой, ранее неизвестной системе.
В 1973 г. Molthan и соавт. [23] нашли антитела, открывающие антитетичный антиген - Dob.
Данные о частоте антигенов Dombrock у различных народов неполны, поскольку получены, в основном, с использованием сывороток анти-Ооа. Чаще всего антиген Doa встречается у европеоидов и негроидов, реже - у монголоидов (табл. 16.2, 16.3). Полученная на основе этих данных расчетная частота генотипов Do a/Do а, Do a/Do bnDo b/Dob составила соответственно 0,1764; 0,4872 и 0,3364.
Таблица 16.2
Частота антигена Doa и генов Doa и Dob у разных народов
|
Популяция |
Количество обследованных |
Частота антигена Doa |
Частота генов |
Источник |
||
|
абс. ч. |
% |
Do" |
Dob |
|||
|
Жители стран Северной Европы |
755 |
501 |
66,36 |
0,4200 |
0,5800 |
[45,48, 49] |
|
Белые американцы |
391 |
250 |
63,94 |
0,3395 |
0,6005 |
[30] |
|
Жители стран Северной Америки |
700 |
446 |
63,71 |
0,3976 |
0,6024 |
[19] |
|
Американские негры |
161 |
89 |
55,28 |
0,3313 |
0,6687 |
[30] |
|
Американские негры |
76 |
34 |
44,74 |
0,2566 |
0,7434 |
[48] |
|
Японцы |
760 |
179 |
23,55 |
0,1257 |
0,8743 |
[27,28] |
|
Жители Таиланда |
423 |
57 |
13,48 |
0,0698 |
0,9302 |
[5] |
Исследование эритроцитов более 2500 членов канадских, израильских, японских, негритянских и других семей с помощью сывороток анти-Ооа показало, что во всех случаях независимо от расовой принадлежности ген Doa проявлял себя как аутосомно-доминантный признак (Tippett и соавт. [48, 49], Lewis и соавт. [19], Polesky, Swanson [30]). У родителей Do(a+) х Do(a-) частота ожидаемых и частота фактических фенотипов детей по антигену Doa совпадали.
Частота фенотипов Dombrock
|
Сочетание антигенов |
Частота (%) среди |
|||||
|
Doa |
Dob |
Gya |
Ну |
Joa |
европеоидов |
негроидов |
|
+ |
— |
+ |
+ |
+ |
18 |
11 |
|
+ |
|
+ |
1 |
+ |
49 |
44 |
|
— |
| |
+ |
+ |
+ |
33 |
45 |
|
— |
— |
— |
|
— |
Редко |
|
|
— |
сл |
сл |
— |
— |
Редко |
|
|
сл |
сл |
+ |
сл |
— |
Редко |
|
Примечание: « + » - антиген присутствует; « - » - антиген отсутствует; сл - антиген слабо выражен.
Gy-
В другой семье, также чешского происхождения, было две женщины Gy(a-), содержавшие анти-Оуа-антитела. Обе женщины имели повторные беременности (Race, Sanger [32]).
Еще 6 индивидов Gy(a-) выявлены в английской семье, имевшей, как полагают Clark и соавт. [6], романское происхождение. У 4 сестер обнаружены анти-Оуа-антитела, у 2 их братьев они отсутствовали. Сестры имели многократные беременности.
Okubo и соавт. [29] описали 6 японских женщин Gy(a-). Редкий фенотип выявлен в связи с обнаружением у них анти-Оуа-антител.
Мак и соавт. [20] наблюдали мужчину Gy(a-) (китайца из Гонконга), имевшего анти-Gyа-антитела, вероятно, аллоиммунной природы: 40 лет назад ему перелили кровь.
Антиген Gya присутствует практически у всех людей. Лица Gy(a-) не были обнаружены при обследовании 9350 японцев (Okubo и соавт. [29]) и 10 145 американцев (Swanson и соавт. [46]). Среди негроидов Фенотип Gy(a-) не выявлен.
Из большого числа обследованных (4530 белых американцев, 735 чехов, 683 белых южноафриканца, 846 американских негров, 1023 черных южноафриканца, 633 южноафриканских индуса, 1679 американских индейцев) только один человек - европеец по происхождению - имел фенотип Gy(a-) и два индейца племени апачи имели фенотип Gy(a+W). Остальные обследованные были Gy(a+).
Ген, формирующий фенотип Gy(a-), наследуется по рецессивному типу. Описаны супружеские пары Gy(a+) х Gy(a+), имевшие детей Gy(a-) (Swanson и соавт. [46], Clark и соавт. [6], Okubo и соавт. [29], Massaquoi [21]). Родители, как правило, были кровными родственниками (Swanson и соавт. [46], Okubo и соавт. [29], Massaquoi [21]).
На эритроцитах Gy(a-) отсутствуют антигены Ну и Joa (Moulds и соавт. [26], Laird-Fryer и соавт. [18]), а также Doa и Dob. Подобная фенотипическая зависимость указывала на то, что перечисленные антигены могут входить в одну систему.
Ну
Первый образец сыворотки, содержащей анти-Ну-антитела, получили Schmidt и соавт. [40]. Позднее были найдены другие образцы антител указанной специфичности (Moulds и соавт. [26], Beattie, Castillo [3], Hsu и соавт. [12]). Носителями антител во всех случаях были негроиды, имевшие фенотип Ну-.
Moulds и соавт. [26] отметили фенотипическую связь антигенов Ну и Gya. Негроиды Ну- имели слабый антиген Gya [фенотип Hy-Gy(a+W)], тогда как у европеоидов Ну- и монголоидов Ну- антиген Gya отсутствовал.
Индивиды Hy-Gy(a-) вырабатывали анти-Gyа-антитела, индивиды Hy-Gy(a+W) - анти-Ну-антитела.
Сыворотки aHTH-Gya не содержали антител анти-Ну. Троекратная адсорбция сывороток aHTH-Gya эритроцитами Hy-Gy(a+W) полностью истощала активность анти-Оуа-антител. Элюаты с указанных эритроцитов вели себя в серологических реакциях так же, как антитела исходных неадсорбированных сывороток aHTH-Gya.
Все лица Hy-Gy(a+W) были Do(a-b+w), антиген Doay них отсутствовал, антиген Dob был выражен слабо (Banks и соавт. [1]).
У 7 лиц Hy-Gy(a+W), обследованных с использованием молекулярно-биологических методов, была найдена замена нуклеотида G 232 Т в экзоне 2, ведущая к аминокислотной замене Gly 108 Val (Rios и соавт. [37, 38]). У указанных индивидов обнаружена мутация С 898 G в экзоне 3, которая приводила к аминокислотной замене Leu 300 Val и, соответственно, уменьшала экспрессию антигенов Gya и Dob.
Joa
О выявлении антигена Joa (Joseph) впервые сообщили Jensen и соавт. [14], которые нашли антитела, идентифицировавшие этот антиген у 2 пациентов -американских негров. Обе сыворотки реагировали со всеми исследованными эритроцитами.
Третий образец анти^оа-антител обнаружили Morel и соавт. [24] у больного с серповидно-клеточной анемией.
Все три носителя анти^оа-антител получали многократные гемотрансфузии.
Laird-Fryer и соавт. [18] выявили у 5 негритянок антитела, обозначенные как aHTH-Jca. Позднее было показано, что эти антитела и антитела анти-Joа реагируют с одним и тем же антигеном (Weaver и соавт. [52]).
Частота встречаемости антигена Joa очень высока. Jensen и соавт. [14] при обследовании 3000 жителей Нью-Йорка, преимущественно европеоидов, а также 7689 американских негров не нашли ни одного человека с фенотипом Jo(a-).
Позднее было установлено, что антиген Joa отсутствует на эритроцитах лиц Hy-Gy(a-) и Hy-Gy(a+W), что свидетельствовало о фенотипической связи этих антигенов и возможной принадлежности к одной групповой системе. Вместе с тем все лица, имевшие анти-1оа-антитела, были Gy(a+)Hy+Jo(a-) (Laird-Fryer и соавт. [18], Weaver и соавт. [51], Brown и соавт. [4]). Тем самым было показано, что антигены Gya, Ну и Joa полностью различаются между собой.
Антиген Ну несколько отличался от антигена Joa. Если антиген Joa отсутствовал на эритроцитах Hy-Gy(a-) и обнаруживался только на эритроцитах Hy+Gy(a+), то антиген Ну присутствовал на эритроцитах и Gy(a+)Jo(a+), и Gy(a+) Jo(a-) (Spring и соавт. [43]).
Weaver и соавт. [51] нашли 4 человек Hy-Gy(a-)Jo(a-). Banks и соавт. [1] выявили пять человек Jo(a-)Do(a+wb+w) негров, одного испанца Jo(a-)Do(a+wb-).
Антигены Sc5, Sc6 и Sc7
Антитела, полученные от лиц с нулевым фенотипом Sc:-l,-2,-3, и фенотипами Sc:—1,2, 3 и Sc:l,-2,3, проявляли очевидную гетерогенность и перекрестную реактивность с эритроцитами разных фенотипов, в том числе трех перечисленных. Выявляемые с помощью этих антител антигены различались между собой. Усилиями молекулярных генетиков удалось установить, что все лица, выработавшие антитела к антигенам Scianna, были гомозиготами по точковым мутациям в разных участках гена ERMAP (табл. 15.4) (Flegel и соавт. [9] и Hue-Roye и соавт. [12]. Таким образом, система Scianna пополнилась сразу тремя антигенами.
Данные о клиническом значении антител affra-Sc5, airra-Sc6 и amn-Sc7 в литературе не представлены.
Свойства
Антигены Scianna устойчивы к действию большинства протеолитических ферментов, используемых в иммуносерологии: папаина, трипсина, бромели-на, химотрипсина (Daniels [4]). Обработка эритроцитов проназой, а также смесью трипсина и химотрипсина уменьшает выраженность этих антигенов. Резкое снижение экспрессии антигенов Scl и Sc2 отмечалось после обработки эритроцитов сульфгидрильными редуцентами (Spring и соавт. [36]). Это свидетельствовало о присутствии в структуре антигенов Scianna одной или более дисуль-фидных связей. Эндогликозилаза F, расщепляющая JV-гликаны, несколько угнетала связывание антител анти-Sc 1 с соответствующим антигеном. При этом связывание антител amn-Sc2 полностью устранялось. По-видимому, аминокислотная замена, определяющая специфичность антигенов Scl и Sc2, каким-то образом связана с iV-гликозилированием протеина Scianna. Обработка эритроцитов сиалидазой уменьшала мол. массу гликопротеина Scianna, изменяла его элек-трофоретическую подвижность.
Антитела системы Scianna
Антитела к антигенам Scianna встречаются редко. Они представлены, как правило, иммуноглобулинами G, лучше выявляются в антиглобулиновой пробе, не связывают комплемент. Описаны агглютинирующие антитела системы Scianna.
Четыре образца анти-8с2-антител выявлены у доноров - добровольцев, иммунизированных с целью получения реактивов анти-D. Один из доноров, эритроциты которого использовали для иммунизации, имел фенотип D+Sc2+ (Seyfried и соавт. [34]).
По данным Mollison и соавт. [24], из 19 добровольцев с фенотипом D-Sc2-, получивших по две и более инъекции эритроцитов D+Sc2+, у 8 образовались анти-Б-антитела и только у одного - анти-8с2-антитела.
В пяти случаях анти-8с4-антитела вызвали легкую форму ГБН, только одному из новорожденных потребовалось обменное переливание крови (Rausen и соавт. [32]).
DeMarco и соавт. [6] привели описание одного случая легкой формы ГБН, обусловленной анти-8с2-антителами.
В другом случае у новорожденного была зарегистрирована положительная прямая проба Кумбса, обусловленная антителами анти-Sc 1 субкласса IgG3, однако проведения лечебных мероприятий при этом не потребовалось (Кауе и соавт. [14]).
Антитела системы Scianna не вызывали гемолитических осложнений после гемотрансфузии. Однако исследование приживаемости радиоактивно меченных эритроцитов в организме больного, имеющего антитела анти-8сЗ, показало относительно быстрое выведение эритроцитов из кровяного русла (МсСгеагу и соавт. [22]). Интересно, что антитела также вскоре исчезли из плазмы крови реципиента. Попытка стимулировать их последующий синтез путем инъекции эритроцитов Sc:l,-2 эффекта не дала.
Антитела анти-8сЗ у упомянутой выше меланезийской девочки исчезли после спленэктомии и не появлялись даже после трансфузии крови Sc:l,-2 (Woodfield и соавт. [38]). Три образца антител Scianna описали Devine и соавт. [7], об одном из них они сообщили как о причине замедленной гемолитической трансфузионной реакции.
Описано несколько случаев выявления аутоантител анти-Sc 1 (Tregellas и соавт. [37], McDowell и соавт. [23], Owen и соавт. [28], Pierse и соавт. [30]). У 2 больных, имевших ослабленные антигены Scianna, помимо фиксированных на эритроцитах аутоантител, присутствовали свободно циркулирующие аутоантитела, которые находили в сыворотке крови, но не обнаруживали в плазме (McDowell и соавт. [23]).
У одного ребенка аутоиммунная гемолитическая анемия, вызванная аутоанти-телами анти-Sc 1, не поддавалась лечению кортикостероидами. Положительный лечебный эффект получен только после удаления селезенки (Owen и соавт. [28]).
Peloquin и соавт. [29] выявили аутоантитела aHTH-Sc3 в сыворотке крови 2 больных (с лимфомой и болезнью Ходжкина). Экспрессия антигенов Scl и Sc3 на их эритроцитах была снижена. Аутоантитела реагировали слабее с эритроцитами Sc:-1,2, чем Sc:l,-2.