Поиск по сайту
Считается, что адсорбция олигосахаридов Lewis на клетках пассивная [115], однако механизм, по-видимому, не столь прост. Транспортная функция эритроцитов изучена мало, хотя очевидно, что перенос многих биологически активных веществ - гормонов, ферментов, вирусов - это сложный микрофизиологический процесс, в котором немаловажная роль принадлежит серологически выявляемым структурам эритроцитов, в том числе Lewis.
Антигены Lea и Lex принимают участие в клеточной дифференцировке и опухолевой трансформации [75, 98] и рассматриваются как фактор, способствующий гематогенному метастазированию опухолевых клеток [97, 153, 222, 241]. Наряду с другими онкоэмбриональными антигенами антиген Lex, по мнению некоторых исследователей, может служить маркером прогрессирующей малигнизации [75, 83, 96, 99].
Lex хорошо выражен в эмбриональных тканях [83, 212] - отсюда его обозначение SSE-1 (Stage Specific Embryotic Antigen-1). Он максимально экспрес-сирован на стадии морулы у мышей и, как полагают [212], играет определенную роль в преимплантации эмбриона.
Fukushi и соавт. [78], исследуя человеческие эмбрионы в разные сроки развития, установили, что Lex появляется через 40 дней с момента оплодотворения, достигает максимума к 50-70 дням, далее его экспрессия уменьшается.
У взрослых Lex присутствует на нейтрофилах, эпителии проксимальных канальцев почек [49, 76, 78] и желудочно-кишечного тракта [200].
Lea, Lex и их производные (Leb и Ley), обработанные сиалидазой, накапливаются в опухолевых клетках, которые в процессе малигнизации утрачивают нормальную дифференцировку [46, 79, 112, 200] и возвращаются к экспрессии антигена Lex, свойственного эмбриональным тканям.
Как показали серии исследований [34, 38, 131, 231], антигены Lex и Lea, обработанные сиалидазой и сульфатазой, являются лигандами адгезивных молекул, обеспечивающих хоминг лимфоцитов при остром воспалении.
Адгезия, так же как и трансэндотелиальная миграция лимфоцитов, обусловлена адгезивными молекулами, экспрессированными на поверхности эндотели-альных клеток [30,147,152].
Антигены Lex, Ley (в меньшей степени Lea, Leb и Led) обнаружены в грамо-трицательныех бактериях Helicobacter pylori [24, 25, 159, 174], вызывающих хронический гастрит [237], язву желудка и двенадцатиперстной кишки [85], лимфому [190] и аденокарциному желудка [181,182, 189].
По мнению Appelmelk и соавт. [20], патогенез Helicobacter-шщуцщюванноп) гастрита включает аутоиммунный компонент и сводится к следующему. Антигенная мимикрия по Lex позволяет Helicobacter pylori, оставаясь незамеченными, нарабатывать большое количество антигена Lex, к которому в итоге вырабатываются нейтрализующие его антитела airra-Lex. Последние, будучи перекрестно реагирующими, взаимодействуют не только с Helicobacter, но и с эпителием желудка, провоцируя гастрит.
Teneberg и соавт. [226] и другие авторы [167,168] полагают, что Helicobacter pylori содержат нейтрофилактивные протеины, способствующие накоплению нейтрофилов в слизистой оболочке желудка.
Щ Другие исследователи [37, 73, 113] связывают роль Helicobacter в этиологии гастрита с непосредственным их прилипанием к слизистой оболочке желудка с помощью адгезивных Ьеь-молекул, что приводит к локальному воспалению.
Молекулярная мимикрия, по мнению ряда авторов [64, 133, 215], лежит в основе заражения человека кровяным гельминтом Schistosoma mansoni, который синтезирует гликоконъюгаты, несущие антиген Lex. Анти-Ьех-антитела, вырабатывающиеся у инвазированных людей, предотвращают повторное заражение [50, 65]. Однако эти антитела способны вызывать комплементзависимый цитолиз гра-нулоцитов, что приводит к нейтропении, наблюдаемой при шистозоматозе [209].
Слабый (Ье™)-фенотип
Слабая выраженность антигенов Lewis обусловлена аминокислотными заменами в генах, контролирующих продукцию фукозилтрансфераз [71,134,172,180].
Koda и соавт. [134] нашли у японцев Le(a-b-) 2 мутации в гене FUT3 (Leu 20 —> Arg, Gly 170 —> Ser). Опыты с клонированием гена Le в COS-клетках показали, что замена Gly 170 —> Ser приводит к продукции неактивного фермента, тогда как при замене Leu 20 щ Arg вырабатывалась активная фукозилтрансфераза, о чем свидетельствовало появление антигена Leb на поверхности COS-клеток.
Mollicone и соавт. [172] также выявили мутацию Leu 20 щ Arg у индонезийцев Le(a-b-), которые содержали антигены Lewis в слюне. Такие же замены описаны у японцев [180] и шведов [71]. Замена аргинина на лицин приводила к экспрессии слабовыраженного антигена Lewis.
Nishihara и соавт. [179] и Mollicone и соавт. [172] описали мутацию Не 356 —» Lys. Гетерозигота по этой мутации, 18 из 19 индонезийцев Le(a-b-), не содержали антигенов Lewis ни на эритроцитах, ни в слюне.
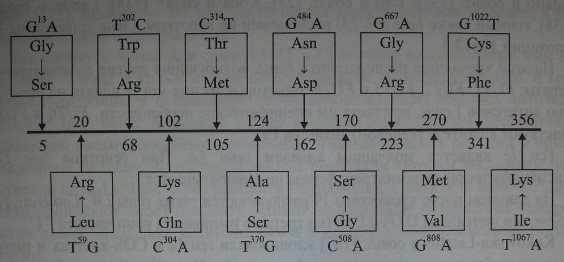
Cooling и Gu [59] исследовали с помощью ПЦР 15 афроамериканцев, имевших фенотип Lenull, Отмечены варианты мутаций в FUT3, которые приводили к продукции неактивного фермента и в результате формировали нулевой фенотип. Одну из мутаций (G —> А) в нуклеотиде 13 обнаружили у 50 % обследованных (рис. 9.3), она приводила к замене Gly 5 —£ Ser. У других обследованных обнаружили мутации G —► Т в нуклеотиде 1022, G Щ А в нуклеотиде 484, G ->
Мутации в гене FUT3 у лиц с фенотипом Lewisnuir Двенадцать нуклеотидных замен, приводящих к продукции неактивной фукозилтрансферазы, по Cooling, Gu [59].
А в нуклеотиде 667. Они приводили к замене Cys 341 Щ Phe, Не 356 Ш Lys, которые также сочетались с низкой активностью фукозилтрансферазы.
Две мутации, Trp 68 —► Arg и Thr 105 —> Met, найдены Elmgren и соавт. [71]. Для того чтобы определить их влияние на активность фукозилтрансферазы, Elmgren и соавт. [70] сконструировали 2 химеричных протеина: FUT3 с Trp 68 —> Arg и FUT3 с Thr 105 —> Met. При первой замене продуцировался фермент с низкой активностью, тогда как при второй замене активность фермента соответствовала норме. Авторы пришли к выводу, что гомозиготность по Trp 68 —* Arg дает фенотип Le(a-b-).
Orntoft и соавт. [187] описали мутацию (С 445 А) у человека Le(a-b-), больного раком. Эта мутация приводила к продукции метионина в позиции 146, однако такая же мутация обнаруживалась и у здоровых лиц.
Mollicone и соавт. [171] установили, что примерно 9 % жителей острова Ява не имеют <х(1,3)-фукозилтрансферазы (FUT6), обычно присутствующей в плазме человека, однако содержат антигены Lewis.
При клонировании гена FUT5 от лиц с дефицитом а(1,3)-фукозилтрансферазы найдены 3 точки мутаций: Arg 173 Щ Cys, Pro 187 Ш Leu, Thr 388 —► Met, которые, однако, не сказывались на активности фермента.
При клонировании гена FUT6 выявлены замены Pro 124 —► Ser, Glu 247 —> Lys, Туг 315 —► стоп-кодон. Две последние замены приводили к продукции неактивного фермента. Замены Glu 247 т Lys и Tur 315—» стоп-кодон в FUT6, которые сочетались с дефицитом а(1,3)-фукозилтрансферазы, обнаружены среди полинезийцев и шведов (Larson и соавт. цит. по [115]). Таким образом, ген FUT6 отвечает за активность <х(1,3)-фукозилтрансферазы в плазме у людей и как другие гены FUT полиморфен.
Большинство антител Lewis не способно разрушать эритроциты, содержащие соответствующие антигены, in vivo [111]. Холодовые антитела анти-Le IgM, температурный оптимум которых ниже комнатной температуры 20-22 °С, не активны при температуре тела человека. Неполные антитела анти-Le IgG, хотя и являются тепловыми, однако не вызывают посттрансфузионных осложнений как истинные антиэритроцитарные антитела.
Выделяют четыре причины, по которым Lewis-несовместимость не проявляет себя клинически [115].
Во-первых, большинство антител, особенно анти-Le15, имеет низкую активность. Многие из них не реагируют с нативными эритроцитами и определяются только с помощью стандартных эритроцитов, обработанных протеолитически-ми ферментами (фицин, папайи, бромелин). Такие ферментзависимые антитела в реакциях несовместимости in vivo не участвуют.
Во-вторых, антигены Lewis, присутствующие в донорской плазме (если переливают цельную кровь) и в том небольшом количестве плазмы, которое имеется в эритроцитарном концентрате, нейтрализуют антитела Lewis реципиента. Взаимодействие антител с растворенными в плазме субстанциями происходит быстрее, чем с субстанциями, фиксированными на мембране эритроцитов, и деструкция эритроцитов не успевает развиться.
В-третьих, перелитые эритроциты утрачивают свои антигены Lewis в плазме реципиента. Например: эритроциты Le(a-b+), перелитые реципиенту Le(a-b-), имеющему антитела анти-Le15, становятся Le(a-b-), а олигосахариды Leb, смытые с эритроцитов, нейтрализуются присутствующими антителами анти-Le15.
В-четвертых, если антитела имеют специфичность aHTH-LebH, они способны реагировать только с эритроцитами OLe(a-b+), но не эритроцитами ALe(a-b+). Таким образом, для реципиентов группы А(П), содержащих антитела aHTH-LebH, любые эритроциты А(П) будут совместимыми.
Совместимость донора и реципиента по групповым антигенам, растворенным в плазме крови, в трансфузиологии не учитывают.
Иммуносерологам и трансфузиологам известно, что универсальную плазму группы AB(IV), содержащую группоспецифические субстанции АВО, переливают в большом количестве (2-2,5 л и более) реципиентам А(И) и В(Ш), имеющим естественные антитела против этих антигенов. Однако при этом каких-либо осложнений не наблюдают.
Антигены системы Gm при переливании плазмы также не учитывают, хотя некоторые реципиенты (по нашим подсчетам, около 5 %) содержат антитела против иммуноглобулинов переливаемой плазмы. Однако и в этих случаях трансфузии не сопровождаются реакциями.
По-видимому, взаимодействие растворимых антигенов с антителами не приводит к посттрансфузионным реакциям, но когда мишенью становятся нерастворимые антигены, фиксированные на эритроцитах, последние разрушаются, что проявляется клинически в виде тяжелого посттрансфузионного осложнения.
Антигены Lewis, являясь по своей природе водорастворимыми, в основной своей массе находятся в плазме и реагируют с соответствующими антителами в жидкофазной системе. Эритроциты, содержащие антигены Lewis в значительно меньшем количестве, чем плазма, остаются интактными. Это, на наш взгляд, пятая причина того, почему несовместимость донора и реципиента по системе Lewis не вызывает посттрансфузионных реакций.
В экспериментах по приживлению эритроцитов, меченных Cr51, in vivo установлено, что время циркуляции эритроцитов Le(a~b+) у реципиентов, имеющих анти-Ееь-антитела, такое же, как у реципиентов без антител. Немедленных или отсроченных трансфузионных реакций не наблюдали. Уровень гемоглобина после переливания Ееь-несовместимых эритроцитов повышался как при совместимой трансфузии и оставался одинаковым в течение нескольких недель.
При огромном объеме трансфузиологической помощи в современной медицинской практике лрансфузионные реакции, вызванные антителами анти-Le3, все-таки регистрируют (М.А. Умнова и др. [12], Krieger, Simmons [136], Brendemoen, Aas [43] и др. [160,164,191]).
Jesse, Sheek [119] описали острую гемолитическую реакцию средней тяжести у 21-летней африканки, которой в связи с осложненным спонтанным выкидышем 4 раза перелили кровь. Перекрестные пробы на индивидуальную совместимость (тест с центрифугированием и непрямая реакция Кумбса) перед каждой трансфузией были отрицательными. После 4-го переливания у женщины появились боли в пояснице, озноб, температура, гематурия. Кроме анти-Ееь-антител, в сыворотке женщины других антиэритроцитарных антител не обнаружено. Гемолитическая реакция была кратковременной, осложнение через 2 дня было купировано. Авторы полагали, что картина посттрансфузионного осложнения была вызвана анти-Ееь-антителами. Другие случаи гемолитических посттрансфузионных реакций, обусловленных антителами анти-Leb, не описаны.
Aubuchon и соавт. [26], van Loghem и соавт. (цит. по [6]) привели случаи посттрансфузионных реакций, обусловленных антителами анти-Leх. Для таких реципиентов практически все доноры несовместимы. Однако даже в этих случаях, как отмечают Waheed и соавт. [233], посттрансфузионные реакции крайне редки.
В акушерской практике зарегистрированы единичные случаи гемолитической болезни новорожденных, связанные с Lewis, которые, однако, вызывали сомнение относительно их обусловленности именно этим фактором. Mollison и
соавт. [173], анализируя эти работы, не нашли достаточного клинического и гематологического подтверждения.
Как показали Spitalnik и соавт. [213], в 12 случаях из отобранных ими 13 пар мать - плод в крови матери присутствовали одновременно IgM и IgG анти-Ьеа-антитела, в пуповинной крови новорожденных имелись антитела анти-Le8 IgG, регистрируемые только высокочувствительным ферментсвя-зывающим имммуносорбентным методом. Гемолитических реакций у новорожденных не бвло. Полученные данные позволили авторам заключить, что антитела анти-Le3 IgM через плаценту не проходят, а антитела анти-Leа IgG легко проникают через плаценту, однако не вызывают разрушения эритроцитов плода, поскольку антигены Lewis у плодов и новорожденных отсутствуют.
Ингибиция Lewis-антител
Lewis-антитела нейтрализуют с целью идентификации антител другой специфичности, присутствующих в сыворотке. Для этого используют образцы слюны, тестированные на наличие субстанций Lea, Leb и АВН, а также вытяжки из гуммиарабика или синтетические антигены Lewis (Spitalnik и соавт., цит. по [115]). Цельная слюна нередко вызывает гемолиз эритроцитов, поэтому ее предварительно разводят раствором натрия хлорида и кипятят, чтобы устранить присутствующую в ней слизь. Методика подробно описана П.Н. Косяковым [6] и Judd [125].
Mollison и соавт. [173] описали случай, когда пациенту Le(a-b-), имеющему антитела анти-Le3 + Leb, гемолизирующие эритроциты в тестах in vitro, с целью нейтрализации антител ввели парентерально очищенный концентрат Le3 и Leb. Антитела пациента были нейтрализованы in vivo, после чего ему было перелито несколько доз крови Le(a-b+) без каких-либо реакций. Через несколько дней антитела анти-Le3 и aHra-Leb снова появлялись в плазме пациента, теперь уже в более сильной форме, чем до нейтрализации. Прямая проба Кумбса стала положительной, поскольку перелитые ранее эритроциты были Le(a-b+) и сенсибилизировались антителами in vivo, однако гемолиза не наблюдалось. Вскоре циркулирующие эритроциты приобрели фенотип реципиента Le(a-b-) и прямая проба Кумбса стала отрицательной.
Нейтрализация антител in vivo была применена также Andorka и соавт., Pelosi и соавт. (цит. по Issitt, Anstee [115]), но широкого распространения не получила: в значительной степени в связи с тем, что в этих модельных экспериментах даже сильные антитела, деструктирующие эритроциты in vitro, не проявляли реактогенных свойств in vivo.
Хромосомная локализация
По данным Mollicone и соавт. [172], Nishihara и соавт. [179], Kukowska-Latallo и соавт. [137], Ball и соавт. [28], Koda и соавт. [134], Lamm и соавт. [138], генный локус Lele (FUT3) расположен на коротком плече хромосомы 19 в позиции 19р13.3.
На этой хромосоме располагаются гены, кодирующие другие фукозилтранс-феразы: FUT1, FUT2, FUT5 и FUT6. Некоторые из них могут влиять на продукцию антигенов Lewis, придавая им специфические особенности. FUT6 и FUT2 участвуют в синтезе тканевого антигена Ley.
Ген к является молчащим аллелем гена Le. При генотипе lele Le-генспецифическая фукозилтрансфераза не вырабатывается.
На длинном плече хромосомы 19 располагаются также гены LW, Lutheran, Eh и Sese, ген пептидазы D {Pep D) и ген третьего компонента комплемента - С,.
Kukowska-Latallo и соавт. [137] клонировали ген Le в COS-клетках и получили рекомбинантные фукозилтрансферазы <х(1—»3) и а(1—>4), способные синтезировать антигены Lea, Leb и X (SSEA-1). Клонированные трансферазы являлись продуктом именно Ze-гена и были однотипны с Lewis-трансферазой, полученной из человеческого молока [151,195].
Suh и соавт. [220] описали несколько мутаций в генах FUT2 и FUT3, при которых антигены Lewis не вырабатывались, f'
AHTH-AjLe5 и анти-ВЬеь
В 1968 г. Seaman и соавт. [206] при выполнении пробы на индивидуальную совместимость эритроцитов донора с сывороткой больного Siedler нашли антитела анти-А^е13. Сыворотка реагировала с эритроцитами, содержащими оба антигена - Ах и Leb, но не реагировала с эритроцитами OLe(b+) и AjLe(b-), содержащими эти антигены порознь. Вскоре 2 такие же сыворотки были найдены Grookston и соавт. [61] и Gundolf [94].
Антитела анти-А^еь нейтрализуются слюной всех секреторов А независимо от Lewis-групповой принадлежности (Grookston и соавт. [61]).
У лиц с фенотипом A1Leb антиген AjLeb присутствует в слюне.
Наряду с антителами анти-А^е* встречаются антитела aHTH-BLeb, реагирующие с антигеном Leb, когда тот присутствует на эритроцитах вместе с групповым антигеном В.
Антитела анти-А^е13 и aHTH-BLeb направлены против олигосахаридов Lebтипа 1, к которым добавлены имммунодоминантные сахара А или В, что и приводит к формированию антигенных детерминант, определяемых указанными антителами.
Для сравнения: антитела aHTH-LebL реагируют только с эритроцитами 0(1), A2Le(b+); а анти-А Leb и aHTH-BLeb - с эритроцитами, несущими Leb и соответствующую А- или В-детерминанту.
Tilley и соавт. [228], Crookston и соавт. [90] установили, что у людей AtLebи BLeb в плазме присутствуют гликосфинголипиды, несущие соответственно антигены AjLeb и BLeb. Такие лица по набору генов относятся к A1, Le, Se и В, Le, Se соответственно. Насколько известно, ни анти-А^еь, ни aHTH-BLeb не дают реакций при переливании компонентов крови (Issitt, Anstee [115]).
Анти-А^е11 и анти-ВЬей
В 1958 г. Andresen [14], обследуя больного раком желудка с фенотипом A2Le(a~b+), нашел антитела, которые реагировали с эритроцитами AjLe(a-b-) секреторов, менее сильно - с эритроцитами АХе(а-Ь-) секреторов. Автор предположил, что ген Se в отсутствие гена£е специфически видоизменяет экспрессию антигена А и что обнаруженные им антитела (известные в литературе как Magard-антитела) выявляли антиген A1Led. Последующие исследования (Hirsch и соавт., 1975) подтвердили предположение Andresen. Magard-сыворотка была первой из обнаруженных сывороток со специфичностью анти-А1Ьес1. Эти антитела, как теперь известно, реагируют с олигосахаридами типа 1А (производными цепей типа 1Н). Анти-А1Ьес1, так же как aHTH-BLed, не дают трансфузионных реакций.