Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...
Система Colton и система LW
Сыворотки amn-LWa и aHTH-LWab реагируют сильнее, если антигены LWa и LWab находятся на эритроцитах D+. Те же антигены на эритроцитах D- реагируют слабее (Levine и Celano [32], Swanson и соавт. [60], DeVeber и соавт. [14], White и соавт. [67]). В некоторых случаях эти различия настолько выражены, что антитела aHTH-LWa ошибочно идентифицируют как анти-D.
AHTH-LWb-aHTm^ia проявляют себя в серологических реакциях с эритроцитами D+ и D- так же, однако из-за низкой частоты открываемого ими LWb-aHTrareHa их трудно принять за анти-D.
Аллоиммунные aнти-LWa-aнтитeлa обнаруживают у лиц, имеющих фенотип LW(a-b+) и LW(a-b-).
Большинство aHTH-LWa-aHTm^ найдены у пациентов, которым производили гемотрансфузии, однако сенсибилизация может наступить вследствие беременности (Giles [18]).
Napier и Rowe [41] находили aHTH-LWa-aHTm^a у добровольцев D-, искусственно иммунизированных антигеном D.
Известно всего два случая образования aHTH-LWab-aHTm^ у лиц с генетически обусловленным (унаследованным от родителей) фенотипом LW(a-b-) (DeVeber и соавт. [14], Poole и соавт. [47]). В одном из них упомянутая выше женщина (миссис Big.) имела три беременности и не подвергалась гемотранс-фузиям. Сыворотка ее крови содержала сильные aHTH-LWab-aHTm^a, которые реагировали с эритроцитами LWab+D+ в разведении 1: 32 ООО и с эритроцитами LWab+D- в разведении 1 : 1000. При последующем наблюдении титр антител снизился, они перестали улавливать различия в экспрессии антигена LWabна эритроцитах D+ и D- (DeVeber и соавт. [14]).
Perrault и соавт. [45] отделили aHTH-LWab-aHTm^a IgM от aHra-LWab-aHTm^ IgG и установили, что агглютинины IgM лучше выявляют различия в экспрессии антигена LWab на эритроцитах D+ и D-, чем антитела IgG.
Несколько образцов aHTH-LWb-aHran^ было найдено в Финляндии. Первый из них содержал моноспецифические aHTH-LWb-aHTm^a, последующие присутствовали в сочетании с антителами анти-К, анти-Кра и анти-1Ла. Все финны, имевшие a№ra-LWb-aHTm^a, были D+, у них наблюдались заболевания крови, и им многократно производили гемотрансфузии.
Антитела системы LW могут иметь аутоиммунное происхождение. Их обнаруживали у больных LW+, страдавших аутоиммунной гемолитической анемией. Эритроциты пациентов реагировали в прямой антиглобулиновой пробе, что свидетельствовало о присутствии на их поверхности аутоантител. Свободно циркулирующие аутоантитела, имевшиеся у больных, проявляли себя как аллоиммунные, и их трудно было отличить от истинных аллоиммунных, особенно у больных с приобретенным фенотипом LW-.
Случаев развития ГБН или посттрансфузионных реакций, обусловленных LW-антителами, не зарегистрировано. Многим реципиентам, имевшим антитела анти-LW8 и aHTH-LWab, производили трансфузии эритроцитов, несовместимых по системе LW, без каких-либо проявлений (Perkins и соавт. [44], Komatsu и соавт. [26], Reid и соавт. [49], Devenish [15], Cummings и соавт. [12], Chaplin и соавт. [10]). Суперактивные aHTH-LWab-amm^[a, обнаруженные у миссис Big., не оказали влияния на здоровье родившегося у нее ребенка (DeVeber и соавт. [14]).
Антитела системы LW чаще относятся к IgG, а именно к IgGl-субклассу (Reid и соавт. [49], Napier и Rowe [41], Cummings и соавт. [12]). Один из описанных образцов анти^^^-антител представлял собой смесь IgM и IgG, другой, не активный в антиглобулиновой пробе, содержал антитела только IgM-класса (Swanson и соавт. [63]).
Приживаемость несовместимых по LW-антигенам эритроцитов у большинства реципиентов, имевших anra-LWa- и aHTH-LWab-annn^a, существенно не отличалась от контрольных показателей (Komatsu и соавт. [26], Reid и соавт. [49], Napier и Rowe [41], Cummings и соавт. [12], Chaplin и соавт. [10]). Исключением явились два образца aнти-LWab-aнтитeл, которые относились к IgG3-субклассу (Villalba и соавт. [64], Herron и соавт. [24]). В одном случае приживаемость эритроцитов LW+D-, меченных радиоактивными изотопами, составила 53 % уже через 1 ч после их введения.
У реципиентов, содержащих высокоактивные anra-LWb-aHTm^a, эритроциты LW(b+), введенные внутривенно, быстро исчезали из кровотока: полупериод их циркуляции составил от 2 до 5 ч (Sistonen и соавт. [53]).
По результатам экспериментов некоторые образцы антител LW могли быть отнесены к трансфузионно опасным, однако видимых реакций они не давали.
Perrault [45] при обследовании 45 ООО доноров выявил 10 человек, имевших аутоантитела анти-LW. Восемь носителей аутоантител были здоровы, 2 больны (у одного был язвенный колит, у другого - опухоль слюнной железы). Аутоантитела выявлены с помощью автоматического анализатора в условиях низкоионной среды с полибреном, при использоваии обычных методов исследования их обнаружить не удалось. Уменьшения продолжительности жизни эритроцитов in vivo аутоантитела не вызывали.
Levine [29] высказал суждение, что аутоантитела анти-LW у больных с аутоиммунной гемолитической анемией, у которых получены положительные результаты прямой пробы Кумбса, встречаются весьма часто. Celano и Levine [9], адсорбируя элюаты, снятые с эритроцитов 6 таких больных, эритроцитами LW(a-b+), нашли аутоантитела aHra-LWa во всех случаях, один элюат содержал только LWa-ayToaHTm^a.
Другие авторы (Vos и соавт. [65]) для адсорбции элюатов использовали эритроциты LW(a-b-)LWab- и выявили аутоантитела анти-LW у 6 из 8 больных с аутоиммунной гемолитической анемией. Во всех элюатах аутоантитела анти-LW присутствовали с антителами другой специфичности.
Антитела системы LW были получены путем иммунизации кроликов и, гораздо успешнее, морских свинок. Для иммунизации использовали эритроциты обезьян Macacus rhesus, бабуинов, а также людей с различной Rh-принадлежностью (Fisk и Foord [16], Levine и соавт. [32, 36], Swanson и соавт. [61], Polesky и соавт. [46], Wiener и соавт. [68, 69]). Экстракты, полученные из эритроцитов человека путем подогрева, также стимулировали у животных образование aHTH-LW-антител (Murray и Clark [40], Levine и соавт. [30, 31]).
Антитела, вырабатываемые морскими свинками и кроликами, не реагируют с эритроцитами LW(a-b+), проявляя таким образом специфичность ajrra-LWa. Данные о способности указанных животных вырабатывать aHra-LWab-amm^a отсутствуют.
Эритроциты LW(a-b+) и LW(a-b-) от миссис Big. стимулировали образование aHTH-LW-aHTm^ у морских свинок (Vos и соавт. [65], Polesky и соавт. [46]). По отношению к этим животным лишь эритроциты RhnuI1 не обладали иммуно-генностью (Levine и соавт. [29,34], Polesky и соавт, [46]). Иммунный ответ животных на введение эритроцитов LW(a-b-) от мисс Big. оказался полной неожиданностью, поскольку на указанных клетках LW-гликопротеины отсутствовали.
К настоящему времени имеется несколько серий моноклональных анти-LWab-annn^, которые были получены путем иммунизации мышей эритроцитами человека и обезьян Macacus rhesus (Sonneborn и соавт. [56, 57], Oliveira и соавт. [42]). Антитела взаимодействуют со всеми образцами эритроцитов за исключением LW(a-b-). Некоторые образцы антител реагировали с папинизиро-ванными эритроцитами LW(a-b+) (Sonneborn и соавт. [56]).
Связывание мышиных моноклональных aHTH-LWab-aHTm^ полностью блокировалось после контакта эритроцитов с аллогенными антителами указанной специфичности. Частичный блокирующий эффект давали также человеческие aHTH-LWa-cbiBOpOTKH. Сыворотки анти-D реакцию aHra-LWab-aHTm^ не блокировали, что свидетельствовало о разных качествах антигенов LW и RH.
Hermand и соавт. [22] полагают, что мышиные МКА распознают эпитопы, находящиеся на первом IgSF-домене LW-гликопротеина. Получены также мышиные МКА, распознающие антигенные участки на первом и втором IgSF-доменах (Blanchard и соавт. [4]). Иммунизацию мышей проводили рекомбинантным химерным протеином, состоящим из двух IgSF-доменов и Fc-фрагмента IgGl человека.
Значение в биологии человека
Гликопротеин LW [CD242, или ICAM-4 (intercellular adhesion molecules)] вместе с другими дифференцировочными антигенами - CD54 (ICAM-1), CD 102 (ICAM-2), CD50 (ICAM-3) - выполняет в организме функцию рецепторов клеточной адгезии (Wang и соавт. [66], Parsons и соавт. [43]), являясь лигандом более 20 различных типов интегринов, обеспечивающих межклеточное взаимодействие (Hynes [25], Spring и соавт. [59]).
Молекулы адгезии ICAM-1, ICAM-2 и ICAM-3 присутствуют на лимфоцитах, гранулоцитах и моноцитах, в то время как ICAM-4 (LW-антигены) свойственны эритроидным клеткам и тканям плаценты (Parsons и соавт. [43]).
Фиксация эритроцитов в селезенке макрофагами, распознающими адгезивные ICAM-4-молекулы, может служить одним из механизмов удаления из кровотока стареющих или, наоборот, атипично молодых форм.
Взаимодействие выделенного из эритроцитов ICAM-4-адгезиного вещества с моноцитами, Т-, В- и NK-клетками блокировалось антителами aHTH-CD18; взаимодействие с Т-клетками блокировалось также анти-CDl la-антителами (Bailly и соавт. [2]).
LW-гликопротеины эритроцитов связываются с^-интегринами эндотелиаль-ных клеток и тем самым способствуют закупорке мелких сосудов у больных с серповидно-клеточной анемией. Экспрессия LW-антигенов на эритроцитах этих больных может быть повышенной.
Антигены LW найдены в эритроцитах всех исследованных приматов: шимпанзе, горилл, орангутангов, бабуинов и многих других обезьян. Эти антигены отсутствуют у мышей, крыс, кроликов, кошек, коз, овец, лошадей (Levine,Celano [33], Shaw [50]).
Измерение участков связывания антигена LW с анти-Ь\¥^аЬ-антителами показало, что на одном эритроците взрослого человека D+ присутствует 4400 LW*-эпитопов, на одном эритроците человека D- находится 2835 LW*-3rorronoB. Для новорожденных D+ и D- эти показатели составили 5150 и 3620 соответственно (Mallinson и соавт. [38]).
Сообщалось, что антигены СсЕе, а также гомозиготность по гену D не оказывают какого-либо влияния на экспрессию антигенов LW (Swanson и соавт. [61]). Однако имеются и прямо противоположные данные. Так, Gibbs [17] нашел, что эритроциты лиц DCe/DcE имели более сильные антигены D и LW, чем эритроциты лиц DcE/dce и DCe/dce. На эритроцитах лиц Du антигены D и LW были выражены еще более слабо (Swanson и соавт. [61]).
Антигены системы LW лучше выражены на эритроцитах новорожденных, поэтому реакция ксеногенных антител с эритроцитами детей более сильная, чем с эритроцитами взрослых. В отличие от ксеногенных сывороток сыворотки анти-LW ал-логенного происхождения реже выявляют это различие (Swanson и соавт. [61]).
В онтогенезе антигены LW формируются на стадии колониеобразующих предшественников (Southcott и соавт. [58]) или позднее, на стадии проэритро-бластов (Bony и соавт. [8], Hermand и соавт. [23]).
Антигены системы LW обладают некоторым эффектом дозы, который отметили Sistonen и соавт. [52], однако слабые реакции наблюдались с эритроцитами не только гетерозигот (LWa/LWb\ но и гомозигот (LWa/LWa). При обследовании 10 014 финнов с фенотипом LW(a+) эти авторы наблюдали слабовыраженные реакции у 722 человек, из которых 348 были гомо- и 374 гетерозиготами. Daniels [13] полагает, что для экспрессии антигенов LW большее значение имеет выраженность антигена D, чем гомо- им гетерозиготность по генам LW и LWb.
Антигены системы LW устойчивы к действию папаина, фицина, трипсина и химотрипсина, однако разрушаются проназой (Lomas, Tippett [37]). Эту особенность используют для дифференцировки антител системы LW и Rh.
Экспрессия антигенов LW обусловлена не только генетическими факторами. Описан транзиторный фенотип LW- с временной утратой эритроцитами всех антигенов LW Этот фенотип диагностировался в связи с обнаружением антител к антигенам LW или LW*. Утрата антигенов часто имела обратимый характер. Первое описание транзиторного фенотипа LW- у Rh-отрицательной беременной опубликовали Giles и Lundsgaard [19]. Незадолго до родов эритроциты беременной были LW-, а сыворотка крови содержала антитела анти-D, анти-С и анти-LW; прямая антиглобулиновая проба с ее эритроцитами была слабоположительной. Через 1 год после родов эритроциты женщины тестировались как LW+, антитела анти-LW не выявлялись. Позднее было описано еще три случая транзиторного фенотипа LW-c aHra-LW-антителами: у двух беременных D- и одного реципиента D+ (Chown и соавт. [11]). Авторы полагали, что имела место утрата антигенов LW, которую нельзя было объяснить блокадой LW-эпитопов антителами анти-LW.
У 11 из 18 мужчин с D-, иммунизированных антигеном D, Chown и соавт. [11] наблюдали появление антител, напоминавших по специфичности анти-LW. Авторы предположили, что aHTH-LW-антитела, возможно, являются предвестником последующей выработки анти-Б-антител.
Swanson и соавт. [62] наблюдали мальчика D+, которому была произведена трансплантация костного мозга от родной сестры D-. Через 3 мес. после трансплантации в сыворотке крови реципиента определялись антитела анти-D и анти-LW. Вероятно, они образовались в результате иммунного ответа трансплантироваиных лимфоцитов донора на антигены D и LW реципиента. Спустя 2 года после трансплантации у реципиента выявлялись только слабые aHra-D-антитела, aHra-LW-аттела исчезли.
Экспрессия антигенов LW может снижаться при некоторых заболеваниях и возвращаться к норме по мере выздоровления. Данный феномен описан у нескольких больных лимфомой, лейкемией, саркомой и другими злокачественными опухолями (Giles и соавт. [18], Perkins и соавт. [44], Villalba и соавт. [64], Komatsu и соавт. [26]). Нередко эти больные умирали до полного восстановления экспрессии указанных антигенов на эритроцитах.
Komatsu и соавт. [26] описали японца со злокачественной лимфомой, у которого во время двух рецидивов заболевания на фоне химиотерапии исчезал антиген LWa и появлялись aHTH-LWa-aHTm^a. Во время ремиссий указанные антитела отсутствовали, эритроциты больного были LW(a+).
Возникновение фенотипа LW- наблюдали во время беременности и имму-нодефицитного состояния (Reid и соавт. [49], Devenish и соавт. [15]).
Эритроциты большинства людей с приобретенным фенотипом LW(a-b-) не реагируют с антителами aHTH-LWab.
Chown и соавт. [11] отметили связь между степенью экспрессии антигенов LW на эритроцитах и спектром антител в сыворотке крови. Некоторые больные LW(a-b-) содержали слабый антиген LWab и aHTH-LWa-airan^a. У других пациентов, утративших антигены LW, антитела имели направленность aHra-LWab. Нередко направленность антител (airoi-LWa или affra-LWab) установить не удавалось.
Sistonen и соавт. [52] описали больного LW(a-)LWab+, у которого в терминальной фазе заболевания фенотип сменился на LW(a-)LWab-. Два его брата и две дочери имели фенотип LW(a-)LWab+. Больной был женат на двоюродной сестре. Впоследствии некоторые члены указанной семьи были обследованы на наличие антигена LWb. Оказалось, что один из братьев больного и обе дочери имели фенотип LW(b+). Эритроциты больного, хранившиеся длительное время в замороженном состоянии, также были исследованы на наличие антигена LWb. Адсорбционные тесты показали следы антигена, из чего следовал вывод, что антиген LWb мог быть утрачен вместе с другими антигенами этой системы.
В большинстве популяций антигены LWa и LWb имеют противоположный характер распределения: LWa встречается часто, LWb - редко. Наибольшая частота антигена LWb зарегистрирована у латышей и литовцев, в связи с чем этот фактор относят к своеобразным балтийским маркерам (табл. 18.3) и его обнаружение в других популяциях, как полагают Sistonen и соавт. [55], отражает степень влияния прибалтийских народов.
У финнов частота генов, генотипов и фенотипов соответствует следующим величинам:
До обнаружения антител airra-LWb практически все индивиды с редким фенотипом LW(a-) выявлялись в связи с присутствием в сыворотке их крови анти-LW-антител. Посемейные исследования часто не подтверждали наследственную передачу гена ZJF(Race и Sanger [48], Beck [3], Giles [18]). Позднее было установлено, что LWa и LWb являются кодоминантными аллелями (Sistonen и соавт. [52, 54]) и не зависят от локуса RH (Levine и соавт. [35], Swanson и соавт.[60, 63], White и соавт. [67]). Обследование членов нескольких финских семей подтвердило это заключение.
Эксперименты по трансфекции кДНК LWа и LWb в клетки линии COS-7, выполненные Hermand и соавт. [21], показали, что моноклональные анти-LWab-aHTm^a более интенсивно реагируют с антигеном LW(a+), чем с антигеном LW(b+).
Фенотип LW(a-b-) крайне редкий. DeVeber и соавт. [14] исследовали эритроциты 10 552 канадцев с использованием сывороток aHTH-LWab и не нашли ни одного с фенотипом LW(a-b-). Миссис Big., первая женщина, у которой были выявлены анти-Ц\\^аЬ-антитела, и ее брат имели фенотип LW(a-b-). Эритроциты всех 5 ее детей реагировали с ее сывороткой (DeVeber и соавт. [14], Sistonen и Tippett [54]). Как установили Hermand и соавт. [23], фенотип миссис Big. был обусловлен делецией кодонов 86-89 в экзоне 1 гена LW9что приводило к синтезу укороченного протеина, лишенного трансмембранного и цитоплазматического домена.
Частота аллеля LWbу различных народов*
|
Популяция |
Количество обследованных |
Частота гена LWb |
|
Латыши |
677 |
0,059 |
|
Литовцы |
829 |
0,057 |
|
Эстонцы |
800 |
0,040 |
|
Финны |
6270 |
0,029 |
|
Русские (Вологодская область) |
383 |
0,022 |
|
Поляки (Польша и США) |
747 |
0,020 |
|
Шведы (Готланд) |
199 |
0,010 |
|
Шведы (Лунд) |
395 |
0,003 |
|
Венгры (Будапешт) |
421 |
0,004 |
|
Швейцарцы |
502 |
0,001 |
|
Бельгийцы (Льеж) |
211 |
|
|
Японцы (Осака) |
500 |
|
|
Африканцы (Сомали) |
1020 |
Антигены LW представляют собой гликопротеины с мол. массой около 40 кДа. Разрушение дисульфидных связей инактивирует вещество LW (Konigshaus, Holland [27]).
Ген LW картирован на коротком плече хромосомы 19 в позиции 19р13.3. Антигенный полиморфизм (LWa/LWb) обусловлен перемещением А 308 G в экзоне 1, что приводит к аминокислотной замене: глицин на аргинин в позиции 70 в первом IgSF-домене гликопротеина LW (Hermand и соавт. [21]).
Мол. масса гликопротеина, полученного посредством иммунопреципитации с использованием аллогенных анти-1ЖаЬ-антител (от миссис Big.), соответствовала 37-47 кДа (Mallinson и соавт. [38], Bloy и соавт. [5, 6], Moore [39]). Субстрат, полученный при использовании моноклональных анти-Ь\\^аЬ-антител, имел меньшую мол. массу - от 36 до 43 кДа.
Мол. масса гликопротеина снижалась до 2 и 17 кДа после обработки N- и О-гликаназами соответственно (Bloy и соавт. [5]). Добавление Ка2-ЭДТА.(три-лон Б) к эритроцитам ингибировало антигены LW (Bloy и соавт. [6]). Ионы Mg2+ восстанавливали активность антигенов LW, ионы Мп2+ и Са2+ были инертны.
Основываясь на результатах сравнительного исследования гликопротеина LW и протеина Rh с помощью химотриптического йодпептидного картирования, Bloy и соавт. [5, 7] высказали предположение, что гликопротеин LW может являться гликозилированной формой Rh-протеина или, иными словами, Rh-полипептид является субстанцией-предшественником гликопротеина LW. Протеин Rh с мол. массой 31 кДа преципитировался одновременно с гликопротеином LW, и это свидетельствовало, что указанные структуры эритроцитарной мембраны тесно связаны.
Bailly и соавт. [1] частично воспроизвели аминокислотную последовательность гликопротеина LW, что позволило создать олигонуклеотидные прайме-ры, исследовать к ДНК и установить, что кодируемый пептид имеет мол. массу 26,5 кДа. Кроличьи антитела к синтетическому пептиду, состоящему из 15 аминокислот, реагировали в непрямой антиглобулиновой пробе со всеми образцами эритроцитов за исключением LW(a-b-). Эритроциты D+ реагировали интенсивнее, чем эритроциты D-. Эритроциты D+LW(a-b+) давали слабовыраженные реакции.
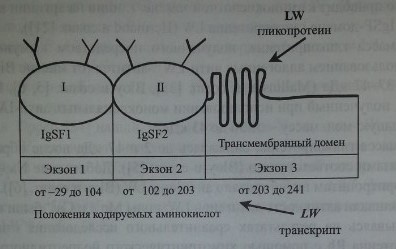
Аминокислотная последовательность протеина LW
Как показали Bailly и соавт. [1], Hermand и соавт. [21], ген LW кодирует протеин, включающий 271 аминокислоту (рис. 18.1), в том числе сигнальный пептид аминокислот, экстрацеллюлярный N-терминальный домен (208 аминокислот), трансмембранный гидрофобный домен (21 аминокислота) и С-терминальный цитоплазматический домен (12 аминокислот). Имеется четыре потенциальных участка N-гликозилирования: 38, 48, 160 и 191, которые занимает аспарагин. N-гликозилирование этих участков приводит к формированию.
Гликопротеин LW включает два IgSF-домена (рис. 18.2) и структурно связан с молекулами межклеточной адгезии ICAM-1, ICAM-2 и ICAM-3. Предложена трехмерная модель гликопротеина LW (Hermand и соавт. [22], Spring и соавт. [59]).
Ген LW имеет величину 2,65 кб, организован в виде трех экзонов (см. рис. 18.2) Экзон 1 кодирует нетранслируемую последовательность из 96 ко-донов, сигнальный пептид и первый IgSF-домен. Экзоны 1 и 2 отделены друг от друга интроном из 129 пар оснований. Еще один интрон (147 пар оснований) разделяет экзоны 2 и 3. Экзон 2 кодирует второй IgSF-домен. Экзон 3 кодирует трансмембранный и интрацеллюлярный домены и содержит в области У нетранслируемую последовательность. Промоторная область гена содержит участки, влияющие на экспрессию антигенов LW на других клетках
Строение гликопротеина LW и транскрипта гена LW
Система LW (Landsteiner - Wiener) получила статус самостоятельной групповой системы лишь в 1982 г., хотя фактически она была открыта в начале 40-х годов.
Первый образец aHTH-LW-антител получили Landsteiner и Wiener [28] путем иммунизации кроликов и морских свинок эритроцитами обезьян Macacus rhesus. По характеру реагирования (~ 85 % положительных результатов, 15 % отрицательных) эти ксеногенные антитела были близки аллогенным, которые годом раньше, в 1939 г., описали Levine и Stetson [36] (см. Система RH). Оба вида антител были обозначены как анти-Rh.
Однако уже в 1942 г. Fisk и Foord [16] показали, что антитела, вырабатываемые морскими свинками, отличаются от анти-Ю1-антител человека. Сыворотки морских свинок агглютинировали эритроциты практически всех новорожденных, в то время как с помощью анти-Шьантител аллогенного происхождения эритроциты новорожденных, так же как и взрослых, можно было разделить на Rh+ и Rh-. В 1952 г. Murray и Clark [40], иммунизируя морских свинок эритроцитами человека Rh+ и Rh-, получили антитела одинаковой специфичности. Аналогичные антитела были получены путем иммунизации животных экстрактами из эритроцитов Rh+ и Rh-.
Далее Levine и соавт. [30, 31] установили, что агглютинация эритроцитов ал-логенными сыворотками не блокировалась, если эритроциты были предварительно нагружены антителами, полученными от животных. Путем адсорбции - элюции антител было показано, что анти-Ш>подобные антитела, полученные от животных, связывались с Rh-отрицательными эритроцитами, хотя в прямых агглю-тинационных тестах они реагировали только с Rh-положительными клетками.
Race и Sanger [48] нашли у 2 Rh-отрицательных женщин антитела, похожие по специфичности на анти-Rh, однако последние легко адсорбировались Rh-отрицательными эритроцитами и тем самым демонстрировали aHTH-Rh-подобную специфичность, аналогичную специфичности антител, полученных от животных.
Поскольку обозначение Rh было дано резус-антигену, Levine и соавт. [35] предложили обозначить антиген, открываемый ксеногенными анти-Rh-подобными антителами, буквами LW в честь Landstainer и Wiener.
Антигены D и LW фенотипически очень близки, хотя и представляют собой разные системы. Некоторые образцы aHTH-LW-антител ошибочно идентифицировались как анти-D, и их можно было отличить только при использовании эритроцитов D+LW-, с которыми они не реагировали.
На эритроцитах D+ антиген LW выражен сильнее, чем на эритроцитах D-, у лиц Rh антигены LW отсутствуют (Levine и соавт. [35]).
Фенотипы LW+D+ и LW+D- Levine и Celano [32] обозначили как LWj и LW2.
Swanson и соавт. [60, 63] и DeVeber [14) показали, что aHTH-LW-антитела ге-терогенны, в связи с чем Beck [3] подразделил LW-отрицательные эритроциты на LW3 и LW4. Эритроциты LW3 не реагировали с aHTH-LW3-aHTm^aMH, но агглютинировались антителами, образовавшимися у лиц LW.. Эритроциты LW4 никакими сыворотками анти-LW не агглютинировались. и
Giles и соавт. [18, 19] нашли лиц с транзиторным фенотипом LW-, который трудно было отличить от LW3 и LW. jr
После обнаружения Sistonen и соавт. [51, 53] редко встречающегося антигена Nea система LW усложнилась.
Sistonen и Tippett [54] нашли, что антитела анти-Кеа и анти-LW, образовавшиеся у лиц LW3, выявляют антитетичные антигены. Это привело к изменению номенклатуры в системе LW: антиген, идентифицируемый сыворотками анти-LW от лиц LW3, получил обозначение LWa, антиген Nea - LWb, фенотип LW4 был переименован в LW(a-b-), антитела, продуцируемые индивидами LW4, названы aHra-LWab (табл. 18.1).
Таблица 18.1
Фенотипы и генотипы LW
|
Обозначение фенотипа |
Генотип |
Реакции с антителами |
||||
|
старое |
новое |
LWa |
LWb |
LWab |
||
|
LW+ |
LWj, LW2 |
LW(a+b-) LW(a+b+) |
LWa/LWa или LWVLW LWa/LWb |
+ + |
— |
+ + |
|
LW- |
LW3 |
LW(a-b+) |
LWb/LWb или LWb/LW |
— |
+ |
+ |
|
LW- |
4 |
LW(a-b-) |
LW/LW |
— |
— |
— |
|
LW О |
Rh .. null |
LW(a-b-) |
|
— |
— |
— |
При включении системы LW в номенклатуру ISBT принято решение отказаться от старых обозначений: LW1, LW2, LW3 и LW4, чтобы избежать путаницы, и заменить их новыми