Поиск по сайту
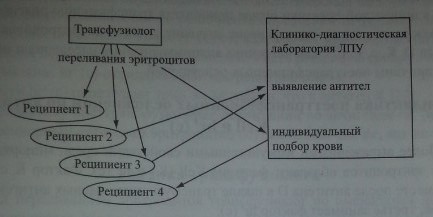
Перед переливанием эритроцитов трансфузиолог по имеющимся документам устанавливает фенотип реципиента по 10 трансфузионно опасным антигенам эритроцитов и, если таковые отсутствуют, организует или выполняет самостоятельно фенотипирование реципиента. Далее трансфузиолог устанавливает, к какой из четырех условных категорий относится реципиент (рис. 36.1). Если в анамнезе реципиента нет указаний на имевшиеся беременности и переливания эритроцитов, его относят к категории 1. У реципиентов этой категории наименьший риск посттрансфузионных осложнений.
У реципиентов, относящихся к категории 2 и 3, риск постгрансфузионного осложнения возрастает. В этом случае необходимо предварительно исследовать кровь реципиента на наличие антиэритроцитарных антител. Это исследование должен выполнять специалист иммуносеролог в специализированной лаборатории. Подбор эритроцитов реципиентам, в крови которых обнаружены антитела (реципиентам категории 4), проводит только специалист иммуносеролог в лабораторных условиях.
Подбор доноров реципиентам всех указанных категорий осуществляют с учетом идентичности по 10 трансфузионно опасным антигенам эритроцитов, однако последнее обстоятельство не освобождает трансфузиолога от выполнения обязательных иммуносерологических исследований непосредственно перед трансфузией: определения группы крови у донора и реципиента, выполнения проб на индивидуальную совместимость и биологической пробы.
Соблюдение перечисленных правил гарантирует иммунологическую безопасность трансфузии эритроцитов.
К теории протективного действия иммуноглобулина антирезус
Механизм феномена отмены аллоиммунизации резус-отрицательных рожениц резус-антигеном плода посредством инъекции им анти-Э-антител после Первых родов до сих пор не имеет удовлетворительного объяснения. Считается, та пассивно введенные антитела связывают резус-положительные эритроциты ребенка, попавшие в кровоток матери в процессе родов, и далее инициируют их быструю элиминацию ретикулоэндотелиальной системой, тем самым предотвращая аллоиммунизацию. Однако также хорошо известно, что агглютинирующая способность и титр резус-антител не коррелируют с их способностью предупреждать аллоиммунизацию. Подавляющее большинство серий монокло-нальных антител, имеющих высокую авидность и огромный титр, протекторными свойствами не обладает.
Обращает на себя внимание тот факт, что при первичной иммунизации и ре-иммунизации титр антител варьирует в широких пределах. У одних людей он низкий, у других - чрезвычайно высокий.
В наших исследованиях (И.С. Липатова, СИ. Донсков [15]) при реиммуниза-ции сенсибилизированных лиц также отчетливо прослеживались колебания титра антител (табл. 36.2).
Таблица 36.2 Уровни антителообразования при реиммунизации антигеном D
|
Число инъекций |
Количество доноров |
Количество доноров, имевших уровень антител |
|||
|
низкий |
средний |
высокий |
сверхвысокий |
||
|
1 |
19 |
5 |
10 |
4 |
|
|
2 |
26 |
5 |
5 |
8 |
8 |
|
3 |
27 |
3 |
5 |
8 |
11 |
|
всего |
72 |
13(18%) |
20 (27,8 %) |
20 (27,8 %) |
19(26,4%) |
Изменения титра оценивали по количеству ступеней разведения сыворотки. Высоту иммунного ответа можно было условно разделить на 4 уровня:
сверхвысокий - повышение титра на 7 ступеней и более (1 : 512-1 : 8192); высокий - повышение титра на 5-6 ступеней (до 1 : 256); средний - повышение титра на 3-4 ступени (до 1 : 128); низкий - повышение титра на 1-2 ступени (до 1 : 32).
Неодинаковое повышение титра антител у аллоиммунизированных позволяет высказать предположение о существовании в организме человека специализированной индикаторной системы, контролирующей уровень (определяющей достаточность) антителообразования. Вырабатывающиеся антитела, по-видимому, содержат определенный сигнальный фрагмент, который приостанавливает их синтез (сигнализирует о его достаточности). У одних людей эти сигнальные фрагменты формируются в молекуле антител раньше (либо более активны), в результате чего синтез антител останавливается на относительно низком уровне, объем продукции антител небольшой, и последующая антигенная стимуляция не дает ожидаемого повышения титра. У других людей указанный сигнальный фрагмент формируется позднее, менее активен или вовсе не формируется. В этом случае антителообразование не ограничено, объем продукции
антдаея большой, и титр антител достигает высоких разведений. Не исключено, Щ именно этот механизм регуляции антителообразования лежит в основе предупреждения аллоиммунизации резус-отрицательных родильниц инъекцией им анти-О-антител.
Моноклональные антитела в отличие от поликлональных не обладают способностью предупреждать аллоиммунизацию резус-антигеном. Очевидно, МКА не содержат сигнальных фрагментов, отменяющих аллоиммунизацию. При получении МКА выбирают клоны, вырабатывающие высокоавид-ные антитела с высоким титром, наиболее пригодные для определения резус-антигена в серологических реакциях. Клоны, вырабатывающие антитела с низким титром, выбраковывают. Не исключено, что параллельно с антителами вырабатывается протеин с сигнальной вставкой - стоп-сигналом. Он не является антителом, но сопутствует антителам и является тем стоп-сигналом, который останавливает синтез антител. Этот протеин также выбраковывают. По-видимому, именно с этой выбраковкой связана неэффективность применения МКА анти-D в акушерской практике.
Можно с высокой степенью вероятности полагать, что способность антител реагировать invitroв серологических реакциях и способность препаратов, содержащих антитела, предотвращать аллоиммунизацию invivo- два разных свойства, присущих препаратам, содержащим антитела. Оба свойства не связаны друг с другом и не являются пропорциональными. Протекторное действие антител не усиливается параллельно увеличению их авидности и титра. Скорее, наоборот, антитела с высоким титром, в том числе МКА, в меньшей степени проявляют (или вовсе не проявляют) протективный эффект, в то время как поликлональные антитела, имеющие существенно более низкий титр, чем МКА, тормозят запуск иммунного ответа. Не исключено также, что антитела и протеин, несущий сигнальную вставку, - разные белки, одновременно присутствующие в поликлональном препарате. В моноклональных антителах протеин, несущий сигнальную вставку, отсутствует.
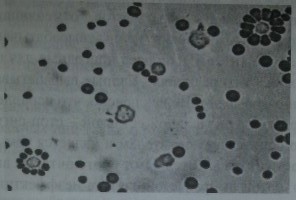
По-видимому, можно выделить два типа резус-антител: серологически высокоактивные, но не препятствующие запуску иммунного ответа на резус-антиген invivo, и серологически не столь активные, но отменяющие иммунный ответ invivo. Пока нет методических подходов, позволяющих с помощью серологических методов различить антитела, имеющие и не имеющие указанной выше сигнальной вставки - стоп-сигнала. Вместе с тем некоторые заделы в этом направлении имеются. В частности, обращает на себя внимание поведение нормальных лимфоцитов человека в реакции розеткообразования (рис. 36.2) с ал-логенными эритроцитами, нагруженными анти-Б-антителами (СИ. Донсков, Е.А. Зотиков [12]). Обработка эритроцитов одними образцами резус-антител приводила к розеткообразованию, в то время как обработка этих же эритро-ЩШъ другими образцами резус-антител, не отличавшимися по активности, не инициировала розеткообразования.
Розеткообразование ингибировалось сыворотками против имму-рйяюбулинов человека, что свидетельствовало о зависимости этой реакции от иммуноглобулиновых рецепторов, имеющихся на поверхности В-клеток и способных, как известно, реагировать с Fc-фрагментом 78-иммуноглобулинов, а также комплексом антиген - антитело.
Два типа розеткообразующих клеток человека.
Вверху справа — лимфоцит, образовавший розетку с эритроцитами, сенсибилизированными неполными резус-антителами (В-лимфоцит), внизу слева - лимфоцит, образовавший розетку с эритроцитами барана (Т-лимфоцит).
Следует еще раз подчеркнуть, что не все сыворотки, содержащие неполные резус-антитела, способны инициировать аллогенное розеткообразование. По этому свойству они могут быть разделены на две группы: розеткообразую-щие ирозетконеобразующие.
Способность резус-антител вызывать прилипание лимфоцитов не была связана с принадлежностью сыворотки к какой-либо из групп системы АВО, не зависела от антигенов Gma и Gmb, а также от пола и возраста лиц, от которых были получены антитела. Розеткообразование усиливалось, если эритроциты нагружали несколькими антителами.
Не установлено, как соотносится розеткообразующая способность антител с их протекторным действием и нельзя ли по розеткообразующим свойствам aHTH-D-антител детектировать их способность отменять аллоиммму-низацию?
Следует выделить два организационных принципа обеспечения иммунологической безопасности переливания эритроцитов:
- подбор донора, идентичного реципиенту по 10 трансфузионно опасным антигенам: А,В, D, с, Е, С, е, Cw,Кик;
- определение предсуществующих антиэритроцитарных антител у всех больных и доноров независимо от их групповой и резус-принадлежности.
Под идентичностью в рассматриваемом случае понимают не только полное соответствие (тождество) донора и реципиента по указанным антигенам, но и другие, нетождественные, комбинации, при которых донор не имеет антигенов, отсутствующих у реципиента (табл. 36.1).
Таблица 36.1 Подбор доноров, идентичных с реципиентами по системе Rh, для трансфузии эритроцитов
|
Реципиент |
|
|
Донор |
|
|
||
|
идентичный |
2-й очереди |
3-й очереди |
|||||
|
фенотип |
частота, % |
фенотип |
частота, % |
фенотип |
частота, % |
фенотип |
частота, % |
|
|
|
CcDee |
31,9 |
|
|
|
|
|
|
|
CCDee |
16,8 |
CcDEe |
13,7 |
|
|
|
CcDee |
31,93 |
ccddee |
12,7 |
ccDEe |
11,8 |
|
|
|
|
|
ccDee Ccddee |
2,2 1,5 |
CCDEe |
0,1 |
|
|
|
CCDee |
16,81 |
CCDee |
16,8 |
CcDee |
31,9 |
CcDEe |
13,7 |
|
|
|
CCddee |
0,03 |
Ccddee |
1,5 |
CcddEe |
0,4 |
|
CcDEe |
13,69 |
|
любой фенотип кроме Cw+ |
|
|||
|
ccddee |
12,71 |
ccddee |
12,7 |
Ccddee |
1,5 |
ccddEe |
од |
|
|
|
ccddee |
12,7 |
CcDee |
31,9 |
|
|
|
|
|
ccDEe |
11,8 |
CcDEe |
13,7 |
|
|
|
ccDEe |
11,82 |
ccDee |
2,2 |
Ccddee |
1,5 |
|
|
|
|
|
ccDEE ccddEe |
2,5 0,1 |
CcddEe |
0,4 |
|
|
|
CwCDee |
2,6 |
CwCDee |
2,6 |
CCDee |
16,8 |
CwcDee |
2,4 |
|
ccDEE |
2,49 |
ccDEE ccddEE |
2,5 |
ccDEe CcDEE |
11,8 0,04 |
CcDEe |
13,7 |
|
CwcDee |
2,38 |
CwcDee |
2,4 |
CcDee CCDee CwCdee |
31,9 16,8 2,6 |
|
|
|
ccDee |
2,21 |
CcDee |
2,2 |
CcDee |
31,9 |
ccDEe |
11,82 |
|
|
|
ccddee |
12,7 |
Ccddee |
1,5 |
CcddEe |
0,4 |
|
Ccddee |
1,54 |
Ccddee ccddee CCddee |
1,5 12,7 0,03 |
ccddEe |
0,1 |
CcddEe |
0,4 |
|
CwcDEe |
1,23 |
CwcDEe |
1,2 |
CcDee |
31,9 |
|
|
|
|
|
ccDEe ccddee |
11,8 12,7 |
CcDEe |
13,7 |
|
|
|
ccDuee |
<1 |
ccDuee ccddee |
<1 12,7 |
Ccddee |
1,5 |
ccddEe |
0,07 |
|
CcddEe |
0,4 |
ccddee Ccddee CcddEe ccddEe |
12,7 1,5 0,4 0,1 |
|
|
|
|
|
|
|
CCddee |
0,03 |
|
|
|
|
Окончание табл. 36.1
|
Реципиент |
|
|
Донор |
|
1—~ |
||
|
идентичный |
2-й очереди |
3-й очереди |
|||||
|
фенотип |
частота, % |
фенотип |
частота, % |
фенотип |
частота, % |
фенотип |
частота, % |
|
CCDEe |
0,1 |
CCDEe CCDee CCddee |
0,1 16,8 0,03 |
CcDee CcDEe |
31,9 13,7 |
|
|
|
ccddEe |
0,1 |
ccddEe ccddEE ccddee |
0,07 12,7 |
Ccddee CcddEe |
1,5 0,4 |
|
|
|
CcDEE |
0,04 |
CcDEE ccDEE ccddEE |
0,04 2,5 |
CcDEe CcddEe ccddEe |
13,7 0,3 0,1 |
|
|
|
Cwcddee |
0,04 |
Cwcddee ccddee |
0,04 12,7 |
Ccddee |
1,54 |
ccddEe |
0,07 |
|
CCddee |
0,03 |
CCddee |
0,03 |
Ccddee |
1,5 |
CcddEe |
0,4 |
|
CCDEE |
0,00 |
CCDEE |
0,00 |
CCDEe CCDee |
0,1 16,8 |
Ccddee |
1,5 |
|
CCddEe |
0,00 |
CcddEe CCddee |
0,35 0,03 |
Ccddee |
1,5 |
ccddee |
12,7 |
|
CcddEE |
0,00 |
CcddEE ccddEE |
0,00 0,00 |
CcddEe ccddEe |
0,4 0,1 |
|
|
|
IccddEE |
0,00 |
ccddEE |
0,00 |
ccddEe |
0,1 |
CcddEe |
0,4 |
|
I CCDuee |
|
CCDuee CCddee |
0,03 |
CcDuee CcDee Ccddee |
31,9 1,5 |
ccddee |
12,7 |
|
CcDuee |
|
CcDuee CCDuee ccDuee |
|
Ccddee ccddee |
1,5 12,7 |
|
|
|
ccDuEe |
|
ccddee ccddEe ccDuEe |
12,7 0,4 |
Ccddee CcddEe |
1,5 0,4 |
|
|
|
ccDuEE |
|
ccDuEE ccddEe ccddEE |
0,4 |
CcddEe |
0,4 |
|
|
|
CwcddEe |
|
ccddee ccddEe CwcddEe |
12,7 0,1 |
Ccddee CcddEe |
1,5 0,4 |
|
|
|
CwcDEE |
|
CwcDEE ccDEE ccddEE |
2,5 |
CcDEe |
13,7 |
CcddEe |
0,4 |
кде чем приступать к иммуносерологическому исследованию донора и реципиента (определению группы крови, резус-фактора и других трансфузион-но опасных антигенов эритроцитов), необходимо знать индекс аллоиммуниза-ции населения в регионе.
Обеспечение иммунологической безопасности переливания эритроцитов (тактика трансфузиолога).
Условные обозначения: реципиент
- 1 -нетбеременностей/трансфузий,
- 2 — есть беременности/трансфузии (без реакций, антител нет),
- 3 - есть беременности/трансфузии (с реакциями, антител нет),
- 4 — есть беременности/трансфузии (без реакций/с реакциями, антитела есть)
Чрезвычайно важен сбор анамнестических сведений о реципиенте, особенно если это женщина: имелись ли беременности, гемотрансфузии, их количество, как закончились (с осложнениями или без таковых), выявлялись ли ранее антиэ-ритроцитарные антитела, в том числе у членов семьи и близких родственников, общие сведения о семье. Нередко ценную информацию дают сопровождающие больного родственники. Указанные сведения помогают не только уточнить степень риска посттрансфузионного осложнения, но и фактически избежать его. Недоучет, игнорирование анамнестических сведений о реципиенте, являются ошибкой трансфузиолога.
Система обеспечения иммунологической безопасности переливания эритроцитов имеет две составляющие - производственную и клиническую иммуно-серологию. Структура производственной иммуносерологии представлена профильными лабораториями и техническими группами коммерческих организаций, станций и отделений переливания крови и контролирующими организациями Министерства здравоохранения и социального развития РФ. Их функция - производство и контроль качества иммуносерологических реактивов. Клиническая иммуносерология представляет собой сферу применения иммуносерологических реактивов для определения группы крови, резус-фактора и других антигенов эритроцитов, проведения проб на индивидуальную совместимость крови донора и реципиента непосредственно в клинике.
Ошибки, обусловленные некачественными тестовыми реактивами, при существующей системе производства практически исключены. Источником ошибок является сфера клинической иммуносерологии. До недавнего времени переливание крови относили к простым процедурам, которые может выполнять любой врач. Однако, как показала практика, у врача, переливающего кровь от случая к случаю, не закрепляются необходимые для трансфузиолога и иммуносеролога профессиональные навыки. В связи с этим первый принцип обеспечения безопасности гемотранс-фузии: иммуносерологические исследования и переливание эритроцитов должны выполнять профессионально подготовленные специалисты.
Ошибки при определении групп крови
Во избежание ошибок при определении групповой- и резус-принадлежности крови необходимо четко знать их источники. Ошибки возникают при нарушении техники выполнения исследования и в случаях трудноопределяемых групп крови [7].
Технические ошибки:
- Порядок расположения реагентов.
- Соотношение ингредиентов реакции.
- Температурные условия.
- Продолжительность наблюдения.
- Выпадение фибрина.
- Агглютинация, маскированная гемолизом.
- Неправильная запись.
Ошибки, обусловленные биологическими особенностями исследуемой крови (трудноопределяемые группы крови):
- Подгруппы крови.
- Неспецифическая агглютинация.
- Агглютинация, обусловленная другими антителами.
- Особенности групп крови новорожденных.
- Кровяные химеры.
- Другие особенности.
Технические ошибки
Порядок расположения реагентов. Если нарушен порядок расположения реагентов в штативе или на пластинке, то при правильной оценке результата с каждой отдельно взятой сывороткой можно сделать неправильное заключение о групповой и резус-принадлежности исследуемой крови. Поэтому каждый раз при определении группы крови следует проверить расположение реагентов, а также визуально оценить их качество, исключив использование помутневших, подсохших реагентов и с истекшим сроком годности.
Соотношение ингредиентов реакции. Оптимальное для реакции агглютинации соотношение эритроцитов и тестовых реагентов 1 : 10 при использовании гемагглютинирующих сывороток и 2-3 : 10 при использовании моноклональ-ных реагентов и реагентов, приготовленных в комбинации с коллоидами.
Как при избытке, так и при недостаточном количестве эритроцитов агглютинация появляется медленно и может быть не замечена, особенно в тех случаях, когда агглютинационные свойства эритроцитов снижены (подгруппа А2, эритроциты Du).
Температурные условия. Определение группы крови производят при температуре не ниже 15 °С, поскольку исследуемая кровь может содержать поливалентные холодовые агглютинины, вызывающие неспецифическое склеивание эритроцитов при пониженной температуре (холодовая агглютинация).
При повышенной температуре (более 25 °С) антитела анти-А, анти-В и анти-АВ реагируют менее активно, чем при комнатной температуре (22 °С), поэтому определение группы крови производят при температуре не выше 25 °С. Нарушение температурных условий при определении группы крови может привести к искажению результатов.
Продолжительность наблюдения. Агглютинация эритроцитов появляется в течение 10-30 сек., однако наблюдение за ходом реакции следует проводить не менее 5 мин, внимательно следят за теми каплями, в которых агглютинация не появилась. Это позволяет выявить слабые агглютиногены А2 и Du, характеризующиеся замедленной агглютинацией. Длительное выдерживание проб на пластинке приводит к их подсыханию и появлению в зоне подсыхания агрегатов эритроцитов, вследствие чего создается ошибочное впечатление положитель-»ой реакции. В сомнительных случаях исследование повторяют.
Выпадение фибрина. При исследовании свежей цельной крови, взятой без антикоагулянта, иногда происходит ее свертывание, что в некоторых случаях затрудняет учет результата. Капля приобретает желеобразную консистен цию, плохо перемешивается при покачивании пластинки. Выпадение фибри на особенно выражено в том случае, если пластинку, на которую помещена реагирующая смесь, слишком долго оставляют лежать на столе не покачивая.
Выпадение фибрина может быть связано с особенностями свертывающей си стемы крови обследуемого, а также с избытком хлорида кальция в тестовых сыворотках, если они были приготовлены из плазмы крови путем дефибринирования указанным препаратом. При внимательном рассмотрении легко различить белесоватые нити и глыбки фибрина, между которыми концентрируются эритроциты, имитируя мелкозернистую агглютинацию. Для получения четких результатов исследование крови выполняют заново, используя для этого тестовые реактивы, приготовленные из нативных сывороток, или моноклональные антитела. В случае возникновения сомнений следует дождаться полного свертывания крови в пробирке, после чего использовать для исследования так называемую третью фракцию эритроцитов (осадок эритроцитов на дне пробирки, не вовлеченных в сгусток) или заготовить исследуемую кровь с антикоагулянтом.
Агглютинация, маскированная гемолизом. Сыворотки крови отдельных лиц содержат активные гемолизины анти-А (реже анти-В), которые могут лизиро-вать стандартные эритроциты до начала агглютинации, что создает впечатление отсутствия последней. Гемолиз предотвращают путем разведения сыворотки изотоническим раствором натрия хлорида или посредством непродолжительного прогревания ее при температуре 56 °С.
Имеют место случаи, когда вместо изотонического раствора в смесь сыворотки и эритроцитов ошибочно добавляют воду, предназначенную для промывания пипеток, что также вызывает лизис как неагтлютинированных, так и агглютинированных эритроцитов. Ошибку распознают по внешнему виду реагирующей смеси, которая на глазах из красной опалесцирующеи взвеси превращается в прозрачную алую жидкость («лаковая» кровь).
Неправильная запись. При правильном определении групповой принадлежности крови результат исследования может быть неверно записан или неверно перенесен из одного документа в другой.
Подгруппы крови. Антиген А (редко В) представлен двумя вариантами (подгруппами) - Aj и А2. Эритроциты А2 отличаются от эритроцитов А, сниженной агглютинационной способностью (слабой агглютинабельностью) по отношению к антителам анти-А. В клинической трансфузиологии подгруппы крови значения не имеют, поэтому при переливании эритроцитов их не учитыва-Н Лицам, имеющим антиген А2, можно переливать эритроциты А,, лицам, имеющим антиген А,, | эритроциты А2. Исключение составляют реципиенты, реющие экстраагглютинины а, и а2. Эти антитела не вызывают посттрансфу-зйонных осложнений, однако проявляют себя в пробе на индивидуальную совместимость на плоскости при комнатной температуре. В частности, сыворотка реципиента А^р агглютинирует эритроциты А, на плоскости или в пробирках при комнатной температуре, поэтому реципиентам А2а,р (II) переливают совместимые эритроциты 0(1), реципиентам A2Ba](IV) - совместимые эритроциты В(Ш) или 0(1). Существуют и другие варианты слабого антигена A: Aint, A3, А4, Ах, Afinn, Aend, характеризующиеся еще более слабой агглютинабельностью (см. Системы АВО и НИ).
При наличии у реципиента слабовыраженного антигена Du последний может быть не выявлен экспресс-методами определения резус-фактора, поскольку тестовые реагенты, приготовленные на основе коллоидных растворов, плохо выявляют Du, моноклональные реагенты IgM, высокоактивные в отношении антигена D, антиген Du не выявляют. Такие ошибки не приводят к посттрансфузион-ным осложнениям, так как реципиенту переливают резус-отрицательную кровь. Они обнаруживаются, когда больной поступает в другое лечебное учреждение, где определение резус-фактора производят специалисты иммуносерологи в лабораторных условиях с использованием других методов.
Неспецифическая агглютинация. В основе неспецифической агглютинации эритроцитов, образования монетных столбиков, лежат определенные специфические механизмы. Клеточные суспензии, в особенности эритроцитов, лейкоцитов, тромбоцитов, как физическое состояние весьма нестабильны: клетки быстро оседают, легко агрегируются. Присоединение антител изменяет электрический заряд эритроцитов, нарушает их суспензионную стабильность. Последняя нарушается под действием не только антител, но и целого ряда других факторов: белкового и солевого состава среды, состояния свертывающей системы крови, гормонального статуса.
В практической работе неспецифической называют неожидаемую, атипичную агглютинацию, несвойственную конкретной групповой антигенной системе. О неспецифической агглютинации судят на основании способности эритроцитов агглютинироваться сыворотками всех групп, включая AB(IV). Неспецифическая агглютинация наблюдается при аутоиммунной гемолитической анемии и других аутоиммунных заболеваниях, сопровождающихся адсорбцией аутоантител или компонентов комплемента на эритроцитах, при гемолитической болезни новорожденных, эритроциты которых нагружены ал-лоантителами матери. Видимость агглютинации могут создавать т. н. «монетные столбики». Невооруженным глазом их трудно отличить от истинной агглютинации. Если каплю эритроцитов, смешанную экстемпоре с сывороткой поместить под микроскоп, можно наблюдать, как эритроциты складываются ШШшетные столбики, которые быстро увеличиваются в длине и агрегируют от истинной агглютинации, при которой агрегация эритроцитов тотчас после перемешивания с сывороткой, минуя стадию монетных ешябиков.
При наличии неспецифической агглютинации эритроцитов с тестовыми реагентами анти-А, анти-В, анти-D и другими необходимо провести пробу со стандартной сывороткой AB(IV), не содержащей антител, и изотоническим раствором натрия хлорида. В противном случае кровь реципиента может быть ошибочно отнесена к группе AB(IV)Rh+, что повлечет за собой неправильный выбор донора. Неспецифическое склеивание эритроцитов, как правило, нестойкое. После добавления 1-2 капель изотонического раствора и покачивания пластинки неспецифические агрегаты распадаются. Однако наблюдаются случаи, когда неспецифическая агглютинация не устраняется ни при добавлении изотонического раствора, ни при многократном отмывании эритроцитов теплым изотоническим раствором (см. Панагглютинация).
В том случае, если из-за неспецифической агглютинации эритроцитов группу крови больного установить не удается, заключение о групповой принадлежности крови не выдают, образец крови направляют в специализированную лабораторию, а больному по жизненным показаниям переливают эритроциты группы 0(1).
В основе неспецифической агглютинации могут лежать разные механизмы. Феномен Томсена. Сущность этого феномена заключается в том, что эритроциты (независимо от групповой принадлежности) хранившиеся при комнатной температуре в течение суток или более и до того не проявлявшие склонности к неспецифическим реакциям, начинают агглютинироваться всеми тестовыми сыворотками, включая сыворотку AB(IV) и собственную. Подобное реагирование может привести к неправильному заключению при определении групповой и резус-принадлежности крови. Все исследуемые образцы эритроцитов, в том числе эритроциты группы 0(I)Rh-, могут быть отнесены к AB(IV)Rh+.
Феномен Томсена чаще наблюдают с отмытыми эритроцитами, чем с эритроцитами, хранящимися в плазме или сыворотке. Он обусловлен попаданием во взвесь эритроцитов коринобактерий, кишечной палочки, протея, микроорганизмов, содержащихся в аэропланктоне. Бактерии, выделяя биологически активные вещества, вызывают ферментативный процесс в эритроцитах, в результате которого высвобождаются скрытые до этого антигенные рецепторы. Основанием для такого заключения послужили эксперименты с эритроцитами, обработанными протеолитическими ферментами животного, растительного и бактериального происхождения (трипсин, папаин, протелин и др.).
В настоящее время выделена система антигенов Т-Tn, которые активируются протеолитическими ферментами (Тп-активация). Антигены Тп присутствуют на эритроцитах большинства людей, так же как в сыворотке крови большинства людей содержатся анти-Тп-антитела. Посттрансфузионных осложнений Тп-.щгатела не вызывают, однако могут исказить результат определения групповой принадлежности крови реципиента, что может привести к этому осложнению.
Панагглютинация. Неспецифическая агглютинация наблюдается не только с эритроцитами, трансформированными бактериальной флорой, как при феномене Томсена. Сыворотки крови, как выдержанные стандартные, так и свежеза-готовленные от пациента, могут неспецифически агглютинировать свежие не-контаминированные эритроциты. Это явление получило название панагглютинация. Различают несколько типов панагглютинации по Н.И. Блинову [1].
Первый тип - полная панагглютинация, когда сыворотка пациента агглютинирует стандартные эритроциты всех групп и свои собственные, а эритроциты пациента агглютинируются всеми стандартными сыворотками. В этих случаях группу крови и резус-фактор определить обычным способом без специальных приемов невозможно.
Второй тип - неполная панагглютинация, когда сыворотка пациента агглютинирует стандартные эритроциты всех групп и свои собственные, а эритроци-mJ пациента специфически агглютинируются стандартными сыворотками. При этом исследование эритроцитов дает четкие результаты, а перекрестная проба и проба на индивидуальную совместимость дает ложноположительные результаты, на которые нельзя ориентироваться.
Третий тип - эритроциты пациента, как при феномене Томсена, агглютинируются всеми сыворотками, включая собственную, а сыворотка пациента специфически реагирует со стандартными эритроцитами.
Панагглютинацию второго и третьего типов называют также аутоагглютина-цией, поскольку и в первом, и во втором случае эритроциты агглютинируются собственной сывороткой. Аутоагглютинация иногда легко обнаруживается без проведения иммуносерологического исследования - при осмотре пробирки, в которую взята кровь пациента. На стенках пробирки видны характерные потеки агглютинатов. В таких случаях, как правило, аутоагглютинация наблюдается в изотоническом растворе натрия хлорида.
Панагглютинация, как и другие проявления неспецифической агглютинации, не имеет закономерной связи с какой-либо определенной патологией. Она может сопутствовать септическим состояниям, циррозу печени, кахексии, ожоговой болезни, нефрозонефриту. Панагглютинация отмечается у больных, которым в процессе реанимации проведена интенсивная трансфузионно-инфузионная терапия: перелиты эритроциты, плазма, коллоидные растворы, введены гормоны, транквилизаторы, антигистаминные препараты. Сыворотка крови таких пациентов нередко представляет собой желатинизированный сгусток и дает атипичные реакции, что должно сразу же насторожить лаборанта.
Агглютинация, обусловленная другими антителами. При определении группы крови перекрестным методом могут быть получены противоречивые результаты, если в исследуемой крови содержатся, помимо изогемагглютининов а и В антитела анти-М, анти-N, анти-Lewis, анти-Н. Эти антитела искажают результаты исследования сыворотки реципиента со стандартными эритроцита-Н Необходимо помнить, что заключение о группе крови реципиента делают на основании исследования его эритроцитов. По сыворотке реципиента группу крови не устанавливают.
Особенности групп крови новорожденных. У некоторых новорожденных в отличие от взрослых антигены А и В на эритроцитах выражены слабее, а соответствующие агглютинины в сыворотке крови могут отсутствовать, что создает трудности при определении группы крови перекрестным методом. Гетерогенные тестовые реагенты, полученные от животных, могут агглютинировать эритроциты новорожденных независимо от их групповой и резус-принадлежности. Аллогенные тестовые сыворотки при определении групповой и резус-принадлежности новорожденных таким свойством не обладают. Резус-фактор выражен у новорожденных, как и у взрослых.
Причиной ошибок могут быть кровяные химеры (см. Кровяные химеры).
Другие особенности. Определение группы крови АВО и резус-принадлежности может быть затруднено в связи с изменением свойств эритроцитов при различных патологических состояниях. Это выражается в повышенной агглютинабельности эритроцитов, наблюдаемой, как уже отмечалось, у больных циррозом печени, при ожоговой болезни, сепсисе. Агглютинабельность может быть столь высока, что эритроциты склеиваются в собственной сыворотке и изотоническом растворе нартия хлорида. При лейкозах наблюдается снижение агглютинабельности эритроцитов, в результате чего значительное их количество остается не вовлеченным в агглютинацию даже при использовании высокоактивных реагентов (ложная кровяная химера).
Во избежание ошибок при выполнении иммуносерологических исследований необходимо быть предельно сосредоточенным и неукоснительно следовать предписаниям инструкции.
В случае сомнительного результата необходимо повторить исследование, используя дополнительно стандартные реагенты других серий. Если результаты этого исследования также вызывают сомнения, образец крови направляют на исследование в специализированную лабораторию.