Moore и соавт. [115], используя методы иммунопреципитации, установили, что антиген Fya присутствует на 3 протеинах, имеющих мол. массу 39, 64 и 85 кДа. Иммуноблоттинг с антителами анти-Fy* позволил выявить структуры с мол. массой 35 - 43 (Hadley и соавт. [60]) и 40-50 кДа (Tanner и соавт. [156]). Субстрат, выделенный электроэлюцией из протеинов 35-43 кДа, ингиби-ровал антитела анти-Fy3 [60]. Аналогичные результаты получили Nichols и соавт. [124], Riwom и соавт. [140], использовавшие иммуноблоттинг с монокло-нальными антителами анти-Руб.
Обработка эритроцитов эндо-Р-гликаназой, N-гликаназой и сиалидазой снижала мол. массу выделяемых с помощью иммуноблоттинга Fy-гликопротеинов до 4 кДа (Hadley и соавт. [60], Tanner и соавт. [156]).
Riwom и соавт. [140] и Wasniowska и соавт. [172] выделили низкомолекулярные фракции из очищенных Fy-гликопротеинов и третичных структур, полученных из них. Указанные исследования свидетельствовали о том, что Fy-гликопротеины N-гликозилированны и слабо О-гликозилированы. Разная степень N-гликозилирования, вероятно, и обусловливает колебания мол. массы Fy-гликопротеинов в широком диапазоне (Chaudhuri и соавт. [30]).
Chaudhury и соавт. [30] посредством иммунопреципитации моноклональны-ми антителами анти-Руб выделили Fy-гликопротеин с мол. массой 36-43 кДа вместе с олигомерами большей мол. массы, последние также реагировали с указанными антителами. Другие из сопутствующих протеинов не реагировали в реакции иммунного окрашивания с антителами анти-Руб. Картирование пептидов, выделенных из эритроцитов Fy(a+b-) и Fy(a-b+), существенных различий не выявило (рис. 10.2).

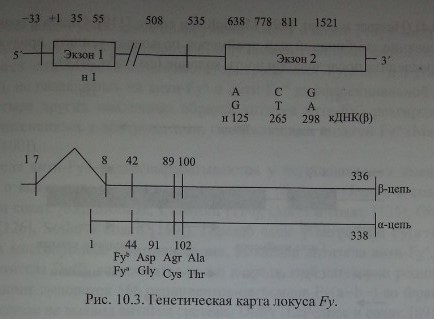
Chaudhury и соавт. [28], изучив последовательность аминокислот в очищенных Duffy-гликопротеинах, сконструировали олигонуклеотидные прай-меры и с помощью ПЦР изменили кодирующий участок ДНК, полученной от лиц Fy(a-b+). Затем этот продукт был использован для выделения кодирующей ДНК из библиотеки ДНК костномозговых клеток человека. В результате исследования получен пептид из 338 аминокислот с мол. массой 35,7 кДа (рис. 10.3).
Neote и соавт. [123] установили, что Fy-гликопротеин структурирован в виде а-спиралей, 7 раз пересекающих мембрану эритроцитов, имеет экстрацеллюлярный N- и цитоплазматический С-домены (см. рис. 10.1). Такое строение свойственно хемокиновым рецепторам (Л и соавт. [81], Murdoch, Finn [120]). Экстрацеллюлярный домен, состоящий из 65 аминокислот, имеет 3 участка N-гликозилирования - позиции 16, 27 и 33. Антитела анти-Руб реагировали с синтетическим пептидом, представляющим собой фрагмент N-терминального домена Fy-гликопротеина.
Первая из полученных образцов Duffy кДНК была представлена одним эк-зоном (Chaudhuri и соавт. [29], Iwamoto и соавт. [79], Tournamille и соавт. [160]).
Позднее Iwamoto и соавт. [77] показали, что в неэритроидных тканях преобладают транскрипты, состоящие из двух экзонов, разделенных 479 парами кодонов. Первый экзон кодирует семь N-терминальных аминокислот Fy-гликопротеина, включая инициирующий трансляцию метиониновый кодон. Терминальный участок молекул Fy-гликопротеина представлен последовательностью MGNCLHRAEL (Iwamoto и соавт. [77]).
В регионе 5! гена FY нет ТАГА- и СААТ-боксов, однако имеется несколько участков SP1 и GATA, препятствующих транскрипции (Iwamoto и соавт. [79], Tournamille и соавт. [160]).