Поиск по сайту
Долгое время химическая структура антигенов Rh оставалась загадкой. Многочисленные попытки выделить этот антиген в чистом виде и проверить его серологические свойства резус-антителами были безуспешными. Высказывалось суждение о том, что этот антиген в серологически активном виде не может существовать вне клеточной мембраны и, будучи выделенным из нее, тотчас инакти-вируется. Такое мнение поддерживалось сведениями о том, что нагревание и высушивание эритроцитов снижают серологическую активность антигенов Rh.
Разработка адекватных методов исследования гидрофобных структур мембраны эритроцитов дала существенный сдвиг в этой области. Появились сообщения Green [316] о том, что экспрессия антигенов D и С на эритроцитах связана с тиоловыми группами, и, следовательно, эти антигены по своей природе относятся к белкам, а не к полисахаридам, как считали раньше по аналогии с полисахаридами А и В.
Использование глутатионмалеимидмембранных зондов также указывало на причастность экзофациальных тиоловых групп к D-специфичности. Однако значение свободных тиоловых групп в формировании антигенов Rh было поставлено под сомнение Suyama и соавт. [646].
Далее было показано (Green [315]), что липидные фракции, экстрагированные из стромы эритроцитов n-бутанолом, а также получаемый при этом нерастворимый белковый осадок не обладают серологической активностью по отдельности, но при объединении этих фракций специфическая D-активность субстрата вновь проявляется. Таким образом, стала проясняться белково-липидная природа субстанции Rh.
Hughes-Jones и соавт. [366] подтвердили, что основными компонентами, необходимыми для экспрессии антигена D, являются фосфолипиды, поскольку обработка мембран эритроцитов фосфолипазами А2 и С инактивировала антигены D, Сс и Ее. Интересная деталь: как было установлено Hughes-Jones и соавт. [366], Green и соавт. [320], анти-Э-антитела, адсорбированные на эритроцитах D+, предотвращали инактивацию антигена D фосфолипазой А2, что указывало на специфичность воздействия этого фермента именно на структуру-носитель антигена D.
Попытки выделить и идентифицировать белок Rh, предпринятые до 1980-х годов, позволили составить общую физико-химическую характеристику антигенов Rh. Предварительно установлено, что белок D имеет мол. массу 7-10 кДа. Другие исследователи сообщили, что антигены Rh расположены на анионном транспортном белке в полосе 3 [678]. Полоса 3, как теперь известно, соответствует антигенам Diego. Впоследствии полученные результаты были объяснены излишним протеолизом полипептидов D при очистке, а также тем фактом, что оба белка одинаково гидрофобны и мигрируют вместе в процессе выделения из мембраны эритроцитов.
Прорыв в исследовании антигенов Rh произошел в начале 1980-х годов, когда появились методы выделения растворимых комплексов «D-aura-D» имму-нопреципитацией антигенов специфическими антителами, меченными радиоактивным йодом (Moore и соавт. [483], Ridgwell и соавт. [564]). Вскоре были идентифицированы полипептиды с мол. массой 32-34 кДа, несущие серологическую активность D, Сс и Ее, и отсутствовашие на эритроцитах Rhnu!1. Каждый полипептид содержал экзофациальные тиоловые группы [564].
Далее выяснилось, что антигены е и Е расположены на одном полипептиде, а антиген D - на другом.
Картирование Rh-полипептидов, проведенное Bloy и соавт. [172], Blanchard и соавт. [168], показало, что фракции, иммунопреципитированные сыворотками анти-с и анти-Е, практически идентичны, а фракции, иммуно-преципитированные сыворотками анти-D, существенно от них отличаются.
Hughes-Jones и соавт. [363] не наблюдали конкурентного подавления связывания анти-с-антител антителами анти-Е и анти-D, а также ингибиции связывания анти-Е-антител антителами анти-с и анти-D, что свидетельствовало о размещении антигенов D, с и Е на разных участках полипептидов. При картировании установлено, что полипептид D имеет отличительные участки, не характерные для полипептидов с и Е, и это полностью совпало с результатами иммунопреципитации.
Gahmberg [295] отметил, что полипептид D не содержит углеводов в отличие от других белков, расположенных на внеклеточной поверхности мембраны эритроцитов. Такое заключение было основано на невозможности пометить полипептид D галактозоксидазой и перийодатом, неспособностью очищенного полипептида связываться в лектиновых колонках, а также неэффективностью обработки эндо-1М-ацетилглютаминазой Н и эндо-|3-галактозидазой.
Гликозилирование как обычная составляющая синтеза мембранных элементов не характерно для белка Rh. Он собирается в виде комплекса, включающего готовые полипептиды Rh и гликопротеины Rh, причем полипептиды Rh являются продуктом одного гена, расположенного на хромосоме 1, а гликопротеины Rh - продуктом другого гена, расположенного на хромосоме 6. Точно так же собираются антигены системы Kell: белок Кх ковалентно связывается с гликозили-рованным гликопротеином Kell, но оба субстрата являются продуктами разных генов, один из которых расположен на аутосоме, другой (Кх - на хромосоме X.)
После того как полипептиды Rh были идентифицированы, несколько групп исследователей попытались изучить их аминокислотную последовательность, а также создать олигонуклеотидные зонды и выделить ДНК, кодирующую Rh. Наиболее эффективными оказались методы препаративной иммунопреципитации (Avent и соавт. [147], Bloy и соавт. [172] с использованием мышиных и человеческих моноклональных антител. Другие исследователи (Saboori и соавт. [590]) использовали для очистки белков неиммунологические методы, в частности хроматографию в гидроксиапатите кальция (Saboori и соавт. [589]). Очищенные полипептиды метили радиоактивным йодом и расщепляли химотрипсином.
Исследования показали, что полипептид Rh, преципитированный анти-D-антителами, имел ту же N-концевую последовательность (до остатка 13), что и полипептид Rh, преципитированный мышиными моноклональными антителами серии R6A [147]. Однако, поскольку антитела R6A реагировали с эритроцитами D—, следовал вывод, что антиген D находится на другом полипептиде, реагирующем с анти-О-антителами, и что анти-О-антитела человека и моноклональные антитела R6A мыши определяют 2 разных, но тесно связанных полипептида. Исследование аминокислотной последовательности белков, выделенных хроматографией в гидроксиапатите из клеток D+ и D-, подтвердило их сходство
Предположение о том, что полипептиды Rh могут быть связаны в мембране эритроцитов с гликозилированным компонентом (гликопротеин Rh), было впервые высказано Gahmberg [295]. Далее было установлено, что гликопротеин Rh, преципитированный анти-Б-антителами вместе с полипептидом Rh, имеет мол. массу 45-70 кДа, а полипептид Rh - 30 кДа.
Когда стало ясно, что полипептиды Rh связаны в клеточной мембране с гли-копротеинами Rh, появились высказывания, что одни антигены Rh могут быть экспрессированы на полипептиде, а другие - на гликопротеине. Не исключали и третий вариант: некоторые антигены Rh представляют собой комплекс, состоящий из участков полипептида и гликопротеина. Присутствуя порознь, эти участки полипептида и гликопротеина не являются иммуногенными, а когда присутствуют одновременно, их комплекс приобретает иммуногенность.
Однако в последующих работах было установлено, что белковые последовательности, определяющие специфичность антигенов Rh, расположены на полипептидах, а не на гликопротеинах.
О том, что гены RHнаходятся на хромосоме 1, свидетельствовал ряд фактов.
К началу 1970-х годов накопились данные о частичной сцепленности генов RHс генами наследственного эллиптоцитоза, глюкозо-6-фосфатдегидрогеназы (G-6-PD), пептидазы-С (РерС) и фосфоглюкомутазы (PGMj).
Результаты семейных исследований указывали на то, что перечисленные гены образуют взаимосвязанную группу близкорасположенных локусов и наследуются вместе независимо от пола. Из накопленных сведений можно было сделать только один вывод: гены RHне расположены на хромосомах X и Y. Вопрос, на какой хромосоме они располагаются, оставался открытым.
Сдвиг в этой области достигнут благодаря гибридизации ядерных клеток мыши и человека (Ruddle и соавт. [587]). При культивировании гибридных клеток, имеющих 2 набора хромосом (человека и мыши), человеческие хромосомы постепенно вытеснялись мышиными. Эта модель оказалась удобной для изучения продукции ферментов, в частности пептидазы С. Установлено, что утрата хромосомы 1 сопровождалась потерей способности культивируемых клеток продуцировать пептидазу-С, а поскольку гены РерС, G-6-PD, PGM}и RHсвязаны, было сделано заключение, что вся группа генов, в том числе ген RH, находится на хромосоме 1.
Дополнительные данные в поддержку этого заключения были получены Marsh и соавт. [462]. Авторы наблюдали больного миелофиброзом, у которого была кровяная химера: 7 % эритроцитов, циркулирующих в его кровотоке, были резус-положительными (CcDee), а остальные 93 % - резус-отрицательными (cde). Один из родителей больного имел фенотип CCDee, т. е. не содержал га-плотипа cde, который мог передать по наследству. Сам пациент передал гапло-тип CDeсвоему сыну. Авторы предположили, что эритроциты CcDee пациента происходили из ростка, в котором гаплотипы CDeи cdeбыли функциональными, а эритроциты cde происходили из ростка, в котором гаплотип CDeявлялся молчащим {cde/ ). При хромосомном анализе выявлена делеция короткого плеча хромосомы 1 в 95 % ядерных клеток крови пациента, на основании чего авторы заключили, что потеря небольшого участка короткого плеча хромосомы 1, очевидно, привела к потере функционального гаплотипа CDe. Поскольку пациент был гетерозиготен по локусу PGM1и содержал оба типа этого фермента, авторы сделали вывод, что локус RHне только расположен на хромосоме 1, но и отстоит от центромеры хромосомы дальше, чем локус PGM.
В 1975 г. Turner и соавт. (цит. по Issitt и Anstee [374]) обследовали семью американских индейцев, в которой одни из членов были гомозиготны по гаплоти-пу -D-, другие - гетерозиготны, а третьи не имели этого гаплотипа. У гомозигот была обнаружена делеция короткого плеча обеих хромосом 1, у гетерози-гот - делеция короткого плеча одной хромосомы, а у родственников, не имевших гаплотипа -D-, делеции не было.
Хромосомный анализ лиц Rhnull и -D- не выявил корреляций, подобных описанным выше. Хромосомные аберрации (делеции и транслокации) не во всех случаях можно выявить существующими цитологическими методами исследования. Обнаружение корреляции серологических и кариологических признаков большая редкость. В литературе имеются сообщения о пациентах с кровяными химерами, содержащими 2 популяции эритроцитов, различающиеся по антигенам Rh. Однако эритроцитарные химеры, так же как и снижение экспрессии антигенов в период обострения болезни, наблюдают редко, и их трудно связать с изменениями в хромосоме 1, которые чаще всего отсутствуют.
Лишь с появлением методов молекулярной биологии, гибридизации in situ кДНК было достоверно установлено Cherif-Zahar и соавт. [211] место расположения локуса RHна коротком плече хромосомы 1, а именно в районе 1р34.3-lp.36.13. Локусы групп крови Fy (Duffy), Sc (Scianna), Cr (DAF, Cromer), Kn(CR1, Knops) и Rd (Radin) также расположены на хромосоме 1.
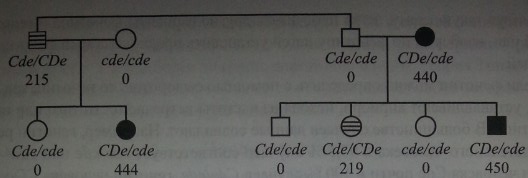
Гаплотип одной хромосомы может влиять на экспрессию антигенов, кодируемых гаплотипом другой хромосомы {транс). Наиболее выраженный эффект позиции транс прослеживается у лиц с генотипами Cde/cDeи Cde/CDe, при которых ген С, находящийся в положении транс по отношению к гену D, приводит к продукции слабого D-антигена (см. раздел Фенотип Du), в то время как ген Dкодирует нормальную экспрессию D-антигена, когда в положении транс находится ген с [202, 204]. На рис. 4.4 представлены результаты исследования 2 семей, у членов которых этот эффект четко прослеживался.
У дяди и племянницы, имевших генотип Cde/cDe, экспрессия антигена D была снижена вдвое по сравнению с тремя другими членами семей, генотип которых был CDe/cde(215, 219 и 444, 440,450 соответственно).
Влияние гаплотипа Cdeна экспрессию антигена D (по Ceppellini и соавт. [202]). Черные фигуры - нормальное количество D-антигена, заштрихованные -сниженное количество D-антигена, белые - отсутствие D-антигена. Цифры означают количество D-антигена в эритроцитах, выраженное в виде среднего титра 6 сывороток анти-D, титрованных с данными эритроцитами.
Race и Sanger [544], исследуя специально отобранные сыворотки анти-С и анти-Е, установили, что гены С и Е в позиции цис и транс влияют на экспрессию одноименных антигенов (табл. 4.9). Ген Е в позиции цис угнетает продукцию антигена С, а ген С в позиции транс - продукцию антигена Е. Впоследствии авторы несколько изменили свои взгляды, придя к выводу, что эффект супрессии может быть обусловлен не взаимодействием генов, а наличием в указанных, заранее отобранных сыворотках примеси других антител. Некоторые сыворотки анти-С содержат фракцию анти-Се-антител, поэтому сильнее реагируют с эритроцитами лиц Cde/cdEи Cde/CDe, имеющими оба антигена (С и Се). Сыворотки анти-Е иногда содержат анти-СЕ-антитела, за счет чего сильнее реагируют с эритроцитами лиц CdE/cdeи CDE/cDe, несущими антигены Е и СЕ.
Однако для того чтобы полностью исключить взаимовлияние генов С и £ в разных генетических комбинациях, нет достаточных оснований. На других моделях эффект транс и цис в той или иной мере проявляется.
Таблица 4.9 Выраженность антигенов С и Е у лиц с различным генотипом RH
|
Генотип |
Экспрессия антигена |
|
|
С |
Е |
|
|
CdE/cde |
Снижена |
Повышена |
|
Cde/cdE |
Повышена |
Снижена |
|
CDE/cDe |
Снижена |
Повышена |
|
Cde/cDE |
Повышена |
Снижена |
Ген Dв положении транс оказывает подавляющее действие на синтез антигенов С, Е и е (Race и Sanger [544]). У лиц CDe/cDEантиген С вырабатывается в меньшем количестве, чем у людей Cde/cde(Lawler и Race [412]).
Антигены f (се), V (ces), rh.(Ce), CE (Rh22), cE (Rh27) и Ces(Rh42) являются в соответствии с представлениями, существовавшими вплоть до последних лет, результатом г/мс-эффекта генов се, ces, Се, СЕ, сЕ и Се5. В положении транс гены сне, си es, С пене продуцируют антиген f и другие перечисленные выше антигены - ces, rh., СЕ, сЕ и Ces соответственно.
В свете современных представлений о системе Rh-Hr как двухгенной уровень экспрессии антигенов, объясняемый ранее положением цис и транс соответствующих генов, получил новую интерпретацию. Антигены С, с, Е и е на полипептиде Rh кодируются аллелями Се, сЕ, се и СЕ не только в разных сочетаниях, но и в различном количестве, а также качестве того или иного антигена.
Имеются данные (Giles, Bevan [305], Heiken, Giles [342]) о существовании независимо наследуемых генов-супрессоров, Х°г и Xе, не связанных с локусом Rh, которые, однако, влияют на экспрессию антигенов резус, в частности инициируют появление слабовыраженных форм CDe-комплекса: (C)D(e), (c)D(e) и других, а также фенотипа Rhnull.
Задолго до установления молекулярных различий в структуре полипептидов Rh и кодирующих их генов иммуносеролога классифицировали мутации, дающие начало новым групповым признакам, по поведению тех или иных антигенов и антител в серологических реакциях.
Доссе [50] разделил мутации на 3 категории.
Мутации с полной автономностью. Примером такой мутации служили антигены С и Cw в системе антигенов CCwc, гены которых до последних лет считались аллельными (см. Cwи С*). Антиген Сw полностью автономен по отношению к антигену С. Это проявляется в том, что люди СС, Сс и ее могут вырабатывать антитела aHra-Cw. Некоторые сыворотки анти-С содержат комбинированные антитела aHra-C+Cw в несепарируемой форме и не могут быть разделены на анти-С и анти-С w адсорбцией эритроцитами С и Cw. Вместе с тем чистые анти-С^антитела (без примеси анти-С) встречаются относительно часто.
Вначале предполагали, что антиген Cw наследуется независимо от С и с, проявляя полную автономность. Однако вскоре выяснилось, что он чаще присутствует в эритроцитах С+, чем в эритроцитах С-.
Аналогичными автономными свойствами обладает антиген Сх по отношению к антигенам С, с и Cw, а также антиген Ew по отношению к антигенам Е и е.
Мутации без автономности. Этот тип мутации отражается на количестве синтезируемого антигенного субстрата, не затрагивая его специфических свойств. Например, эритроциты Du агглютинируются не всеми сыворотками анти-D, которые в 100 % случаев реагируют с обычными эритроцитами D+. D не имеет собственной антигенной специфичности, отличающейся от D, однако передается по наследству кодоминантно, как D и все другие групповые антигены. Антитела анти-D могут быть полностью удалены из сыворотки адсорбцией эритроцитами Du, но сыворотка анти-D не может быть разделена на анти-D и анти-D11 дифференциальной адсорбцией. В совокупности все эти признаки свидетельствуют о существовании генной мутации или модификации гена D, которая не является автономной и проявляется лишь в виде слабовыраженного антигенного вещества.
Можно привести и другие примеры мутаций без автономности: С и Си, Е и Еи.
Промежуточные мутации. Например, антиген cv, описанный Race и соавт. [549], имеет признаки двух антитетичных антигенов - С и с, представляя собой некую промежуточную форму этих антигенов. Эритроциты cv агглютинируются полными и неполными анти-с-антителами с такой же интенсивностью, как эритроциты гомозигот с/с, а также реагируют с некоторыми сыворотками анти-С. Между тем специфические анти-су-антитела в чистом виде не встречаются.
Промежуточные формы антигенов наследуются кодоминантно.
Согласно современным представлениям о молекулярной структуре антигенов Rh (см. Строение системы Rh) приведенная классификация мутаций на основе иммуносерологических особенностей эритроцитов может показаться несколько наивной, однако именно такого рода сопоставления побудили молекулярных биологов искать объяснение групповым различиям на молекулярно-генетическом уровне.
Rh-антигены передаются индивиду по наследству в виде двух гаплотипов: одного - от отца, другого - от матери. Как и при наследовании других групповых признаков, у детей не может быть Rh-антигенов, отсутствующих у родителей.
Часто лекторы для закрепления знаний у слушателей спрашивают: «Могут ли родиться резус-положительные дети у резус-отрицательных родителей?» и получив, как правило, отрицательный ответ, продолжают вопрос: «А у резус-положительных родителей - резус-отрицательные дети?». На второй вопрос также нередко сдедует отрицательный ответ: «Не могут!». Это неверно. У резус-положительных родителей могут родиться резус-отрицательные дети, если оба родителя гетерозиготны - D/dх D/d.
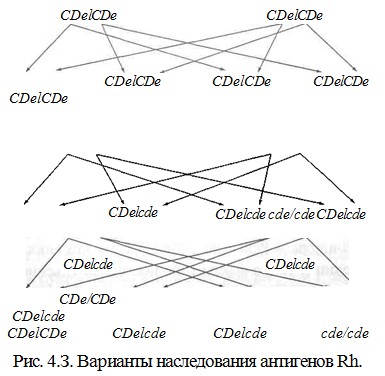
Ниже приведена удобная для использования схема, позволяющая отразить возможные Rh-фенотипы детей, которые можно ожидать у конкретной супружеской пары (рис. 4.3).
У супругов CDe/CDeх CDe/CDeвсе дети будут гомозиготы CDe/CDe. В семье, где один из родителей CDe/CDe, а другой - cde/cde, все дети будут гетерози-готы CDe/cde. Когда родители гетерозиготы CDe/cdeх CDe/cde, 75 % детей будут резус-положительными, 25 % - резус-отрицательными; из всех детей 25 % будут гомозиготы CDe/CDe, 50 % - гетерозиготы CDe/cdeи 25 % - гомозиготы cde/cde.
Используя такую схему, легко просчитать другие варианты фенотипа и генотипа детей или, наоборот, по фенотипу детей установить предполагаемый фенотип родителей.
Если фенотип можно определить с помощью сывороток, то генотип, как правило, устанавливают априори, исходя из частоты встречаемости того или иного фенотипа. В большинстве случаев данные совпадают. Например, генотип резус-отрицательного человека в 97,5 % случаев соответствует cde/cdeили cde/-; генотип человека Cde почти в 100 % случаев Cde/cde, генотип человека CDe примерно в 30 % случаев CDe/cde, а в 16 % случаев - CDe/CDe. Высока (более 90 %) вероятность того, что человек с фенотипом cDe имеет генотип cDe/cde, a не cDe/cDe, поскольку гаплотип cdeвстречается значительно чаще, чем гапло-тип cDe. Более точно установить ЯЯ-генотип человека можно на основании семейного исследования, т. е. установления Rh-фенотипа родителей, братьев, сестер и детей (близких родственников, желательно 3-4 поколений).
С высокой точностью генотип может быть установлен с помощью набора сывороток анти-се, анти-Се, анти-сЕ и анти-СЕ. Например, человек с фенотипом CcDEe может иметь генотип cDE/Cdeили CDE/cde. При обоих генотипах эритроциты будут реагировать одинаково с сыворотками анти-D, анти-С, анти-Е, анти-с и анти-Е, а с сыворотками анти-се, анти-Се, анти-сЕ и анти-СЕ - по-разному. При генотипе cDE/Cdeагглютинация эритроцитов произойдет с сыворотками анти-Се и анти-сЕ, но не произойдет с сыворотками анти-се и анти-СЕ (см. табл. 4.7). При генотипе CDE/cde, наоборот, эритроциты будут реагировать с сыворотками анти-се и анти-СЕ, но не будут реагировать с сыворотками анти-Се и анти-сЕ. Точно также эритроциты СсЕе с генотипом Cde/cdEбудут реагировать с сыворотками анти-Се и анти-сЕ, а у человека с генотипом CdE/cde- только с сыворотками анти-се и анти-СЕ.
Наиболее точно (но не в 100% случаев) генотип устанавливают, анализируя сам ген. Для этого исследуют ДНК человека с помощью молекулярно-биологических методов (см. ДНК-типирование Rh-антигенов).