Антитела JMH
Лица JMH- были обнаружены исключительно благодаря присутствию в сыворотках их крови анти-ХМН-антител. В анамнезе этих людей часто отсутствовали указания на беременности и гемотрансфузии (Baldwin и соавт. [1], Moulds и соавт. [15]), что служит основанием относить эти антитела к естественным или аутоиммунным по происхождению.
Антитела JMH чаще представлены субклассом IgG4, описаны также анти- ^ тела субклассов IgGl и IgG2 (Baldwin и соавт. [1], Pope и соавт. [18], Tregellas и соавт. [23]), а также IgG3 (Geisland и соавт. [9]).
Имеются сообщения о переливании реципиентам, содержащим анти-JMH-антитела, несовместимых invitroэритроцитов JMH+. Трансфузии не сопровождались трансфузионными реакциями (Sabo и соавт. [19], Whitsett и соавт. [24], Baldwin и соавт. [1], Tregellas и соавт. [23]). Одному из таких реципиентов в течение 10 мес. лечения перелили 20 доз эритроцитов JMH+ без реакций, при этом у него был достигнуто желаемое увеличение содержания гемоглобина (Tregellas и соавт. [23]).
Срок циркуляции эритроцитов JMH+ в кровяном русле больных, имевших анти-1МН-антитела, не был сокращен по сравнению с нормой (Sabo и соавт. [19], Whitsett и соавт. [24], Tregellas и соавт. [23]). Некоторые анти-JMH-антитела проявляли себя invitroкак клинически значимые (Geisland и соавт. [9], Hadley и соавт. [10]).
Данные, позволяющие сделать заключение о возможном значении анти-JMH-антител в акушерстве, отсутствуют. В большинстве случаев женщины, у которых выявляли эти антитела, были старше детородного возраста. Анамнестические сведения не были убедительными.
В одном случае женщина 26 лет, имевшая анти-ДМН-антитела, родила здоровую двойню, оба ребенка имели фенотип JMH-. Повторное обследование детей через 10 мес. показало, что один из них имел нормально выраженный антиген JMH, у другого он выявлялся слабо.
Моноклональные антитела, реагировавшие с гликопротеином CDwl08, одновременно реагировали с антигеном JMH и квалифицировались как анти-JMH (Mudad и соавт. [16]).
Daniels и Knowles [7, 8] показали, что моноклональные aHra-CDwl08-антитела блокируют реакцию аллогенных анти-ЛУШ-антител, что свидетельствовало если не об идентичности, то об одинаковой специфической направленности aHTH-CDwl08- и анти-ЛУШ-антител.
Локализация и строение антигенов JMH
Методом иммуноблоттинга и иммунопреципитации с аллогенными и моно-клональными антителами показано, что антигены JMH расположены на глико-протеине с мол. массой 76 кДа. Этот белок присутствует на эритроцитах JMH+, на эритроцитах JMH- он не найден (Bobolis и соавт. [3]). Гликопротеины, несущие антигены JMH, относятся к гликозилфосфатидилинозитол (ГФИ) связанным протеинам. Они отделяются от мембраны эритроцитов соответствующим ферментом - ГФИ-фосфолипазой С.
Гликопротеин JMH содержит 19 цистеиновых остатков и как полагают, имеет дисульфидные связи. Доказательством этому может служить тот факт, что антигены JMH разрушаются сульфгидрильными реагентами.
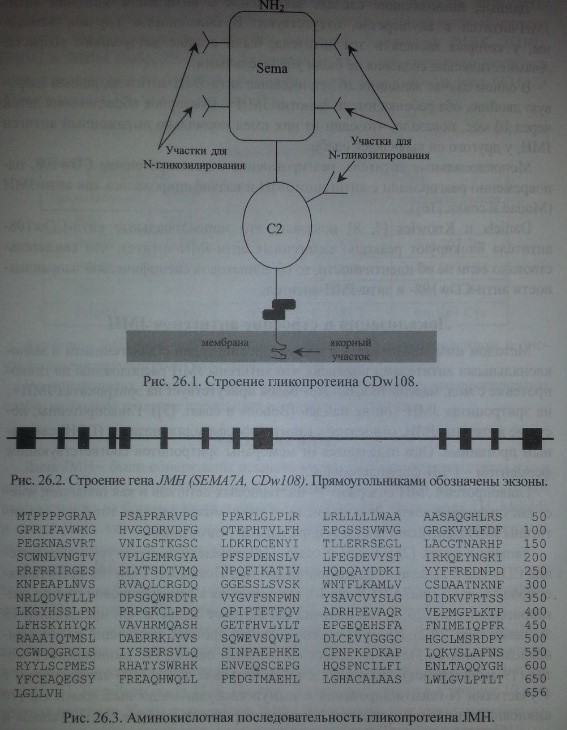
Yamada и соавт. [25], Lange и соавт. [14] определили структуру гликопроте-ина CDwl08 и выделили кодирующий его ген. Поскольку CDwl08 представляет собой белок Sema7A (H-Sema-L), относящийся к семафориновой группе гли-копротеинов (рис. 26.1), ген получил обозначение SEMA7A. Он представлен 13 экзонами (рис. 26.2). Продуктом гена является протеин, состоящий из 656 аминокислот (рис. 26.3). Он включает сигнальный пептид (46 аминокислот), мотив (19 аминокислот), связанный с ГФИ, большой домен (500 аминокислот) с 4 участками N-гликозилирования и иммуноглобулиноподобный домен С2 (70 аминокислот) с одним участком N-гликозилирования (см. рис. 26.1) (Yamada и соавт. [25], Lange и соавт. [14]).
Как показали Mudad и соавт. [16], гликопротеины JMH и CDwl08 являются одним и тем же белком и имеют одинаковою аминокислотную последовательность. Они отсутствуют на эритроцитах JMH-.
Описаны Л больных дизэритропоэтической анемией, эритроциты которых содержали слабый антиген JMH (Bobolis и соавт. [2]).
Секретируемые и мембранные семафорины выполняют функцию сигнальных белков (белков наведения), способствующих росту аксонов нервной клетки в нужном направлении {Вгоп и соавт. [5], Kolodkinи соавт. [13]), участвуют в межклеточных взаимодействиях (Tamagnone, Comoglio [21]).
Плексины - основные рецепторы семафоринов - участвуют в регуляции деятельности эндокринной, иммунной, сердечно-сосудистой, желудочно-кишечной и других важнейших систем организма (Yazdani, Terman [26]).
Гликопротеин CDwl08 экспрессирован преимущественно на активированных лимфоцитах и содержит аминокислотную последовательность Arg-Gly-Asp (267-269), характерную для молекул клеточной адгезии. Большое количество РНК-транскриптов SEMA7Aвыявлено в плаценте, тестикулах, селезенке, низкое - в головном мозге и тимусе (Lange и соавт. [14], Yamada и соавт. [25]).
Утрата антигенов JMH (и обретение фенотипа JMH-) invivoможет быть обусловлена действием внутриклеточных протеаз (Bobolis, Telen [4]). Инкубация эритроцитов при 37 °С в течение 45 мин приводила к появлению в супернатанте серологически активного JMH-протеина с мол. массой 67 кДа. Отделение протеина тормозилось ингибиторами протеаз. Высвобождение протеина JMH из изолированных мембран происходило только при добавлении цитоплазмы или нейтрофилов (Bobolis, Telen [4]).



