Поиск по сайту
Антиген CD99 выполняет функцию молекул клеточной адгезии. Реакция CD99 на клеточной мембране с антителами инициирует активацию Т-лимфоцитов, о чем свидетельствует появление антигена CD25 (рецептора к интерлейкину-2) и антигенов CD69 и CD40L (маркеров Т-клеточной активации) (Wingett и соавт. [98]).
По данным Bernard и соавт. [8], Pettersen и соавт. [70], связывание анти-С099-антител с тимоцитами и зрелыми Т-клетками ускоряло их апоптоз.
Некоторые образцы анти-СБ99-антител блокировали спонтанное розет-кообразование Т-клеток человека с эритроцитами барана (Bernard и соавт. [7]). Стимуляция эпитопа CD99 антителами вызывала агрегацию тимоцитов, несущих антигены CD4 и CD8, а также агрегацию В-лимфобластов (Bernard и соавт. [9], Hahn и соавт. [50]). Укороченный изомер гликопротеина CD99, лишенный цитоплазматического домена,^наоборот, ингибировал агрегацию В-клеток (Ambros и соавт. [2]).
Высокий уровень экспрессии антигена CD99 наблюдается у больных саркомой Эрвинга и другими опухолями нейроэктодермального происхождения (Ambros и соавт. [2]), Анти-С099-антитела угнетали рост клеток саркомы Эрвинга in vitro и in vivo, в связи с чем предложено использовать эти антитела для терапии (Scotlandi и соавт. [83]).
Снижение экспрессии антигена CD99 наблюдалось у больных лимфогранулематозом (болезнь Ходжкина) (Kim и соавт. [57]). Одновременно у больных отмечалась слабая выраженность антигенов гистосовместимости I класса. Эти ли-ганды накапливаются внутри комплексов Гольджи. Не исключено, что эпитопы CD99 участвуют в транспорте HLA-антигенов из аппарата Гольджи, где они синтезируются, в мембрану клеток (Sohn и соавт. [87]). Уменьшение количества антигенов гистосовместимости в опухолевых клетках рассматривают как один из механизмов ускользания их от системы иммунологического надзора (Sohn и соавт. [87]).
Функции антигена Xgaв клетке неизвестны. Его структурная гомология с антигеном CD99 позволяет полагать, что он определяет адгезивные свойства клеток, однако его распределение на клетках организма человека (не эритроцитах) мало изучено.
Антигены Xga и CD99 у животных
Антиген Xga обнаружен на эритроцитах гиббонов Hylobates lar lar. Из 32 обезьян фенотип Xg(a+) имели 30 % особей мужского пола и 53 % - женского. У других представителей человекообразных обезьян (67 шимпанзе, 2 гориллы, 20 орангутангов, 60 бабуинов и 5 гиббонов Hylobates pileatus) антиген Xgaне выявлен.
Антиген CD99 не обнаружен на лимфоцитах периферической крови гиббонов, но выявлен на фибробластах шимпанзе и горилл. Он отсутствовал у орангутангов и других исследованных млекопитающих (Gavin и соавт. [39], Shaw и соавт. [84]).
Shaw и соавт. [93], анализируя геномную и кодирующую ДНК, установили наличие генов XG и MLC2 у низших приматов. Хромосомную организацию двух высокогомологичных генов - Ж и МС2 - авторы объясняют дупликацией одного из генов, полагая, что она произошла около 150 млн лет назад.
Рекомбинации X-Y затрагивают участки хромосом, получившие название «псевдоаутосомные». Участки Y-хромосомы, определяющие мужской пол, в том числе тестисдетерминирующий ген SRY, в рекомбинациях, как правило, не участвуют. Однако встречаются исключения из этого правила: примерно один из 20 ООО мужчин имеет хромосомный набор XX, свойственный женскому организму.
Как полагает Fergusson-Smith [35], в результате рекомбинации генетического материала на концах короткого плеча Х- и Y-хромосом локус XG отцовской Х-хромосомы заменяется тестисдетерминирующим геном SRYva Y-хромосомы. Образуется Х-хромосома, определяющая мужской пол. Такие индивиды страдают бесплодием, несмотря на нормально выраженные мужские половые признаки (Davies [23], De la Chapelle [24,25], Jacobs, Hassold [56]).
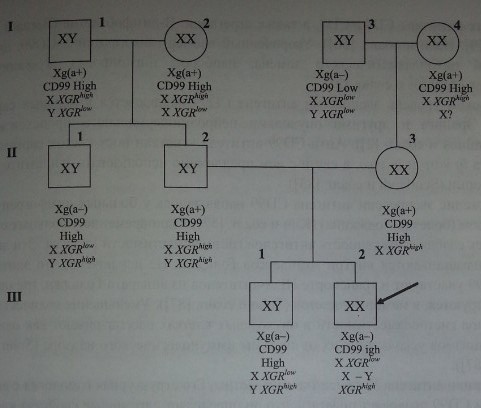
Антигены Xg и CD99 имеют отношение к феномену ХХ-дисомии (рис. 14.4): пробанд (Ш-2) Xg(a-) с высокой экспрессией антигена CD99 имел кариотип XX. Его отец (И-2) Xg(a+) имел ген Yga (XGRH8h), происходивший из Y-хромосомы. Брат отца (II-1) имел такую же Y-хромосому, его эритроциты Xg(a-) также содержали высокоэкспрессированный антиген CD99. Наиболее вероятное объяснение кариотипа XX: отец пробанда имел Х-хромосому, в которой локус XG был замещен фрагментом короткого плеча Y-хромосомы, содержащим ген SRY.
Присутствие Y-хромосомного материала у большинства мужчин, имеющих кариотип XX, было подтверждено результатами молекулярно-генетических исследований. Кариотип таких лиц получил обозначение Y(+)XX.
Petit и соавт. [69] выявили мужчин с кариотипом XX, у которых Y-генетический материал отсутствовал.
В редких случаях мужчины XX наследуют от отца ген Xga. Это дает основания полагать, что рекомбинации Х- и Y-хромосом могут происходить без участия локуса XG (De la Chapelle и соавт. [25], Evans и соавт. [33]).
Evans и соавт. отметили, что у мужчин XX короткое плечо обеих Х-хромосом значительно длиннее, чем у Х-хромосом женщин. Соответственно рекомбинации X-Y могут происходить с различным количеством генетического материала, и это объясняет, как одна и та же Х-хромосома может нести одновременно покусы XG и SRY
Родословная мужчины с кариотипом XX показывающая возможность рекомбинации X—Y (по De la Chapelle и соавт. [26]) с различными уровнями экспрессии антигена CD99. Пробанд (мужчина Ш-2) Xg(a-) унаследовал: от матери (П-3) Х-хромосому с геном XGRlow, от отца (П-2) рекомбинантную X-Y-хромосому, в которой локус XG замещен геном XGRMgh. У брата пробанда рекомбинация локуса XG не затронула Y-хромосому.
В процессе мейоза у мужчин Х- и Y-хромосомы расходятся в разные сперма-тоциты. Подобно аутосомам, Х- и Y-хромосомы в процессе мейотического деления спариваются. При спаривании и последующем разделении возможно перераспределение генного материала - рекомбинации. Такие участки получили название псевдоаутосомных, поскольку гены, находящиеся в этих участках, в том числе Xg, наследуются не как Х-сцепленные, и их ошибочно принимают за ау-тосомные (Burgoyne [13,14], Ellis, Goodfellow [30], Rappold и соавт. [75]).
Частота рекомбинаций в псевдоаутосомах в 20 раз выше, чем в других хромосомах. Некоторые гены псевдоаутосом, расположенные близко к теломере, претерпевают рекомбинации в 50 % случаев. При проведении посемейных исследований такие гены невозможно отличить от аутосомных. Ген МС2, контролирующий антиген CD99, является псевдоаутосомным и также подвержен рекомбинациям между гомологичными участками Х- и Y-хромосом. Такие рекомбинации в процессе мейоза выявлены примерно у 2 % мужчин (Goodfellow и соавт. [44]). Псевдоаутосомные участки, располагающиеся на Х-хромосоме, после инактивации Х-хромосомы остаются активными.
Ген XG не относится к псевдоаутосомным, однако сцеплен с другими, обладающими такой характеристикой (Ellis и соавт. [32]). В очень редких случаях ген XG9 по-видимому, вовлекается в рекомбинации с гомологичным участком.
Хромосомы. Именно этим объясняют случаи рождения сыновей Xg(a+) у женщин Xg(a-) Sanger и соавт. [80], Chown и соавт. [16], Tippett, Ellis [91] и др.
Гены MIC2 и XG
Ген МС2, как отмечалось выше, контролирует антиген CD99. При изучении гибридных клеток человек - мышь установлено, что локус МС2 присутствует как на Х-, так и на Y-хромосоме (Goodfellow и соавт. [42, 43], Curry и соавт. [18]). По данным Goodfellow и соавт. [43], гибридные клетки экспрессировали CD99 и в тех случаях, когда содержали только одну (X или Y) половую хромосому человека. Клонирование кДНК МС2 показало идентичность локуса МС2 на Х- и Y-хромосомах (Goodfellow и соавт. [47], Darling и соавт. [22]).
Локус МС2 картирован на концах короткого плеча Х- и Y-хромосом в позициях Xpter —>Хр22.32 и YpterYpll.2 (Buckle и соавт. [ 12]). *
Выделение геномной ДНК, примыкающей к локусу МС2, показало наличие генного вещества, связанного с псевдоаутосомными структурами
1 По Tippett, Ellis [93], Ellis и соавт. [32], Smith и соавт. [86].
1 Аминокислоты, кодируемые генами МС2 и XG на эритроидной форме Xg-гаикопротеина;
2 кДНК XG содержит дополнительную вставку величиной 3 пн, кодирующую серии в позиции 86 между экзонами 5 и 6;
Организация генов MIC2 и XG
|
Экзон |
М1С2 |
XG |
||||
|
Размер экзона, пн |
Аминокислота |
Размер интрона, кб |
Размер экзона, пн |
Аминокислота |
Размер интрона, кб |
|
|
1 |
-244 |
1-23 |
23 |
246 |
1-21 |
12,5 |
|
2 |
33 |
23-34 |
3,2 |
42 |
21-35 |
3,3 |
|
3 |
48 |
34-50 |
2,4 |
24 |
35-43 |
8,3 |
|
4 |
45 |
50-65 |
0,6 |
63 |
43-64 |
7,0 |
|
5 |
69 |
65-88 |
1,0 |
63(66)2 |
64-85 |
7,0 |
|
6 |
48 |
88-104 |
1,2 |
69 |
85-108 |
2,0 |
|
7 |
51 |
104-121 |
4,1 |
51 |
108-125 |
10,0 |
|
8А3 |
|
|
|
45 |
(125-140)3 |
|
|
8 |
114 |
121-159 |
6,8 |
36 |
125-137 (140-152) |
5,0 |
|
9 |
57 |
159-178 |
7,7 |
117 |
137-176 (152-191) |
4,0 |
|
10 |
533 |
178-186 |
|
67(244) |
176-180 (191-195) |
|
Ген МС2 на Х- и Y-хромосоме состоит из 10 небольших экзонов (табл. 14.4). Экзон 1 кодирует лидер-пептид, экзоны 2-9, а также часть экзона 10- протеин CD99.
Гены MIC2 и XG характеризуются высокой степенью гомологии. Подобно гену МС2 ген XG также включает 10 экзонов. Экзон 1 кодирует лидер-пептид, экзоны 2-10 - иммунодоминантный протеин. Дополнительный экзон XG, получивший обозначение 8А, представлен только в транскриптах из фибробластов (Tippett, Ellis [91], Ellis и соавт [32]).
Экзоны 1-3 гена XG Y-хромосомы менее активны по сравнению с экзона-ми 1-3 гена XG Х-хромосомы и образуют меньшее количество транскриптов (Weller и соавт. [97]).
Одиночная трансфекция (только кДНК МС2 или XG) и двойная трансфек-ция (кДНК МС2 и XG одновременно) мышиных фибробластов показали, что антигенные эпитопы Xg и CD99 экспрессируются на мембране клеток независимо друг от друга (Fouchet и соавт. [37]).
Экзоны 1-3 гена XG Y-хромосомы менее активны по сравнению с экзона-ми 1-3 гена XG Х-хромосомы и образуют меньшее количество транскриптов (Weller и соавт. [97]).
Одиночная трансфекция (только кДНК МС2 или XG) и двойная трансфекция (кДНК MLC2 и XG одновременно) мышиных фибробластов показали, что антигенные эпитопы Xg и CD99 экспрессируются на мембране клеток независимо друг от друга.
У людей Xg(a-) экспрессия антигена CD99 варьирует от низкой степени до высокой (Tippett и соавт. [92]). Для объяснения этого феномена Goodfellow и соавт. [45] предложили гипотезу о существовании XG-регуляторного локуса - XGR. В позиции цис ген XGR влияет на активность генов XG и МС2 на Х-хромосоме, а также гена МС2 на Y-хромосоме. Ген XGR представлен двумя аллелями: XGRIown XGRhigh. АллельXGRlow препятствует экспрессии CD99, в то время как аллельXGRhigh ей способствует. В соответствии с этой моделью женщины Xg(a-) имеют ген XGRlow на обеих Х-хромосомах и экспрессия CD99 у них неизменно низкая. Мужчины Xg(a-) имеют ген XGRlow на Х-хромосоме, но при этом на Y-хромосоме может присутствовать как XGRlow, так и XGRhigh, и именно это определяет уровень экспрессии CD99.
Ген XGR является псевдоаутосомным, поскольку образуется в результате X-Y-рекомбинации.
Модель, согласно которой экспрессия антигенов Xga и CD99 регулируется одним и тем же геном XGR, позволяет объяснить, почему частота и выраженность антигенов Xga и CD99 столь связаны. Она также позволяет понять, почему матери Xg(a~) имеют сыновей Xg(a+): сын наследует от матери ген Xg с Х-хромосомой, а от отца ген XGRhighс Y-хромосомой, несущей рекомбинацию XG-XGR, кодирующую антиген Xga.
Следует отметить, что модель, предложенная Goodfellow и соавт., остается гипотетической, однако она весьма конструктивна, поскольку позволяет объяснить имеющееся разнообразие фенотипов Xg и CD99.
Влияние аллелей High и Low гена XGR на выраженность антигенов Xga и CD99
|
XGR-annem на хромосоме |
Фенотип |
|||
|
Женщины |
X |
i;"v ' X |
Xg |
CD99 |
|
High |
High |
Xg(a+) |
Сильный |
|
|
High |
Low |
Xg(a+) |
Сильный |
|
|
Low |
Low |
Xg(a-) |
Слабый |
|
|
Мужчины |
X |
Y |
Xg |
CD99 |
|
High |
High |
Xg(a+) |
Сильный |
|
|
High |
Low |
Xg(a+) |
Сильный |
|
|
Low |
High |
Xg(a-) |
Сильный |
|
|
Low |
Low |
Xg(a-) |
Слабый |
|
Нормальные клетки всех млекопитающих имеют две Х-хромосомы у особей женского пола и только одну Х-хромосому у особей мужского пола. Для развития зародышевой клетки достаточно одной Х-хромосомы. Одновременное функционирование в зиготе двух гомологичных Х-хромосом исключено благодаря явлению, получившему название «инактивация Х-хромосомы, или эффект Лайона». В каждой соматической клетке женского организма (Х/Х) активной является только одна Х-хромосом, активность другой подавляется в раннем эмбриональном периоде (Lyon [61, 62]). Ийактивация одной из двух Х-хромосом (отцовской или материнской) - событие случайное. Количество клеток с отцовской и материнской Х-хромосомами приблизительно одинаковое. Потомство клетки, в которой произошла инактивация одной из Х-хромосом, будет обладать точно такой же инактивированной хромосомой. Таким образом, женские особи химеричны по Х-хромосоме, поскольку в одних клетках активна отцовская Х-хромосома, в других - материнская. Инактивация генов Х-хромосомы происходит в позиции цис. На одной из Х-хромосом возникает центр инактивации, Xist, который образует большой иРНК-транскрипт, блокирующий Х-хромосому (Lyon [61]).
Сначала полагали, что нейтрализации подвергаются все без исключения гены инактивированной Х-хромосомы. Однако в дальнейшем стало очевидным, что ряд генов (не мене 20) в такой Х-хромосоме не инактивируется (Davies [61]). Одним из генов, не подвергающихся инактивации, является XG. Если бы XG пребывал на одной Х-хромосоме в активном состоянии, а на другой - в неактивном, то женщины, гетерозиготные по гену Xga (Xga/Xg), должны были бы иметь в периферической крови смешанную популяцию эритроцитов, состоящую из клеток Xg(a+) и Xg(a-). В действительности же этого не наблюдается (Race, Sanger [73], Klinger и соавт. [58], Ducos и соавт. [29]).
Описаны случаи естественных и трансплантационных химер по Xga, однако при этом было установлено, что эритроциты Xg(a+) и Xg(a-) происходили из одних и тех же костномозговых предшественников (Sparkes и соавт. [88]).
Ген МС2, контролирующий синтез антигена CD99, также не подвергается инактивации (Goodfellow и соавт. [46]). Гибридные клеточные линии, содержавшие инактивированные Х-хромосомы, продуцировали антиген CD99.
Имеются данные, свидетельствующие о том, что локус XG нейтрализуется при инактивации дефектных Х-хромосом с наличием делеций (Polani и соавт. [72]).
Локус XG картирован на коротком плече Х-хромосомы. Среди 20 женщин с делецией короткого плеча Х-хромосомы 13 имели фенотип Xg(a+). Такая частота соответствует встречаемости антигена Xga среди мужчин (Sanger и соавт. [79, 81]), поэтому есть все основания полагать, что у женщин с делецией короткого плеча на одной Х-хромосоме антиген Xga вырабатывается за счет гена XG другой, нормальной, Х-хромосомы. Локус МС2, контролирующий CD99, при инактивации дефектной Х-хромосомы нейтрализации не подвергается (Goodfellow и соавт. [46]).