Поиск по сайту
Частота привычных выкидышей (ранних спонтанных абортов) существенно выше среди женщин с фенотипом р, чем в популяции в целом. У многих женщин фенотип р были выявлен именно по этой причине.
Прерывание беременности, обусловленное анти-Р-антителами, происходит в I триместре беременности. Если Этого не происходит, беременность развивается нормально и завершается рождением здорового ребенка. У большинства детей Р и Р2, родившихся от матерей группы р, ГБН не развивается (Sheedan и соавт. [148], Yamaguchi и соавт. [174]), хотя легкие формы указанной патологии в ряде случаев были описаны (Hayashida и соавт. [56], Levene и соавт. [91]).
Установлено (Cantin, Lyonnais [24], Levine и соавт. [97], Weiss и соавт. [169]), что причиной ранних самопроизвольных выкидышей у женщин, имеющих группу крови р, являются антитела анти-РР1Рк. Какая именно фракция этих антител обусловливает указанную патологию, пока неизвестно.
Ikin и соавт. [65] и Levine [92] полагали, что невынашивание беременности обусловлено анти-Р 1-фракцией, поскольку антиген Р1 формируется у эмбриона на ранних стадиях внутриутробного развития. Sanger и Tippett [143] не разделяли эту точку зрения, поскольку у женщин р, имевших мужей Pj и Р2, рождались и здоровые дети, при этом соотношение детей Pj:P2 не отличалось от имеющегося в популяции в целом.
Kato и соавт. [76] связывают невынашивание беременности! с анти-Рк-антителами: антиген Рк также хорошо выражен в растущих тканях развивающегося эмбриона.
Lopez и соавт. [103]) установили, что в 75 % случаев антитела анти-Рк обладают in vitro цитотоксическими свойствами и, следовательно, способны вызвать патологию in vivo.
Энзимные и радиоиммунные тесты показали, что сыворотки крови почти всех лиц, имеющих фенотип р, содержат антитела анти-РР1Рк IgG3-субкласса (Rydberg и соавт. [140], Soderstrom и соавт. [151]), которые, как известно, могут преодолевать плацентарный барьер.
В гликосфингожпидах, выделенных из тканей спонтанно абортированных 12- и 17-недельных плодов, антигены Р и Рк обнаруживали в следовых количествах. В то же время гаишсфинголипиды, выделенные из плацент, хорошо экспрессировали указанные антигены (Lindstrom и соавт. [100]). Таким образом, мишенью для антител, обусловливающих невынашивание беременности, является не плод, а плацента.
Антитела анти-Р у женщин с фенотипом Рк не вызывали угнетения беременности и лишь в редких случаях служили причиной легких форм ГБН (Nakagima и соавт. [126], Yamaguchi и соавт. [174]).
Антитела анти-Р, ассоциированные с привычными выкидышами, были описаны у японской женщины с фенотипом Р k и женщины с фенотипом Pjk жительницы Кувейта (Shirey и соавт. [150], Yoshida и соавт. [176]). У 1-й женщины было 4 самопроизвольных выкидыша, у 2-й - 13. Ни та, ни другая не имели детей. В дальнейшем обеим женщинам с 5-6 недели очередной беременности проводили плазмаферез с целью снижения титра антител. Обе женщины родили жизнеспособных детей, не нуждающихся в каком-либо специальном лечении, кроме фототерапии. В сыворотке крови женщины из Кувейта присутствовали IgM, IgG (главным образом IgG3) и IgA; такие же анти-Р-антитела были элюированы из тканей плаценты. Плазму японской женщины адсорбировали Р-положительными эритроцитами, после чего производили реинфузию (Yoshida и соавт. [176]). Имеются другие сообщения об эффективном применении плазмафереза у женщин, имеющих р-фенотип и страдающих невынашиванием беременности (Fernandez-Jimenez и соавт. [43], Rydberg и соавт. [140], Shechter [147], Yoshida и соавт. [177]).
Необычные антитела выявили Vos и соавт. [167] в Перте (Западная Австралия) у женщин с привычным невынашиванием беременности. Эти антитела вызывали гемолиз, но не агглютинировали эритроциты Р} и Р2; тесты с эритроцитами р были отрицательными. Женщины имели фенотип Рг Гемолизины обнаруживали в сыворотках крови только в момент самопроизвольного выкидыша, вне беременности антитела не обладали гемолитической активностью. Гемолитическая активность не была опосредована комплементом. Vos и соавт. [164-167], обследовавшие женщин, не нашли какого-либо объяснения указанному феномену.
У женщин Канады, США и Венгрии, страдавших невынашиванием беременности, подобных гемолизинов не обнаружено (Horvath и соавт. [63], Vos et al [167]).
Кишечная палочка (Escherichia coli), вызывающая пиелонефрит и другие рецидивирующие воспаления мочеполового тракта, прилипает к эпителию слизистой оболочки с помощью адгезинов - лектиноподобных веществ, расположенных на поверхности бактериальной клетки (Lingwood и соавт. [102], Stapleton и соавт. [154]).
Адгезины связываются с гликоконъюгатами глобозидов, содержащими диса-харид Galal Щ 4Gal, а также сиалозил- и дисиалозилгалактозил (Elder, Spitalnik [40], Lindstrom и соавт. [101], Moulds и соавт. [118]). Указанные вещества составляют основу специфичностей PI, Р, Pk, LICE и других антигенов, объединенных в систему Р и GLOB.
Как показали Kallenius и соавт. [72], способность уропатогенных штаммов Escherichia coli связываться с эритроцитами и эпителиальными клетками лиц, имеющих фенотип р, снижена. Следовало ожидать, что лица, имеющие группу крови р, резистентны к урогенитальным инфекциям, однако изучение коррелятивной связи фенотипа Р с урогенитальными инфекциями не дало однозначных результатов (Kallenius и соавт. [72]).
Некоторые штаммы Escherichia coli выделяют энтеротоксины, в частности веротоксин, подобный токсину Шига, который продуцируют бациллы Shigella dysenteriae. Веротоксин вызывает воспаление слизистой оболочки тонкой кишки, диарею, инициирует гемолитический уремический синдром (Green [52], Elder, Spitalnik [40]). Р-группоспецифический дисахарид Galal —► 4Gal выступает в роли лиганда, фиксирующего веротоксин на эпителии слизистой оболочки.
Свиной стрептококк {Streptococcus suis), один из возбудителей менингита человека, способен связываться с веществом Рк- трисахаридом Galal —»• 4Gaipi Ц 4Glc. Препараты их этих бактерий сильнее агглютинировали эритроциты PjkH P2k по сравнению с Р и Р2, но не вызывали склеивания эритроцитов р (Haataja и соавт. [53]).
Антиген Р (глобозид) является клеточным рецептором для парвовируса В19, проявляющего высокую тропность к костномозговым клеткам, особенно к эри-троидным предшественникам, в которых он реплицируется (Brown и соавт. [20]). Оболочки лизированного вируса В19 вызывали агглютинацию эритроцитов Р, и Р2, но не реагировали с эритроцитами Рк и р. Цитотоксичность парвовируса в клеточной культуре удавалось предотвратить с помощью моноклональных антител анти-Р. Антитела анти-Р 1 и анти-Рк цитотоксичность указанного вируса не отменяли. Цитотоксичность не наблюдали в культурах костномозговых клеток, полученных от лиц р (Brown и соавт. [19-21]).
При двойном иммунном окрашивании клеток костного мозга, инфицированных парвовирусом В19, установлено, что вирусные частицы адсорбируются на клетках, экспрессирующих антиген Р (Kerr и соавт. [78]).
, имеющие фенотип р, оказались невосприимчивы к парвовирусной инфекции В19 (Kerr и соавт. [78]).
Имеются данные, что лиганд Gb3 (Pk) может выступать в роли кофактора, способствующего проникновению вируса иммунодефицита человека HIV-1 в Т-клетки (Hammache и соавт. [54], Puri и соавт. [132]).
Антиген Рк
Формирование антигенной детерминанты Рк происходит с участием a-D-галакгозы (Furukawa [49], Kundu и соавт. [86], Voak и соавт. [161], Watkins, Morgan [168]). Активность антител анти-Рк, так же как и анти-Р, ингибировалась жидкостью кист эхинококка (Matson и соавт. [108]). Частичный кислотный гидролиз гликопротеина, выделенного из эхинококковых кист, позволил получить 2 субстанции: трисахарид, обладающий способностью специфически инактивировать антитела анти-Р 1 и анти-Рк, и дисахарид Galal щ 4Gal, связывающий антитела анти-Р 1, но инертный по отношению к анти-Рк-антителам [168]. Другие олигосахариды, содержавшие терми-Ц^ЦНРлактозные группы, также нейтрализовали активность анта-Рк-антител,
Naiki, Marcus [125] идентифицировали антиген Рккак Gb3 (глобозид 3) с наличием галактозного остатка.
Анализ мембранных гликосфинголипидов показал, что Gb3 отсутствует на эритроцитах нулевого фенотипа р, однако содержится в повышенном количестве на эритроцитах Pk+ (Koscielak и соавт. [85], Marcus и соавт. [107]). Как было показано Nudelman и соавт. [128], моноклональные антитела анти-Рк хорошо связываются с Gb3.
Brodin и соавт. [18] получили несколько образцов мышиных моноклональных анти-Рк-антител иммунизацией животных синтетическими гликопротеина-ми с присоединенной трисахаридной группировкой Galal —> 4Gaipi Щ Clc.
При изучении мембранных гликосфинголипидов, выделенных из эритроцитов Pj и Р2, установлено присутствие на обоих типах клеток глобозида 3 в качестве общего компонента мембраны (Naiki, Markus [124, 125], Markus и соавт. [105, 106]). Полученные авторами данные свидетельствуют о том, что антиген Рк в действительности встречается чаще, чем это было ранее показано с помощью серологических методов исследования.
Антиген Р (глобозид)
Гликопротеины, угнетающие активность антител анти-Р 1!и анти-Рк, не реагировали с антителами анти-Р. Причина такого реагирования вскоре стала понятной. Naiki и Matson [125], используя технику ингибиции антител, установли, что антиген Рк представлен глобозидом 3 (Gb3), а антиген Р - глобозидом 4 (Gb4). Было показано, что Gb4 отсутствует на эритроцитах Рк и содержится в следовых количествах на клетках р (Kundu и соавт. [86], Marcus и соавт. [107]).
Глобозиды являются наиболее представительными мембранными гликоли-пидами: на одной клетке может присутствовать до 14 млн молекул (Anstee [6, 8], Fletcher и соавт. [45]). Вариант глобозида Gb3 (Pk) содержит дополнительный N-ацетилгалактозаминовый остаток (см. табл. 7.2).
Моноклональные антитела анти-Р ингибировались глобозидами, имеющими терминальные группировки GalNAcpl —> 3Galal —> 4Gal и Gaipi —> 3GalNAcpi —> 3Gal (Kannagi и соавт. [73]). Один из образцов моноклональных анти-Р-антител нейтрализовался иммуносорбентом Galpl Щ 3GalNAc-R, обладающим специфичностью Т-антигена (Inglis и соавт. [66]). Анти-Р-антитела аллогенного происхождения с указанным дисахаридом не реагировали.
Эритроциты р, несмотря на отсутствие в их мембране глобозидов Gb3 и Gb4, каких-либо морфологических и функциональных отклонений от нормы не имеют. Они содержат лактозилцерамид и другие комплексные гликолипиды в более высокой концентрации, чем эритроциты PI.
Высокая концентрация глобозидов зарегистрирована в почках
Антиген LKE
Антиген LKE [см. Антиген LKE (Luke)] перекрестно реагирует с монокло-нальными антителами к мышиному стадиоспецифическому эмбриональному антигену (SSEA-4). Химическая структура позволила отнести его к глобозидам (Daniels [37], Kannagi и соавт. [73]).
Подобно тому, как это имеет место в системе АВО, продуктом генов локуса Р являются не сами антигены, а гликозилтрансферазы. Антигены, распознаваемые специфическими антителами, образуются в результате присоединения углеводных группировок к терминальным участкам субстрата-предшественника. Возникновение нулевого фенотипа р связано с мутациями гена a4Gal-T(табл. 7.3).
Таблица 7.3
Молекулярная основа фенотипа р*
|
Позиция нуклеотидных и аминокислотных замен |
Популяция |
|
Экзон 2 С 752 Т, Pro 251 Leu; G 903 С, Pro 301 Pro |
Японцы |
|
Экзон 2 A 109 G, Met 37 Val; С 752 T; Pro 252 Leu; G 987 A, Thr 329 Thr |
Японцы |
|
Экзон 2 T 548 A, Met 183 Lys |
Шведы |
|
Экзон 2 T 548 A, Met 183 Lys; 987 G > A, Thr 329 Thr |
Шведы |
|
Экзон 2 G 560 A, Gly 187 Asp |
Шведы |
|
Экзон 2 G 783 A, Trp 261, возникновение стоп-кодона |
Японцы |
|
Экзон 2 237-239 делеция СТТ, делеция Phe 81 |
Японцы |
|
Экзон 2 1029-1030 ins С, изменение рамки считывания с образованием продукта, состоящего из 92 дополнительных аминокислот |
Японцы |
* По Reid, Lomas-Francis [136].
Pk -синтаза
Ген a4Gal-Tl9 обусловливающий фенотипические различия Р1иР2, картирован на хромосоме 22 (22ql3.2). В этом регионе секвенирован участок, кодирующий а1,4-галактозилтрансферазу, которая присоединяет галактозу к лак-тозилцерамиду (глобозиду 2) с образованием глоботриозилцерамида (глобозида 3), или антигена Pk(Gb3) (Furukawa и соавт. [50], Steffenson и соавт. [155]). Ген a4Gal-Tl представлен двумя экзонами, его гомологи, помимо млекопитающих, найдены у насекомых и растений (Keuch и соавт. [79]).
Р-синтаза
В последние годы удалось картировать и клонировать ген, кодирующий трансферазу p3GalNAc-Tl. Указанный фермент обеспечивает присоединение iV-ацетилгалактозаминового остатка к глобозиду 3 (Рк), в результате чего происходит превращение вещества Ц в антиген Р (Almeida и соавт. [4, 5],
Kijimoto-Ochiai и соавт. [82], Okajama и соавт. [129]). Ген p3GalNAc-Tl независим от других групповых антигенов крови, он представлен одним экзоном, расположенным в позиции 3q25. Последнее послужило основанием присвоить антигену Р статус групповой системы эритроцитов - GLOB (028) [136]. Вещество Р присутствует в различных тканях организма: головном мозге, миокарде, легких, тестикулах, почках, печени, селезенке, желудке, плаценте. Степень экс-|ессии в органах варьирует в широких пределах.
Р1-синтаза
Считается, что Р1-синтаза представляет собой разновидность а1,4-галакто-зилтрансферазы, которая способна превращать параглобозид в антигенную субстацию PI (Furukawa и соавт. [50], Steffenson и соавт. [155]) и, возможно, р (Iizuka и соавт. [64]).
Предложены 2 генетические модели биосинтеза вещества PI, Р и ассоциированных с ними антигенов, которые в той или иной мере объясняют зависимость Рр-фенотипа от синтеза глобозидов и параглобозидов (Fletcher и соавт. [45], Kundu и соавт. [89] и др.).
Одна из моделей, предложенная Graham и Williams [51], предполагает существование 2 локусов: Р и Р1.
Локус Р1 представлен тремя аллелями - Рк, Рки р:
- Рк кодирует а1,4-галактозилтрансферазу, которая превращает параглобозид и лактозилцерамид в вещества Рк и Р1;
- Р*кодирует а1,4-галактозилтрансферазу, способную преобразовать лактозилцерамид в вещество Рк;
- р - молчащий аллель, в присутствии которого антигены Рк и Р1 не образуются.
Локус Р представлен двумя аллелями: Р+ и Р~, последний из них - молчащий.
Согласно этой модели, у родителей р х Р2 не должно быть детей с группой Р1? что подтверждено результатами посемейных исследований.
Naiki и Marcus [124] предложили трехлокусную модель: Р, Рк и Р1 с вариантом Р7+. Эта модель допускает возможность рождения детей с группой ?{ у родителей р х Р2. Однако в действительности такой комбинации ни разу не наблюдали. Предположение о сцепленности генов Рк и Р1 на хромосоме не подтвердилось в экспериментах по секвенированию региона 22ql3.2 генома человека (Steffenson и соавт. [155]).
Антигенные детерминанты Р на эритроцитах представлены углеводными остатками гликосфинголипидов (табл. 7.2), олигопептидные цепи связаны с це-рамидом (Schenkel-Brunner [144]). Изучение биохимической структуры антигенов PI, Р и Рк показало, что субстанции Р и Рк не являются предшественниками антигена PL Синтез указанных антигенов происходит посредством двух различных механизмов: Рк и Р образуется из параглобозидов, причем Рк является предшественником Р, а Р1 - из глобозидов.
Структура гликосфинголипидов, ассоциированных с системой Р
|
Антиген |
Структура |
Терминальные углеводные группировки |
|
Р1 |
Лактозилцерамид (Gb2) |
GalP Ш 4Glc-Cer |
|
ПАРАГЛОБОЗИДЫ |
||
|
Параглобозид |
Galp й 4GlcNAcpl Н 3Galpl -> 4Glc-Cer |
|
|
Галактозилпараглобозид |
Galp И 4Galpl 4GlcNAc 31 W 3Galpl 5ji 4Glc-Cer |
|
|
Сиалозилпараглобозид |
NeuAca2 3Galpl 4GlcNAcpi -> 3Gaipi-> 4Glc-Cer |
|
|
ГЛОБОЗИДЫ |
||
|
рк |
Глоботриозилцерамид (Gb3) |
Galal -► 4Gaipi £> 4Glc-Cer |
|
Р |
Глобозид |
GalNAcpl -> 3Galal 4Galpl -* 4Glc-Cer |
|
LKE, SSEA-4 |
Сиалозилгалактозилглобозид |
NeuAca2 3Gaipi & 3GalNAcpl & 3Galpl Ж 4Galpl 4Glc-Cer |
|
|
Дисиалозилгалактозилглобозид |
NeuAca2 -► 3Galpl Щ 3(NeuAco2 -> 6) GalNAcpl -»3 Galal -> 4Gaipi -> 4Glc-Cer |
|
Н |
Глобо-Н (тип 4Н) |
Fucal m 2Galpl 3GalNAcpl Ш 3Galal Щ 4Galpl r* 4Glc-Cer |
|
Антиген Форссмана |
(Gb5) |
Gal-NAcal i 3GalNAcpl 3Galal M 4Galpl 4Glc-Cer |
Антигены Р, относящиеся к параглобозидам
Параглобозид (лакто-Л^-неотетразилцерамид) является предшественником АВН-субстанций типа 2, некоторых ганглиозидов, а также антигена Р1. Первые сведения о природе Р-антигенов были получены в тестах с ингибицией специфических антител. Изучая ингибирующее действие моно-, ди- и трисахари-
дов на активность антител анти-Р 1, Morgan и Watkins [116, 168] показали, что специфическая активность всех Сахаров обусловлена a-D-галактозой. Авторы
получили из жидкости эхинококка овец гликопротеин, специфически ингибировавший анти-Р 1-антитела. При кислотном гидролизе указанного гликопротеина было установлено, что детерминанта Р1, распознаваемая антителами анти-Р 1, является трисахаридом: Galal Щ 4Galpl Щ 4GlcNAc (Cory и соавт. [33], Schenkel-Brunner [144]. '}
Антиген PI на эритроцитах представлен гликосфинголипидом - пента-мерным церамидом (см. табл. 7.2) с трисахаридным терминальным участком, распознаваемым специфическими антителами (Naiki и соавт. [122, 124]). Пространственная структура представляет собой параглобозид с дополнительным остатком а-галактозы. Трисахаридная структура, определяющая специфичность, обладала выраженным ингибирующим эффектом по отношению к моно-клональным анти-Р 1-антителам (Bailly и соавт. [10,11], Rouger и соавт. [139]).
Brodin и соавт. [18]) получили Р1-специфический трисахарид синтетическим путем и с успехом использовали для иммунизации мышей с целью получения моноклональных антител. Синтетический трисахарид, коньюгированный с иммуносорбентом, извлекал антитела анти-Р 1 из аллоиммунных сывороток (Cowles и соавт. [34]).
Описаны антитела, реагирующие с эритроцитами нулевого фенотипа р. Эти антитела специфически ингибировались сиалозилпараглобозидом (Metaxas и соавт. [Ill], Schwarting и соавт. [145]), терминальная часть которого содержала остатки сиаловых кислот. Упомянутый сиалозилпараглобозид найден в высокой концентрации на эритроцитах лиц, имеющих нулевой фенотип р. При этом синтез вещества Pk (Gb3) блокирован.
Антигены Р, относящиеся к глобозидам
Антигены Р, Рк и Р1 между собой тесно связаны, однако имеют разную природу: Р и Рк относятся к глобозидам, а Р1 - к параглобозидам. На эритроцитах они представлены гликолипидами, в жидкости эхинококковых кист они присутствуют в составе гликопротеинов.
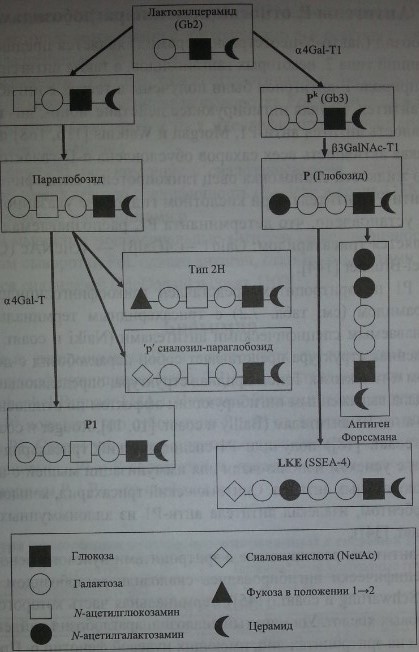
Используя очищенные гликолипиды для ингибиции антител анти-РР1Рк, Naiki и Matson [125], Yang и соавт. [175] установили, что глобозид и тригек-созид церамида (Gb3) свойственны эритроцитам, несущим антигены Р и Рк. Субстанция Рк трансформируется в антиген Р, а антиген Р1 синтезируется на основе параглобозидов (рис. 7.1).
Синтез антигенов Р и GLOB по Daniels