Herron и Smith [53] посредством иммунопреципитации субстрата антителами анти-Xg3 установили, что антигенные эпитопы Xga эритроцитарной мембраны относятся к сиалогликопротеинам. Установлена мол. масса вещества (22,5-28 кДа). Обработка эритроцитов сиалидазой приводила к уменьшению мол. массы. Гликопротеин, определяющий специфичность Xg, тесно связан с белком CD99 (Petty, Tippett [71 ], Fouchet и соавт.
Кодируемый геном XG протеин состоит из 180 аминокислот. Экстрацеллюлярный N-терминальный домен включает 142 аминокислоты, содержит 16 участков О-гликозилирования, но не имеет участков N-гликозилирования. Остальная часть Xg-протеина представлена трансмембранным и црггоплазматическим С-терминальным доменами (рис. 14.1) (Ellis и соавт. [32]).
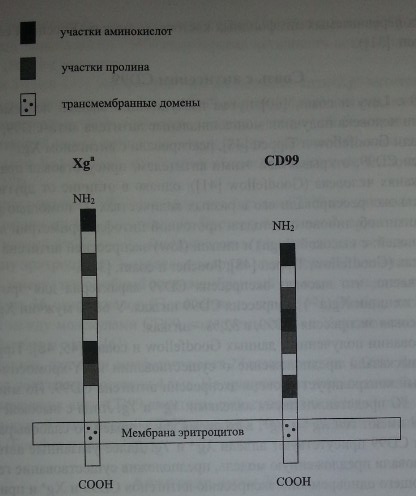
Строение гликопротеинов Xga и CD99

Строение гликопротеинов Xga и CD99
Транскрипты гена XG, помимо эритроидных клеток и фибробластов, выявлены в скелетных мышцах, сердце, плаценте, клетках предстательной и щитовидной желез, позвоночнике и трахее (Fouchet и соавт. [37]), Некоторое количество транскриптов XG обнаружено в легких, почках, яичке, а также в тканях плода и некоторых перевиваемых лимфоидных клеточных линиях.



