Система Colton (Колтон) представлена тремя антигенами. Два из них, Соа (частый) и Соь (редкий), находятся в антитетичных отношениях. Третий антиген, СоЗ, присутствует на всех эритроцитах, за исключением эритроцитов лиц с нулевым фенотипом, Со(а-Ь-) (табл. 17.1). Групповые детерминанты Colton расположены на белке, получившем название аквапорин-1 (AQP-1).
Генный локус СО картирован на коротком плече хромосомы 7. Нулевой фенотип Со(а-Ь-) может быть обусловлен моносомией по хромосоме 7. Антигенные различия Colton обусловлены одиночными мутациями гена СО, приводящими к замене аланина в позиции 45 валином.
Таблица 17.1
Антигены Colton
|
Обозначение |
Частота |
Примечание |
|
|
традиционное |
ISBT |
||
|
Соа |
С01 |
Высокая |
Антитетичен Со\ Ala 45 |
|
Соь |
С02 |
Низкая |
Антитетичен Соа, Val 45 |
|
СоЗ |
СОЗ |
Очень высокая |
Отсутствует у лиц Со(а-Ь-) |
Негликозилированный вариант AQP-1 имеет мол. массу 28 кДа, гликозили-рованный - от 40 до 60 кДа (Denker et al [14]. Количество молекул AQP-1 на одну клетку составляет 120-160 тыс.
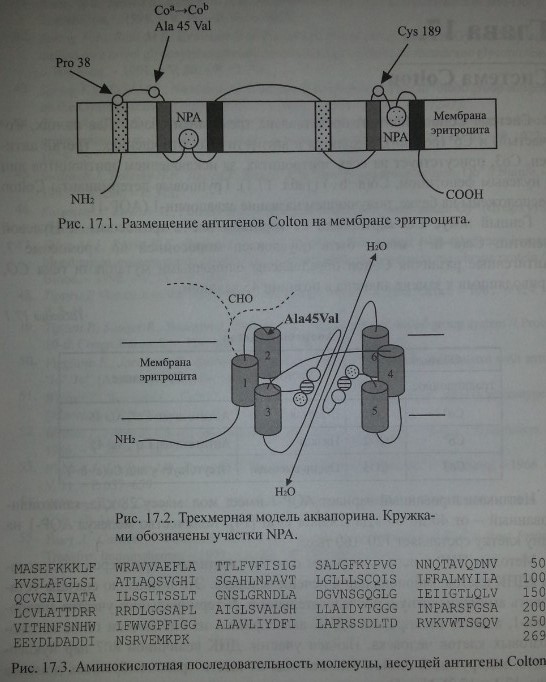
Методом ПЦР с использованием олигонуклеотидных праймеров исследована кДНК клеток эмбриональной печени человека. Это позволило сначала установить аминокислотную последовательность N-терминального участка аквапо-рина-1, а затем изолировать кДНК аквапорина-1 из библиотеки генов костномозговых клеток человека. Найден участок ДНК величиной 807 пар нуклео-тидов, кодирующий синтез полипептида из шести трансмембранных доменов (рис. 17.1 и 17.2). N- и С-терминальные участки полипептида расположены внутри клетки (Preston, Agre [43]). Полипептид, несущий антигены Colton, состоит из 269 аминокислот (рис. 17.3).
Обе половины молекулы аквапорина (по три трансмембранных домена в каждой) имеют участки NPA со сходной последовательностью аминокислот. Согласно предложенной трехмерной модели, участки NPA между трансмембранными доменами образуют канал транспорта воды и функционируют как целое.
Система Colton
Система Colton (Колтон) представлена тремя антигенами. Два из них, Соа (частый) и Соь (редкий), находятся в антитетичных отношениях. Третий антиген, СоЗ, присутствует на всех эритроцитах, за исключением эритроцитов лиц с нулевым фенотипом, Со(а-Ь-) (табл. 17.1). Групповые детерминанты Colton расположены на белке, получившем название аквапорин-1 (AQP-1).
Генный локус СО картирован на коротком плече хромосомы 7. Нулевой фенотип Со(а-Ь-) может быть обусловлен моносомией по хромосоме 7. Антигенные различия Colton обусловлены одиночными мутациями гена СО, приводящими к замене аланина в позиции 45 валином.
Таблица 17.1
Антигены Colton
|
Обозначение |
Частота |
Примечание |
|
|
традиционное |
ISBT |
||
|
Соа |
С01 |
Высокая |
Антитетичен Со\ Ala 45 |
|
Соь |
С02 |
Низкая |
Антитетичен Соа, Val 45 |
|
СоЗ |
СОЗ |
Очень высокая |
Отсутствует у лиц Со(а-Ь-) |
Негликозилированный вариант AQP-1 имеет мол. массу 28 кДа, гликозили-рованный - от 40 до 60 кДа (Denker et al [14]. Количество молекул AQP-1 на одну клетку составляет 120-160 тыс.
Методом ПЦР с использованием олигонуклеотидных праймеров исследована кДНК клеток эмбриональной печени человека. Это позволило сначала установить аминокислотную последовательность N-терминального участка аквапо-рина-1, а затем изолировать кДНК аквапорина-1 из библиотеки генов костномозговых клеток человека. Найден участок ДНК величиной 807 пар нуклео-тидов, кодирующий синтез полипептида из шести трансмембранных доменов (рис. 17.1 и 17.2). N- и С-терминальные участки полипептида расположены внутри клетки (Preston, Agre [43]). Полипептид, несущий антигены Colton, состоит из 269 аминокислот (рис. 17.3).
Обе половины молекулы аквапорина (по три трансмембранных домена в каждой) имеют участки NPA со сходной последовательностью аминокислот. Согласно предложенной трехмерной модели, участки NPA между трансмембранными доменами образуют канал транспорта воды и функционируют как
Сист
Первая экстрацеллюлярная петля молекулы аквапорина может быть N-гликозилирована и, подобно протеину полосы 3, обладать АВН-антигенной активностью (Smith и соавт. [52]).
Ген AQP-1 локализован в позиции 7р14, имеет величину 17 кб и представлен четырьмя экзонами (рис. 17.4), кодирующими аминокислоты в позициях 1-128
Вскоре после обнаружения того факта, что локусы СО и AQP-1 находятся в одном и том же участке хромосомы 7, были получены новые данные. Установлено, что антитела анти-Соа и анти-Соь могут избирательно преципитировать молекулы аквапорина на эритроцитах, содержащих антиген Соа или
Соь соответственно (Smith и соавт. [52]). Анти-СоЗ-антитела позволяли посредством иммунопреципитации выделить аквапорин из эритроцитов Со(а+Ь-) и Co(a-b+).
СоаиСоь
В 1967 г. Heisto и соавт. [19] сообщили о выявлении трех образцов сывороток, открывавших новый антиген с высокой частотой встречаемости. Антиген был обозначен как Соа, или Colton, по имени первого пробанда. Любопытен тот факт, что в действительности его фамилия была Calton, но она, как отметили Reid и Lomas-Francis [46], была неразборчиво написана на пробирке с кровью.
Тремя годами позже Giles и соавт. [18] идентифицировали антитела, открывавшие антиген Соь, антитетичный Соа.
С использованием сыворотки анти-Соа обследованы 1706 американских негров, все оказались Соа+ (Race, Sanger [45]). Среди 13 460 европейцев (жителей стран Северной Европы, США и Канады), обследованных разными авторами, выявлены 27 человек Со(а-) (Heisto и соавт. [19], Lewis и соавт. [30], Race, Sanger [45]), Smith и соавт. [53], (Wray, Simpson [58]). Частота антигена Соа, таким образом, составила 99,8 %.
Сыворотка анти-Соь использована при обследовании 799 испанцев, проживающих в Майами (Issitt и соавт. [23]), 100 канадских индейцев племени кри (Lucciola и соавт. [31]) и 2244 японцев (Nagao и соавт. [38]. Частота выявления антигена Соь в указанных популяциях составила 4,6 %, 2 % и 0,22 % соответственно.
Из 5186 доноров, обследованных Giles и соавт. [18] в Англии, Lewis и соавт. [30] в Канаде, Case [7], Brackenridge и соавт. [5] в Австралии и Новой Зеландии, 443 (8,5 %) имели фенотип Со(Ь+) (табл. 17.2).
Результаты посемейных исследований [19, 30,45] свидетельствуют, что гены Со и Соb наследуются кодоминантно.
Описаны две семьи с необычным характером наследования генов Соа и Cob (Moulds и соавт. [35], Swanson, Eckman [55]). Количественное исследование антигенов эритроцитов членов этих семей путем титрования антител анти-Соа и анти-СоЗ показало, что они несли по одной дозе указанных антигенов, что, по-видимому, было обусловлено передачей от одного из родителей молчащего аллеля Со.Таблица 17.2
Частота признаков Colton у европеоидов
|
Частота, % |
||
|
антигена |
гена |
генотипа |
|
Соа 99,8 |
Соа 95,5 |
CoVCo* 91,2 Coa/Cob 8,6 |
|
Соь 8,5 |
Соь 4,5 |
Cob/Cob 0,2 |
Антигенный полиморфизм Colton связан с заменой нуклеотидов С 134 Т в экзоне 1 гена СО. Аллель Соа кодирует аланин в позиции 45, в то время как при наличии гена Соъ это положение занимает валин. Антигенные эпитопы Colton расположены на экстрацеллюлярной петле второго домена AQP-1 (см. рис. 17.1 и 17.2) вблизи участка N-гликозилирования Asn 42. Нарушение процесса глико-зилирования влияет на экспрессию антигенов Colton (Smith и соавт. [52]).
Антигены Соа и Соь устойчивы к действию протеолитических ферментов: папаша, трипсина, химотрипсина, проназы, сиалидазы и сульфгидрильных реагентов.
Dunstan [15], используя метод проточной цитофлюориметрии, показал, что антиген Соа отсутствует на лимфоцитах, моноцитах и гранулоцитах.
Антиген Соь полностью развит на эритроцитах к моменту рождения (Henke и соавт. [20]).
СоЗ
В 1974 г. Rogers и соавт. [47] идентифицировали фенотип Со(а-Ь-). Его обнаружение было ожидаемым. Указанная редкая группа крови была установлена у жительницы Канады французского происхождения и у 2 из ее 4 сибсов. Родители женщины и 2 других сибса имели фенотип Со(а+Ь-). Сыворотка крови женщины содержала анти-СоЗ-антитела, которые реагировали со всеми образцами эритроцитов, за исключением собственных эритроцитов и 2 ее сибсов. Исследования методом адсорбции - элюции показали, что анти-СоЗ-антитела не являются простой смесью антител анти-Соа и анти-Соь, а представляют собой несепарируемый комплекс анти-СоаЬ. Активность этих антител полностью истощалась посредством адсорбции эритроцитами как Со(а+Ь-), так и Со(а-Ь+). Элюаты с эритроцитов Со(а+Ь-) реагировали перекрестно с эритроцитами Со(а-Ь+) и, наоборот, элюаты с эритроцитов Со(а-Ь+) реагировали с эритроцитами Со(а+Ь-).
Вслед за Rogers и соавт. [47] другие исследрватели описали 5 лиц с нулевым фенотипом Со(а-Ь-), не состоявших в родстве. Все они были европейцами и были выявлены в связи с обнаружением у них анти-СоЗ-антител (Fuhrmann и соавт. [17], Theuriere и соавт. [56], Savona-Ventura и соавт. [49], Lacey и соавт. [27], Chretien и соавт. [9]).
Поиск других лиц с нулевым фенотипом Colton среди 40 тыс. американских, 9 тыс. австралийских и 2 тыс. финских доноров не дал положительного результата (Lacey и соавт. [27]).
Молекулярно-генетическое обследование лиц Со(а-Ь-) показало, что указанный редкий фенотип могут обусловливать четыре фактора:
- Гомозиготность по полной или частичной делеций экзона 1 гена СО (Preston и соавт. [44]).
- Гомозиготность по вставке одной пары нуклеотидов в позиции 307 экзона 1 (Preston и соавт. [44]). Оба фактора блокировали синтез аквапорина. Его не удавалось обнаружить на эритроцитах методом иммуноблоттин-га (Preston и соавт. [44]).
- Гомозиготность по мутации С 614 А в экзоне 3, которая приводит к аминокислотной замене Asn 192 Lys в экстрацеллюлярном участке третьего домена аквапорина с преобразованием аминокислотной последовательности Asn-Pro-Ala в Lys-Pro-Ala (Chretien и соавт. [9]). При таких изменениях протеин утрачивает способность транспортироваться к поверхности мембраны эритроцита. Двое детей пробанда Со(а-Ь-) были гетерозиготны по мутации С 614 А, в результате чего имели фенотип Со(а+Ь~).
- Гомозиготность по мутации С 113 Т в экзоне 1 с аминокислотной заменой Pro 38 Leu (Preston и соавт. [44]). В этом случае на эритроцитах выявлялись следовые количества аквапорина. Эритроциты давали слабоположительные реакции с мощными (титр 1 :32 ООО) анти-СоЗ-антителами (Lacey и соавт. [27]).
У лиц Со(а-Ь-) эритроциты были нормальными по физиологическим показателям, содержание гемоглобина и гематокрит были в пределах нормы, отмечено уменьшение продолжительности жизни эритроцитов in vivo (Mathaj и соавт. [33]).
Эритроциты одного ребенка с редкой формой конгенитальной дизэритропоэ-тической анемии без мутаций гена AQP-1 содержали аквапорин-1 в количестве менее 10 % от нормы, были Со(а-Ь-), однако при этом реагировали с анти-СоЗ-антителами (Parsons и соавт. [41], Agre и соавт. [2]). Эритроциты ребенка, так же как и его родителей, были дефицитны по содержанию CD44, имели группу In(a-b-) AnWj - по системе Indian, слабый антиген LWab системы LW, обладали очень низкой проницаемостью для воды. Эритроциты больных с другими формами конгенитальной дизэритропоэтической анемии содержали нормально выраженные антигены Colton.
Антиген СоЗ, как и факторы Соа и Соь, устойчив к действию протеолитиче-ских ферментов и сульфгидрильных реагентов.



