Banks и соавт. [1], Spring и соавт. [42, 43] посредством перекрестной иммунопреципитации показали, что антигенные детерминанты Doa, Gya, Ну и Joaрасположены на одном и том же экстрацеллюлярном гликопротеине (рис. 16.1), имеющем мол. массу 46,75-57,5 кДа. Обработка эритроцитов эндогликозила-зой F приводила к уменьшению мол массы гликопротеина до 11 кДа, что свидетельствовало о N-гликозилировании изучаемого субстрата. Вместе с тем протеин Dombrock не подвергался О-гликозилированию.
Строение гликопротеина Dombrock.
В процессе иммунопреципитации предположительно выделялись также ди-меры указанных соединений.
В экспрессии антигенов Gya и Ну участвуют дисульфидные связи. При обработке сульфгидрильными реагентами мол. масса гликопротеина уменьшалась до 40-50 кДа и он быстрее мигрировал в полиакриламидном геле в присутствии додецил-сульфата.
Gubin и соавт. [9] провели скрининг базы данных, включающих около 5000 нуклеотидных последовательностей хромосом, полученных из дифференцирующихся эритроидных клеточных линий. Оказалось, что синтез ГФИ-ассоциированных протеинов кодируют гены, расположенные на хромосоме 12.
Идентифицирован фрагмент ДНК, который, по-видимому, и является геном Dombrock. Трансфекция этого фрагмента в эритролейкемические клетки К562 приводила к экспрессии на их поверхности антигенов Doa, Gya, Ну и Joa (Gubin и соавт. [9]).
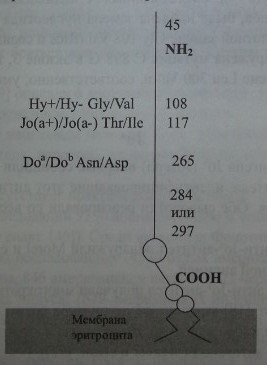
Локус DO имеет величину 14 кб, состоит из трех экзонов (рис. 16.2) и кодирует синтез протеина, состоящего из 314 аминокислот (рис. 16.3). Экзон 1 кодирует аминокислоты в позиции 1-45, экзон 2 - в позиции 49-285, экзон 3 - в позиции 286-314, включая ГФИ-ассоциированный фрагмент из 17 аминокислот (Reid, Lomas-Francis [35]).

Аминокислотная последовательность гликопротеина Dombrock.
Обследование индивидов Do(a+) и Do(a-) с использованием молекулярно-генетических методов показало, что антигенные различия Doa/Dob обусловлены нуклеотидной заменой А 793 G в экзоне 2 гена DO (Gubin и соавт. [9], Rios и соавт. [36]). Последняя приводит к аминокислотной замене Asn 265 Asp (табл. 16.4). Два других замещения нуклеотидов, приводящие к появлению аминокислотных остатков Туг 126 и Leu 208, также связаны с различиями Doa/Dob. Антигенные различия Ну+/Ну- и Jo(a+)/Jo(a-) обусловлены заменами Gly 108 Val и Thr 117 Не.
РНК-транскрипты гена DO обнаруживали в селезенке, лимфатических узлах, костном мозге и эмбриональной печени; в тимусе и лейкоцитах периферической крови они отсутствовали (Gubin и соавт. [9]). Они не выявлялись в течение первых 4 дней культивирования клеток периферической крови человека в присутствии эритропоэтина
Молекулярная основа антигенов Dombrock
|
Фенотип'' |
Замена нуклеотидов |
Экзон |
Замена аминокислот |
|
Doa/Dob |
A793G |
2 |
Asn 265 Asp |
|
Ну+/Ну- |
G323T |
2 |
Gly 108 Val |
|
Jo(a+)/Jo(a-) |
С350Т |
2 |
Thr117 He |
Биологическая функция
Продукт аллеля Dob содержит аминокислотную последовательность Arg -Gly - Asp, характерную для молекул клеточной адгезии. Аллель Do" кодирует в том же участке фрагмент с другой последовательностью аминокислот, Arg -Gly - Asn, что может повлиять на адгезивную способность субстрата.
Экзон 2 локуса DO содержит участок, характерный для генов, контролирующих синтез аденозиндифосфатрибозилтрансферазы (АДФ-трансферазы) (Koch-Nolte, Haag [16]). Возможно, гены Dombrock способны модифицировать этот фермент и таким образом влиять на его функциональную активность (Gubin и соавт. [9]).
Spring и соавт. [42, 43], Telen и соавт. [47] наблюдали у больных пароксиз-мальной холодовой гемоглобинурией две популяции эритроцитов, одна из которых была лишена ГФИ-ассоциированных протеинов и не содержала антигенов Dombrock. Эти эритроциты были более чувствительны к комплементу.



