После открытия групповых антигенов возникла проблема установления их структуры. Задачей иммунохимиков в области групп крови человека являлось выделить и охарактеризовать структуры, ответственные за специфические свойства веществ, обладающих антигенной активностью, и объяснить, почему они независимы в серологических реакциях.
Выделение антигенов А и В из эритроцитов оказалось непростой задачей. На эритроцитах и других клетках они представлены в водонерастворимой форме. Их удалось выделить экстракцией этанолом. Однако вскоре выяснилось, что эти вещества содержатся во многих органах и тканях организма человека, при этом они растворимы в воде. Для их выделения к 5 г различных тканей добавляли 25 мл воды, экстракт кипятили в течение 10 мин и затем центрифугировали. Полученный осадок растворяли в 2,5 мл изотонического раствора натрия хлорида. О присутствии субстанций А и В судили по способности экстрактов угнетать активность анти-А- и/или анти-В-антител (Freidenreich и Hartmann, 1938).
Эти и другие подобные исследования позволили установить, что наибольшее количество вещества А и В содержится в секреторных тканях (слизистая оболочка желудка, слюнные железы, жидкость кист яичников) и в меконии.
Эти же вещества были выделены из стенок желудков лошадей, коров и свиней. Процедуру чаще выполняли замораживанием - оттаиванием экстрактов с последующим растворением высушенного осадка в охлажденном 90% растворе фенола. Фракция, не поддававшаяся растворению, обладала наибольшей антигенной активностью. Высокой степени очистки удавалось добиться ультрацентрифугированием и использованием органических растворителей, например этанола. Оказалось, что по своей природе группоспецифические вещества А, В и Н являются мукополисахаридами, содержащими приблизительно 85 % углеводов и 15 % белков. Мягкий кислотный гидролиз приводил к исчезновению специфической активности субстрата. При этом высвобождались сахара. Изучение структуры полисахаридов клеточных мембран бактерий подтвердило их антигенные различия, обусловленные именно присутствием тех или иных терминальных углеводных группировок.
Существенный прогресс в изучение природы веществ А, В и Н внесли работы Watkins’а и Morgan’а, показавших присутствие анти-Н-подобных агглютининов в сыворотке угря. Последние вызывали агглютинацию эритроцитов человека группы О. Их активность ингибировалась L-фукозой. При последующих исследованиях обнаружено, что способность анти-А-лектинов агглютинировать эритроциты А устраняется добавлением в них Ы-ацетил-О-галакгозамина. Анти-В-антитела нейтрализовались D-галакгозой соответственно. Эти результаты были подтверждены при использовании экзогликозидаз, выделенных из Trichomonas foetus и Clostridium welchii. Указанные ферменты разрушали вещества А, В и Н. В то же время активность этих ферментов устраняли К-ацетил-Б-галакгозамин, D-галактоза и L-фукоза соответственно, что указывало на химическую природу группового вещества.
В настоящее время химическая структура групповых веществ хорошо изучена (рис. 3.6).
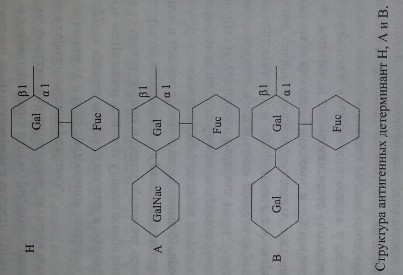
Антигены систем АВО и Н представляют собой олигосахаридные цепи, связанные с полипептидами (гликопротеины) или церамидами (гликосфинго- липиды).
Выделяют 2 класса олигосахаридных цепей, которые экспрессируют АВН- антигены. Первый из них представлен N-гликанами - разветвленными структурами, связанными через аминогруппы аспарагина, и N-ацетилглюкозамин. Второй класс представлен О-гликанами, имеющими простую или сложную структуру, связывание в них происходит через гидроксильные группы серина или треонина также через N-ацетилглюкозамин.
Гликосфинголипиды (углеводные цепи, присоединенные к церамиду) подразделяют в зависимости от биохимической природы на глобозиды, лактозиды и ганглиозиды.
Основная масса антигенов Н, А и В организма представлена гликопротеинами, доля гликосфинголипидов существенно меньше.
Антигены Н, А и В формируются трансферазами, которые присоединяют соответствующие моносахариды к цепям-предшественникам.
Н-антиген представлен L-фукозой, присоединенной в позиции С-2 терминального галактозного остатка.
А- и В-антигены появляются в результате присоединения к фукозилиро- ванному галакгозному остатку (Н-антигену) N-ацетил-Б-галактозамина или D-галактозы в позиции С-3. Хотя структура Н-антигена представлена не только фукозой, данная группировка считается иммунодетерминантной, поскольку де- фукозилирование приводит к утрате Н-серологической активности субстрата. Аналогичным образом 1Ч-ацетил-0-галактозамин и D-галактозу относят к имму- нодетерминантным структурам, определяющим А- и В-серологическую активность соответственно (Schenkel-Brunner [195]).
Выделяют шесть типов АВН-активных цепей (типы 1 - 6). Цепи типа 1 присутствуют в секретах, плазме и тканях энтодермального происхождения. Цепями типа 2 представлено большинство АВН-активных олигосахаридов на эритроцитах и в тканях экто- и мезодермального происхождения. Тип 3 несет антигенные детерминанты в гликолипидах эритроцитной мембраны и в муцине у индивидов группы A (Anstee [68]). Тип 4 связан с гликолипидами и представлен в небольшом количестве на эритроцитах (Anstee [68], Daniels [87], Schenkel-Bnmner [195]). Тип 6 присутствует в виде свободных олигосахаридов в грудном молоке и моче. Цепи 5-го типа в организме не встречаются, они синтезированы искусственно (Daniels [87], Schenkel-Brunner [195]).
Синтез Н-антигена происходит при участии а1,2-Ь-фукозилтрансферазы, которая обеспечивает перенос фукозы от гуанозин-дифосфата (ГДФ) к галактоз- ному остатку цепи-предшественника в позиции С-2. Известны 2 типа al,2-L- фукозилтрансферазы, синтез каждого из них контролируют высокогомологичные, однако генетически независимыме друг от друга локусы FUT1(H) и FUT2(SE). Они расположены на хромосоме 19. Продукты указанных генов (ферменты) обеспечивают фукозилирование и образование Н-активных структур в различных тканях. FUT1(H) обладает большей аффиностью к цепям типа 2, в то время как FUT2(SE) - к цепям 1-го типа. У подавляющего большинства людей антиген Н присутствует в обязательном порядке, Н-дефицитные фенотипы очень редки.
Н-антиген, образовавшийся в результате действия al ,2-Ь-фукозилтрансфераз, является субстратом для дальнейшего шикозилирования А- и В-специфическими трансферазами, обеспечивающими присоединение иммунодетерминантных группировок: М-ацетил-О-галактозамина и/или D-галакгозы, после чего субстрат приобретает А- и/или В-антигенные свойства.
Гены, контролирующие А- и В-трансферазы, независимы от локусов FUT1(H) и FUT2(SE), картированы на хромосоме 9, в локус АВО. Последний нередко содержит молчащие аллели О1, О2 и др., в присутствии которых синтеза А- и В-трансфераз не происходит. У лиц, гомозиготных по таким аллелям, вещество Н не конвертируется далее в антигены А.
Присутствие Н-, А- и В-трансфераз в сыворотке крови и на эритроцитах устанавливают с помощью специфических антител, которые нередко образуются после трансплантации органов (Eiz-Vesper и соавт. [96]).
Н. В. Бовин и др. (1990) создали искусственные А- и В-субстанции биохимическим синтезом, однако они, несмотря на их структурное сходство с естественным группоспецифическим веществам, не нашли применения, поскольку их адсорбционная активность в отношении а- и (3-изогемаагглютининов была низкая.