Telen и соавт. [47] показали, что большинство образцов анти-У^-антител не реагирует с фракцией комплементчувствительных эритроцитов больных парок-сизмальной ночной гемоглобинурией (ПНГ), однако взаимодействует с фракцией эритроцитов, не чувствительных к комплементу. Установлено, что упомянутые комплементчувствительные эритроциты в значительной степени лишены глико-зилфосфатидилинозитола (ГФИ). У двух больных ПНГ комплементчувствительные эритроциты были Yt(b+). Эти результаты интерпретированы авторами как указание на то, что эпитопы YtaH Ytb несет ГФИ-ассоциированный гликопротеин.
В 1991 г. Spring и соавт. [45] показали, что антигены Cartwright на эритроцитах несет ГФИ-ассоциированный гликопротеин АХЭ (см. рис. 13.1). Путем иммунопреципитации антителами aHTH-Yta и анти-Yt15 выделен субстрат с мол. массой 72 кДа. По электрофоретической подвижности он был идентичен веществу, выделенному с помощью моноклональных антител к АХЭ эритроцитов. Субстрат обладал ацетилхолинэстеразной активностью, о чем свидетельствовали результаты экспериментов Petty [36] с иммобилизацией моно- и поликло-нальных антител анти-Yt3 и анти-Yt15.
АХЭ эритроцитов подвергается TV-гликозилированию. Как установили Spring и соавт. [45], обработка субстрата, выделенного посредством иммунопреципитации, N-гликаназой приводила к уменьшению его мол. массы с 72 до 63 кДа. С помощью МКА к АХЭ установлено, что один эритроцит несет 3-5 тыс. АХЭ-участков. При использовании для аналогичных исследований Fab-фрагментов указанных антител выявлено 7-10 тыс. участков связывания. Это дало основания Spring и соавт. [45] полагать, что АХЭ присутствует в мембране эритроцитов в форме димера.
Как указывалось выше, АХЭ играет важную роль в передаче нервных импульсов в исполнительные органы и ткани. Ацетилхолин обеспечивает передачу электроимпульсных сигналов от терминальных участков нервов в мышечные клетки. Затем ацетилхолин быстро разрушается АХЭ путем гидролиза для прекращения последующей передачи нейроимпульсов.
АХЭ присутствует в различных тканях в разных изоформах, обусловленных альтернативным сплайсингом гена ACHE (Taylor [46], Li и соавт. [29]). Фрагменты кДНК гена ACHE обнаружены в библиотеке генов из клеток фетальной мышечной ткани и нервной ткани взрослых лиц (Soreg и соавт. [44]). Полная кодирующая последовательность гена установлена Li и соавт. [29] при анализе космидной библиотеки генома человека.
Три экзона кодируют сигнальный пептид и N-терминальный участок, состоящий из 535 аминокислот (рис. 13.3). За счет альтернативного сплайсинга следующего экзона возникают структурные изменения в С-терминальном домене, позволяющие ГФИ присоединяться к эритроидным клеткам.
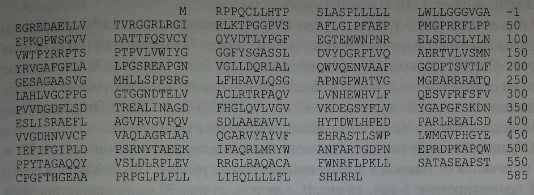
Аминокислотная последовательность протеина АХЭ